
- •Химическое равновесие
- •Термодинамика растворов
- •2 Химическая кинетика
- •2.1 Скорость химической реакции
- •2.1.2 Реакции нулевого порядка
- •2.1.3 Реакции первого порядка
- •2.1.4 Реакции второго порядка
- •2.1.5 Молекулярность элементарных реакций
- •2.1.6 Сложные реакции
- •2.1.7 Классификация сложных реакций
- •2.1.8 Влияние температуры на константу скорости реакции
- •2.1.9 Уравнение Аррениуса
- •2.1.10 Кинетика двусторонних (обратимых) реакций
- •2.1.11 Кинетика гетерогенных химических реакций
- •2.2 Фотохимические реакции
- •2.3 Каталитические процессы
- •2.3.1 Гомогенный катализ.
- •2.3.2 Автокатализ.
- •2.3.3 Гетерогенный катализ.
- •2.3.4 Ферментативный катализ.
Термодинамика растворов
Существование абсолютно чистых веществ невозможно – всякое вещество обязательно содержит примеси, или, иными словами, всякая гомогенная система многокомпонентна. Если имеющиеся в веществе примеси в пределах точности описания системы не оказывают влияния на изучаемые свойства, можно считать систему однокомпонентной; в противном случае гомогенную систему считают раствором.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми смесями). Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве либо компонент, кристаллизующийся первым при охлаждении раствора; если одним из компонентов раствора является жидкое в чистом виде вещество, а остальными – твердые вещества либо газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит поэтому условный характер.
Одной из важнейших характеристик раствора является его состав, описываемый с помощью понятия концентрация раствора. Ниже дается определение наиболее распространенных способов выражения концентрации и формулы для пересчета одних концентраций в другие, где индексы А и В относятся соответственно к растворителю и растворенному веществу.
Молярная концентрация С – число молей νВ растворенного вещества в одном литре раствора.
Нормальная концентрация N – число молей эквивалентов растворенного вещества (равное числу молей νВ, умноженному на фактор эквивалентности f) в одном литре раствора.
Моляльная концентрация m – число молей растворенного вещества в одном килограмме растворителя.
Процентная концентрация ω – число граммов растворенного вещества в 100 граммах раствора.
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
Еще одним способом выражения концентрации является мольная доля X – отношение числа молей данного компонента к общему числу молей всех компонентов в системе.
![]() (4)
(4)
ОБРАЗОВАНИЕ РАСТВОРОВ. РАСТВОРИМОСТЬ
Концентрация компонента в растворе может изменяться от нуля до некоторого максимального значения, называемого растворимостью компонента. Растворимость S – концентрация компонента в насыщенном растворе. Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом. Величина растворимости характеризует равновесие между двумя фазами, поэтому на неё влияют все факторы, смещающие это равновесие (в соответствии с принципом Ле Шателье – Брауна).
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Исторически сложились два подхода к образованию растворов – физическая теория, основы которой были заложены в XIX веке, и химическая, основоположником которой был Д.И.Менделеев. Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0; такие растворы принято называть идеальными). Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди СuSО4 в воде приводит к образованию окрашенного раствора, из которого выделяется не СuSО4, а голубой кристаллогидрат СuSО4·5Н2О). Современная термодинамика растворов основана на синтезе этих двух подходов.
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, к которым можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия одинаковых частиц EA-A и EB-B. Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы.
Растворимость газов в газах
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях (при очень высоких давлениях, когда плотность газов приближается к плотности жидкостей, может наблюдаться ограниченная растворимость). Газовые смеси описываются законом Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов.
![]() (5)
(5)
![]() (6)
(6)
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона:
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
![]() (7)
(7)
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе):
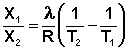 (8)
(8)
Как правило, при растворении газа в жидкости выделяется теплота (λ < 0), поэтому с повышением температуры растворимость уменьшается. Растворимость газов в жидкости сильно зависит от концентрации других растворенных веществ. Зависимость растворимости газов от концентрации электролитов в жидкости выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C):
![]() (9)
(9)
Взаимная растворимость жидкостей
В зависимости от природы жидкости могут смешиваться в любых соотношениях (в этом случае говорят о неограниченной взаимной растворимости), быть практически нерастворимыми друг в друге либо обладать ограниченной растворимостью. Рассмотрим последний случай на примере системы анилин – вода. Если смешать примерно равные количества воды и анилина, система будет состоять из двух слоев жидкости; верхний слой – раствор анилина в воде, нижний – раствор воды в анилине. Для каждой температуры оба раствора имеют строго определенный равновесный состав, не зависящий от количества каждого из компонентов.

Рис. 1. Диаграмма растворимости системы анилин – вода.
Зависимость концентрации растворов от температуры принято изображать графически с помощью диаграммы взаимной растворимости. Эта диаграмма для системы анилин-вода приведена на рис. 1. Область под кривой – это область расслаивания жидкостей. Повышение температуры приводит к увеличению концентрации каждого из растворов (увеличению взаимной растворимости), и при некоторой температуре, называемой критической температурой расслоения (Ткр на рис. 1) взаимная растворимость воды и анилина становится неограниченной. Система анилин – вода относится к т.н. системам с верхней критической температурой расслоения; существуют также и системы, для которых повышение температуры приводит к уменьшению взаимной растворимости компонентов.
Растворимость твердых веществ в жидкостях
Растворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры; сведения о растворимости твердых тел целиком основаны на опытных данных. Качественным обобщением экспериментальных данных по растворимости является принцип "подобное в подобном": полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот.
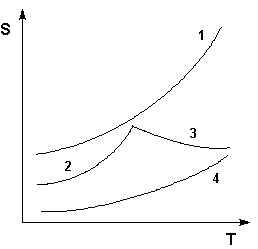
Рис. 2. Кривые растворимости некоторых солей в воде. 1 – КNО3, 2 – Nа2SО4·10Н2О, 3 – Nа2SО4, 4 – Ва(NО3)2.
Зависимость растворимости S от температуры обычно изображают графически в виде кривых растворимости (рис. 2). Поскольку теплота растворения твердых веществ в жидкостях может быть как положительной, так и отрицательной, растворимость при увеличении температуры может увеличиваться либо уменьшаться (согласно принципу Ле Шателье – Брауна).
Давление насыщенного пара растворов. Закон Рауля
Представим, что в равновесную систему жидкость А – пар введено некоторое вещество В. При образовании раствора мольная доля растворителя XА становится меньше единицы; равновесие в соответствии с принципом Ле Шателье – Брауна смещается в сторону конденсации вещества А, т.е. в сторону уменьшения давления насыщенного пара РА. Очевидно, что, чем меньше мольная доля компонента А в растворе, тем меньше парциальное давление его насыщенных паров над раствором. Для некоторых растворов выполняется следующая закономерность, называемая первым законом Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]() (1)
(1)
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
![]() (2)
(2)
Относительное понижение парциального давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
Первый закон Рауля нетрудно вывести, используя понятие химического потенциала компонента, если считать пар над раствором идеальным газом. Условием гетерогенного равновесия является равенство химических потенциалов компонентов системы во всех фазах. Химический потенциал растворителя в растворе μА (р) связан с мольной долей растворителя в растворе XА уравнением (3):
![]() (3)
(3)
Химический потенциал растворителя в паре μА(п) можно выразить через парциальное давление пара растворителя РА:
![]() (4)
(4)
Химический потенциал чистого жидкого растворителя μ*А равен химическому потенциалу равновесного пара:
![]() (5)
(5)
В состоянии равновесия μА(п) = μА(р). Комбинируя выражения (3-5), легко получить:
![]() (6)
(6)
Принимая, что μ*А = μoА (р), получаем следующее уравнение:
![]() (7)
(7)
Отсюда легко получить выражение для первого закона Рауля:
![]() =>
=>
![]() =>
=>
![]() (8)
(8)
Растворы, для которых выполняется первый закон Рауля, называют идеальными растворами. Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций.
Если компоненты бинарного раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание компонентов в парах будет, как правило, отличаться от содержания их в растворе: пар относительно богаче компонентом, температура кипения которого ниже – см. следующий параграф). Рассмотрим идеальный бинарный раствор, состоящий из компонентов А и В, неограниченно растворимых друг в друге. Общее давление пара, согласно первому закону Рауля, равно
![]() (9)
(9)
Таким образом, для идеальных бинарных растворов зависимость общего и парциального давления насыщенного пара от состава раствора, выраженного в мольных долях компонента В, является линейной при любых концентрациях (рисунок 1). К таким системам относятся, например, системы бензол – толуол, гексан – гептан, смеси других изомерных углеводородов. Для реальных растворов данные зависимости являются криволинейными (рисунок 2).
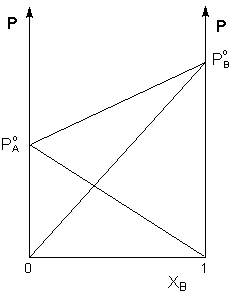
Рис. 1. Зависимость парциальных и общего давлений пара идеального раствора от концентрации.
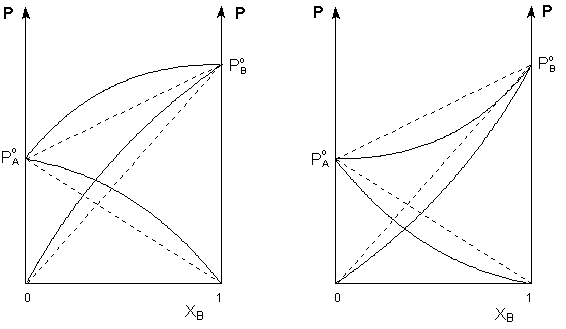
Рис. 2. Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных (слева) и отрицательных (справа) отклонениях от закона Рауля.
Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения).
Образование реальных растворов сопровождается тепловым и объёмным (т.н. контракция) эффектами. Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходным объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0) ); объём раствора в этом случае будет меньше, чем сумма исходным объёмов компонентов (ΔV < 0).
Состав равновесного пара над раствором
Если рассмотреть, как соотносятся состав раствора и состав равновесного пара, то нетрудно показать, что в общем случае мольная доля компонента в растворе Хi не совпадает с мольной долей компонента в паре Yi.
![]() (10)
(10)
Подставив сюда уравнение (9), получаем:
![]() (11)
(11)
Разделив числитель и
знаменатель правой части уравнения на
Р°А
и введя обозначение
![]() ,
получим:
,
получим:
![]() (12)
(12)
Из уравнения (12) видно, что YB = XB только при условии, что α = 1, т.е. при равенстве давлений насыщенного пара чистых компонентов А и В. Если α > 1, то мольная доля компонента В в паре оказывается больше, чем его мольная доля в растворе (и наоборот). Вид зависимости состава равновесного пара от состава раствора приведён на рисунке 3.
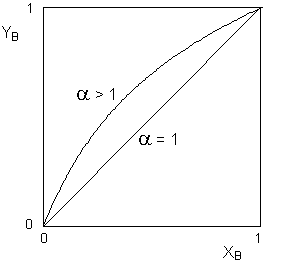
Рис. 3. Зависимость состава пара от состава раствора для идеальных растворов.
Данную зависимость состава пара от состава раствора качественно описывает первый закон Коновалова:
Равновесный пар по сравнению с жидкостью относительно обогащён тем компонентом, добавление которого к жидкости повышает общее давление пара над раствором (или, что то же самое, понижает температуру кипения раствора при некотором постоянном давлении).
Первый закон Коновалова применим как к идеальным, так и к неидеальным растворам. Если отклонения от первого закона Рауля невелики, то зависимость состава пара от состава раствора имеет вид, аналогичный изображённому на рисунке 3 для случая, когда α > 1. Если отклонения раствора от идеального велики, на кривой зависимости общего давления пара от состава раствора может появиться экстремум (максимум или минимум для положительных и отрицательных отклонений соответственно). В этом случае зависимость состава пара от состава раствора имеет более сложный вид, показанный на рисунке 4.
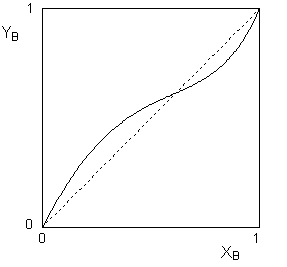
Рис. 4. Зависимость состава пара от состава раствора для систем, имеющих экстремум на кривой зависимости общего давления пара от состава раствора.
Аналогичная ситуация может иметь место и для близких к идеальному раствору систем, в которых компоненты раствора имеют близкие температуры кипения (давления насыщенного пара над чистым компонентом). Данная ситуация описывается вторым законом Коновалова:
Точки экстремума на кривой зависимости общего давления пара от состава раствора отвечают растворам, состав равновесного пара над которыми совпадает с составом раствора.
Такие растворы называются нераздельно кипящими или азеотропными смесями.
Законы Коновалова можно вывести термодинамически, воспользовавшись уравнением Дюгема – Моргулиса, связывающим парциальные давления паров компонентов бинарного раствора с их мольными долями в растворе:
![]() (13)
(13)
Переписав уравнение (13) в виде
![]() (14)
(14)
и подставив туда XA = 1 – XB, получаем:
![]() =>
=>
![]() (15)
(15)
Выражая dPA из уравнения (15) и подставляя вместо парциального давления каждого из компонентов произведение общего давления пара на мольную долю компонента в паре (PA = PYA = P(1–YB), PB = PYB), получим:
![]() (16)
(16)
Учитывая, что, согласно закону Дальтона, dP = dPA + dPB, уравнение (16) можно переписать относительно dP:
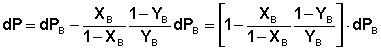 (17)
(17)
Разделив это выражение на dXB, получаем зависимость, связывающую общее давление пара над бинарным раствором с мольной долей компонента B в растворе:
 (18)
(18)
Таким образом, если
добавление в раствор компонента B
увеличивает общее давление пара (![]() > 0),
то, поскольку производная
> 0),
то, поскольку производная
![]() всегда
положительна, получаем, что YB
– XB
> 0, доказав 1-й закон Коновалова.
всегда
положительна, получаем, что YB
– XB
> 0, доказав 1-й закон Коновалова.
В точке экстремума производная давления по мольной доле B равна нулю. Отсюда получаем:
![]() =>
=>
![]() =>
=>
![]() (19)
(19)
На различии составов раствора и равновесного с ним пара основано разделение растворов с помощью перегонки. Для рассмотрения равновесия в таких системах удобно пользоваться диаграммами состояния раствор – пар в координатах давление пара – состав или температура кипения – состав.
Перегонка двойных жидких растворов 1-го типа
Рассмотрим диаграммы состояния бинарного жидкого раствора, летучие компоненты которого неограниченно растворимы друг в друге и не образуют азеотропную смесь (системы 1-го типа). Для построения диаграммы состояния на одном графике откладываются две зависимости: зависимость давления насыщенного пара от состава раствора и зависимость давления насыщенного пара от состава пара (рисунок 5) или зависимость температуры кипения раствора от состава раствора и зависимость температуры кипения раствора от состава равновесного пара (рисунок 6).

Рис. 5. Диаграмма состояния системы 1-го типа в координатах давление – состав (Т = const)
Рассмотрим диаграмму состояния, изображённую на рисунке 5. Кривая KLMN представляет собой зависимость давления насыщенного пара от состава раствора; над кривой находится область, отвечающая жидкой фазе. Кривая KRQN представляет собой зависимость давления насыщенного пара от состава пара; под кривой находится область, отвечающая газообразной фазе. Область между кривыми – область гетерогенности системы. Как видно из диаграммы, раствору состава ХВ отвечает равновесный пар состава YB (точки L и R), давление которого равно Р1, а раствору состава Х'В – равновесный пар состава Y'B (точки M и Q) давление которого равно Р2. Таким образом, увеличение концентрации компонента В приводит к уменьшению общего давления пара, и в соответствии с 1-м законом Коновалова равновесный пар содержит больше компонента А, чем раствор.
При рассмотрении процесса перегонки жидкости при постоянном давлении используется диаграмма состояния в координатах температура кипения – состав, изображённая на рисунке 6.
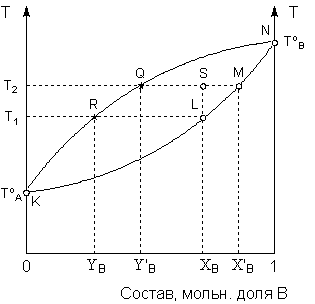
Рис. 6. Диаграмма состояния системы 1-го типа в координатах температура – состав (P = const)
Кривая KLMN представляет собой зависимость температуры кипения от состава раствора; под кривой находится область, отвечающая жидкой фазе. Кривая KRQN представляет собой зависимость температуры кипения раствора от состава пара; над кривой находится область, отвечающая газообразной фазе. Область между кривыми – область гетерогенности системы.
Как видно из диаграммы, раствор состава ХВ имеет температуру кипения Т1 (точка L), а находящийся с ним в равновесии пар – состав YB (точка R), т.е. обогащён компонентом A, добавление которого к раствору понижает температуру кипения раствора. Диаграмма состояния позволяет не только определить состав равновесных фаз, но и рассчитать их относительные количества. Рассмотрим систему общего состава ХВ, находящуюся при температуре Т2 (точка S). Равновесная жидкая фаза (точка M) будет иметь состав Х'В, а равновесный пар – состав Y'В (точка Q). Относительные количества фаз определяются по правилу рычага; в данном случае количество жидкой фазы (в молях, поскольку состав выражен в мольных долях) будет относиться к количеству пара, как длина отрезка |QS| относится к длине отрезка |SM|.
Таким образом, диаграмма состояния позволяет определить состав фракции, отгоняющейся из раствора состава ХВ в интервале температур от Т1 до Т2. Очевидно, что в этом случае состав фракции будет находиться между YВ и Y'В, т.е. отогнанная фракция будет обогащена по сравнению с исходным раствором компонентом A. Если сконденсированный пар подвергнуть повторной перегонке, будет получена фракция, ещё более обогащённая компонентом A. В результате многократного повторения таких операций может быть получен пар чистого компонента A. Разделение компонентов жидкого раствора, имеющих различные температуры кипения, за счёт многократного повторения циклов испарение – конденсация называется ректификацией. Схематически процесс ректификации показан на рисунке 7.
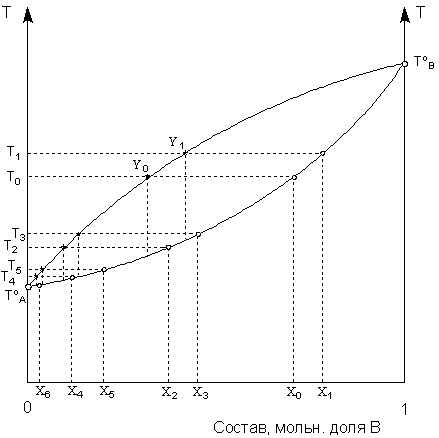
Рис. 7. Ректификация смеси летучих жидкостей.
При перегонке исходного раствора состава Хo состав раствора непрерывно изменяется, и температура кипения повышается. При перегонке в интервале температур от Тo до Т1 состав равновесного пара также изменяется от Yo до Y1; его конденсацией будет получена жидкая фракция состава Х2, кипящая при температуре Т2. Перегонкой её в интервале температур от Т2 до Т3 после конденсации пара будет получена фракция состава Х4, кипящая при температуре Т4. Перегоняя последнюю в интервале температур от Т4 до Т5, получают фракцию состава Х6. Состав и температура кипения данной фракции уже довольно близки к чистому компоненту A. Количество необходимых для полного разделения компонентов раствора циклов испарение – конденсация (т.н. число теоретических тарелок ректификационной колонны) определяется природой компонентов (прежде всего разностью их температур кипения) и желаемой степенью чистоты получаемого ректификата и может быть рассчитано с помощью диаграммы состояния системы.
Перегонка двойных жидких растворов 2-го типа
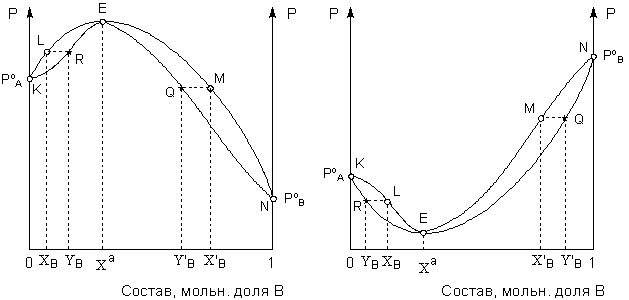
В случае если зависимость общего давления насыщенного пара смеси летучих компонентов имеет экстремум (т.н. смеси 2-го типа), диаграммы состояния системы раствор – пар имеют вид, показанный на рисунках 8 – 9.
А) Б)
Рис. 8. Диаграммы состояния раствор – пар для летучих смесей 2-го типа в координатах давление насыщенного пара – состав для систем с максимумом (А) и минимумом (Б) общего давления.

А) Б)
Рис. 9. Диаграммы состояния раствор – пар для летучих смесей 2-го типа в координатах температура кипения – состав для систем с минимумом (А) и максимумом (Б) температуры кипения.
Температура кипения азеотропных растворов при постоянном внешнем давлении неизменна, и состав раствора при перегонке не изменяется (как у индивидуальных веществ). Диаграмму состояния системы 2-го типа в принципе можно рассматривать как совокупность диаграмм состояния двух систем первого типа, в каждой из которых в роли одного из компонентов выступает азеотропная смесь. Анализ диаграммы состояния таких систем аналогичен таковому для систем 1-го типа.
Как видно из рисунка 9, полное разделение подобных систем перегонкой невозможно. При фракционной перегонке системы с минимумом температуры кипения (рис. 9-А) состав дистиллята постепенно приближается к азеотропному. Кубовой остаток при этом обогащается тем компонентом, который в исходном растворе находился в избытке по сравнению с составом азеотропной смеси – компонентом А в области концентраций левее азеотропной точки и компонентом B в области концентраций правее азеотропной точки. В системах с максимумом температуры кипения (рис. 9-В), напротив, дистиллят обогащается компонентом, который находился в избытке по отношению к азеотропному раствору, а состав кубового остатка постепенно приближается к азеотропному.
Следует, однако, помнить, что отождествление азеотропной смеси с индивидуальным веществом является сугубо условным. При изменении внешнего давления происходит смещение экстремума на кривой зависимости температуры кипения от состава (в некоторых случаях может произойти исчезновение экстремума). Следовательно, составы азеотропных растворов для жидких смесей данных компонентов при разных давлениях различаются. Так, для системы этанол – вода мольная доля этанола в азеотропе составляет 0.895 при давлении, равном 760 мм рт. ст., и 0.996 – при 100 мм рт. ст.
Перегонка двойных жидких растворов 2-го типа
Температура кристаллизации разбавленных растворов.
Жидкий раствор в отличие от чистой жидкости не отвердевает целиком при постоянной температуре. При некоторой температуре, называемой температурой начала кристаллизации, начинают выделяться кристаллы растворителя; именно температура начала кристаллизации является количественной характеристикой процесса кристаллизации из растворов. Поскольку по мере кристаллизации растворителя концентрация раствора возрастает, кристаллизация последующих порций растворителя происходит при более низкой температуре. Процесс кристаллизации раствора можно охарактеризовать величиной понижения температуры замерзания ΔTкр, равной разности между температурой замерзания чистого растворителя To и температурой начала кристаллизации раствора Tкр:
![]() (1)
(1)
Основным фактором, определяющим протекание процесса кристаллизации раствора, является парциальное давление насыщенного пара растворителя над раствором. Этому нетрудно дать термодинамическое обоснование. Условием всякого термодинамического равновесия является минимум свободной энергии системы. Используя понятие химического потенциала, условие равновесия можно записать следующим образом:
![]() (2)
(2)
Отсюда нетрудно получить, что при равновесии некоторого компонента между фазами α и β его химические потенциалы в этих фазах равны:
![]() (3)
(3)
Таким образом, условием равновесия в гетерогенной системе является равенство химических потенциалов каждого компонента во всех фазах.
Условие равновесия между двумя конденсированными фазами можно выразить также и через парциальные давления насыщенного пара компонента. Если фазы α и β являются конденсированными, и каждая из них находится в равновесии с парообразной фазой (п), то можно записать:
![]() ;
;
![]() (4)
(4)
Если конденсированные фазы находятся в равновесии, то получаем:
![]() (5)
(5)
Учитывая зависимость химического потенциала от парциального давления компонента, выражение (5) можно переписать следующим образом:
![]() (6)
(6)
Здесь μi* – стандартный химический потенциал компонента в парообразной фазе. Отсюда получаем
![]() (7)
(7)
Таким образом, равенство парциальных давлений насыщенного пара некоторого компонента над всеми фазами может служить условием равновесия для данной гетерогенной системы.
Общая количественная взаимосвязь между понижением температуры кристаллизации раствора и его концентрацией может быть получена лишь для бесконечно разбавленных растворов. Такие растворы являются идеальными независимо от природы растворителя и растворённого вещества, поэтому к ним полностью применим 1-й закон Рауля, описывающий зависимость парциального давления компонента над идеальным раствором от состава:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
(8)
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
(9)
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, равенство давлений насыщенного пара растворителя над твёрдым растворителем и над раствором всегда будет достигаться при температуре более низкой, чем To. Это можно проиллюстрировать с помощью Р – T диаграммы состояния растворителя и растворов различной концентрации (рисунок 1). Здесь кривая ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно.
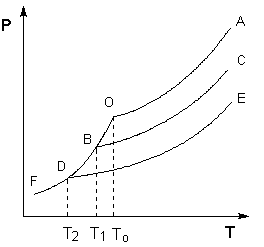
Рис. 1. Понижение температуры замерзания разбавленных растворов
Равновесие между насыщенным паром и твёрдым или жидким растворителем описывается уравнением Клаузиуса – Клапейрона:
![]() (10)
(10)
![]() (11)
(11)
Здесь Р'А и Р°А – соответственно давление насыщенного пара над твёрдым и жидким чистым растворителем при температуре Т = То, ΔHсубл и ΔHисп – теплота сублимации и теплота испарения чистого растворителя. Вычитая из уравнения (10) уравнение (11) и заменяя разность теплот сублимации и испарения на теплоту плавления чистого растворителя чистого растворителя ΔHпл, получаем:
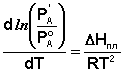 (12)
(12)
Рассматривая кристаллизацию растворителя из раствора, мы можем заменить давление насыщенного пара растворителя над раствором РА на давление насыщенного пара над твёрдым растворителем Р'А, поскольку, как было сказано выше, они равны. В этом случае выражение для закона Рауля мы можем переписать в следующем виде:
![]() (13)
(13)
Здесь ХВ – мольная доля растворённого вещества. Тогда выражение (12) преобразуется к следующему виду:
![]() (14)
(14)
Поскольку мы рассматриваем бесконечно разбавленный раствор и понижение температуры кристаллизации раствора также мало, уравнение (12) можно интегрировать, считая теплоту плавления не зависящей от температуры.
![]() (15)
(15)
 (16)
(16)
![]() (17)
(17)
Для бесконечно разбавленных растворов Tкр и Tо можно приравнять; заменяя Tо на Tпл, получаем:
![]() (18)
(18)
Логарифм в левой части уравнения (18) можно разложить в ряд:
![]() (19)
(19)
Поскольку ХВ стремится к нулю, можно ограничиться первым членом ряда. Подставляя ХВ вместо ln(ХВ), получаем:
![]() (20)
(20)
На практике использовать
значения концентрации раствора,
выраженные в мольных долях, крайне
неудобно, поэтому в уравнении (20)
необходимо заменить мольную долю на
моляльную
концентрацию
раствора m.
Учитывая, что число молей nA
растворителя в растворе много больше
числа молей nB
растворённого вещества, мольную долю
последнего представим как
![]() .
Приняв, что масса растворителя равна
1000 г, представим число молей nA
растворителя как
.
Приняв, что масса растворителя равна
1000 г, представим число молей nA
растворителя как
![]() ,
где МА
– молярная масса растворителя. В этом
случае можно записать
,
где МА
– молярная масса растворителя. В этом
случае можно записать
![]() (21)
(21)
Молярную теплоту плавления растворителя ΔHпл заменим на удельную теплоту плавления λA (ΔHпл = λAМА). Для понижения температуры кристаллизации бесконечно разбавленного раствора получаем:
![]() (22)
(22)
![]() (23)
(23)
В правой части полученного уравнения (23) все величины, кроме моляльной концентрации раствора, являются константами некоторого растворителя А. Поэтому выражение в скобках можно заменить на криоскопическую постоянную растворителя К. Окончательно получаем:
![]() (24)
(24)
Уравнение (24) называют вторым законом Рауля. Его можно сформулировать следующим образом:
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора.
Иначе говоря, ΔTкр определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Температура кипения разбавленных растворов.
Соотношение, подобное полученному выше, может быть выведено и для повышения температуры кипения предельно разбавленных растворов нелетучих веществ. Любая жидкость – чистый растворитель или раствор – кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (т.е. давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. Следовательно, давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Ткип всегда выше, чем температура кипения чистого растворителя при том же давлении То.
На Р – T диаграмме состояния растворителя и растворов различной концентрации видно, что температуры кипения этих жидкостей будут температурами, при которых изобара Р = 1 атм. пересечет кривые ОА, ВС и DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно (рисунок 2).
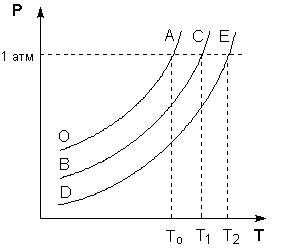
Рис. 2. Повышение температуры кипения разбавленных растворов нелетучих веществ.
Для повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ ΔTкип = Tкип – To можно, рассуждая подобно описанному в предыдущем параграфе, вывести количественную взаимосвязь с концентрацией раствора.
Запишем условие кипения раствора с учётом 1-го закона Рауля:
![]() (25)
(25)
![]() (26)
(26)
Дифференцируя (26) по температуре, получаем:
![]() (27)
(27)
К равновесию жидкость – пар применимо уравнение Клаузиуса – Клапейрона:
![]() (28)
(28)
Из уравнений (27) и (28) получаем:
![]() (29)
(29)
Уравнение (29) можно проинтегрировать, считая, что ΔНисп не зависит от температуры. Последнее предположение является справедливым для бесконечно разбавленных растворов, температура кипения которых мало отличается от температуры кипения чистого растворителя.
![]() (30)
(30)
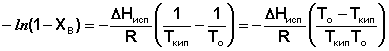 (31)
(31)
![]() (32)
(32)
Раскладывая логарифм в ряд, и ограничиваясь для бесконечно разбавленных растворов первым членом ряда, получаем:
![]() (33)
(33)
Аналогично изложенному в предыдущем параграфе заменяем мольную долю моляльной концентрацией, молярную теплоту испарения растворителя удельной и принимаем, что для бесконечно разбавленных растворов Tкип приближенно равна To.
Окончательно получаем:
![]() (34)
(34)
В уравнении (34) коэффициент пропорциональности Е, величина которого зависит только от природы растворителя, есть эбулиоскопическая постоянная растворителя. Второй закон Рауля для температуры кипения растворов можно сформулировать следующим образом:
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора.
Второй закон Рауля является следствием из первого; следует ещё раз подчеркнуть, что данный закон справедлив только для бесконечно разбавленных растворов. Криоскопическая и эбулиоскопическая константы растворителя имеют физический смысл соответственно понижения температуры замерзания и повышения температуры кипения растворов с моляльной концентрацией, равной 1 моль/кг. Однако, поскольку такие растворы не являются бесконечно разбавленными, уравнения (24) и (34) к ним неприменимы; криоскопическая и эбулиоскопическая константы поэтому относятся к числу т.н. экстраполяционных констант.
Осмотическое давление разбавленных растворов.
Ещё одним коллигативным – зависящим только от концентрации – свойством растворов является осмотическое давление раствора. В 1748 году А.Нолле обнаружил явление перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный – осмос. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, есть осмотическое давление π. Зависимость осмотического давления идеальных растворов от температуры и молярной концентрации раствора С описывается т.н. принципом Вант-Гоффа:
![]() (35)
(35)
Осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в состоянии идеального газа при той же температуре, занимало бы тот же объем, который занимает раствор.
Следует отменить, что принцип Вант-Гоффа был сформулирован на основании опытных данных, и аналогия между уравнением Вант-Гоффа (35) и уравнением состояния идеального газа не имеет физического смысла.
Определение молекулярной массы растворённого вещества.
Уравнения (24), (34) и (35) дают возможность расчёта молекулярной массы растворённого вещества на основании экспериментального определения понижения температуры замерзания, повышения температуры кипения разбавленных растворов и их осмотического давления. Рассмотрим определение молекулярной массы криоскопическим методом. Зная массы растворителя g1 и растворённого вещества g2, уравнение (24) нетрудно привести к следующему виду:
![]() (36)
(36)
Температура кипения разбавленных растворов.
Растворы электролитов. Теория электролитической диссоциации
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Для учета этих отклонений Вант-Гофф внес в уравнение (35) для растворов электролитов поправку – изотонический коэффициент:
![]() (37)
(37)
Аналогичная поправка вносится в законы Рауля и изотонический коэффициент определяется следующим образом:
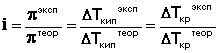 (38)
(38)
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает и стремится к некоторому целочисленному значению. Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания и осмотическое давление для них всегда больше, чем вычисленные. Для объяснения особенностей свойств растворов электролитов С.Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул растворённого вещества N:
![]() (39)
(39)
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 < α < 0.7) и слабые (α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Слабые электролиты. Константа диссоциации.
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
![]()
константа диссоциации выразится следующим соотношением:
![]() (40)
(40)
Для бинарного (распадающегося на два иона) электролита выражение (40) можно переписать в следующем виде:
![]() (41)
(41)
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, выражение (41) в этом случае можно записать следующим образом:
![]() (42)
(42)
Для растворов слабых электролитов можно считать, что (1 – α ) приближённо равно 1. Тогда получаем:
![]() (43)
(43)
![]() (44)
(44)
Т.о., степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение (44) называют законом разбавления Оствальда. Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Будем считать, что из N молекул электролита продиссоциировало n молекул, образовав νn ионов (ν – число ионов, образующихся при диссоциации молекулы). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
![]() (45)
(45)
![]() (46)
(46)
Соотношение (46) дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита:
![]() (47)
(47)
