
- •Глава 1.Биополимеры
- •1.1.Химическое строение биополимеров
- •1.1.1.Белки
- •1.1.2.Олигонуклеотиды и нуклеиновые кислоты
- •1.1.3.Полисахариды
- •1.1.4.Гликопротеины и пептидогликаны
- •1.2.Конформация биополимеров
- •1.2.1.Уровни пространственной организации биополимеров
- •1.2.2.Силы, стабилизирующие пространственную структуру биополимеров
- •1.2.3.Вторичная структура биополимеров
- •1.2.4.Третичная структура биополимеров
1.2.Конформация биополимеров
1.2.1.Уровни пространственной организации биополимеров
Обычно при рассмотрении пространственной организации биополимеров (белки, нуклеиновые кислоты) выделяют четыре уровня: первичную, вторичную, третичную и четвертичную структуру. Хотя такое разделение в значительной мере условно, оно весьма полезно для систематизации наших знаний о строении биополимеров.
Первичной структурой (первичной последовательностью) называют порядок, в котором мономерные единицы связаны между собой ковалентными связями.
Вторичная структура. Часто в полимерных цепях содержатся участки, мономерные остатки которых образуют локально упорядоченные трехмерные структуры. Совокупность таких упорядоченных структур называют вторичной структурой биополимера.
Третичная структура биополимера — это полная трехмерная структура одной неделимой структурной единицы.
Четвертичная структура. Многие биополимеры имеют и четвертичную структуру, в которой отдельные структурные единицы, называемые субъединицами, объединены за счет электростатического притяжения, водородных связей и гидрофобных взаимодействий в олигомер. Субъединицы четвертичной структуры могут быть как одинаковыми, так и различными, а расположение их в четвертичной структуре как симметричным, так и асимметричным.
Первичная последовательность (структура) не несет непосредственной информации о пространственном строении (конформации) биополимеров (хотя очевидно, что конформация биополимеров в значительной степени определяется конформационными возможностями составляющих их мономерных единиц). О ней уже было сказано в предыдущем разделе. Ниже мы остановимся только на вторичной, третичной и четвертичной структурах.
Но прежде, чем перейти к рассмотрению пространственного строения биополимеров следует познакомиться с силами, стабилизирующими пространственную структуру биополимеров.
1.2.2.Силы, стабилизирующие пространственную структуру биополимеров
Конформационные возможности биополимеров несравненно богаче конформационных возможностей небольших молекул. Так, нуклеозиды могут существовать в виде 12 конформеров (см. Раздел Error: Reference source not found), так что даже если считать, что все конформеры обладают одинаковой энергией, доля активного конформера, выполняющего некую биологическую функцию, будет не меньше 8% (на самом деле значительно больше, поскольку биологически активным является, как правило, самый стабильный конформер). Таким образом, наличие конформационного равновесия не может помешать небольшой молекуле выполнять ее биологическую функцию. Иначе обстоит дело с биополимерами. В полипептидной цепи вращение возможно вокруг двух связей каждого аминокислотного остатка — связи между карбоксильным углеродом и углеродом (Cк–C) и между ‑углеродом и аминым азотом (C–N). Как было показано выше (см. Раздел 1.1.1) вращение вокруг пептидной связи сильно затруднено, а сама пептидная группа существует в анти-конформации. Количество конформаций полипептидной цепи будет равно 32N 10N, где N — число аминокислотных остатков. Даже для относительно небольшого белка из 100 аминокислотных остатков число возможных конформаций пептидного остова равно приблизительно 10100. Число это невообразимо велико. Оно не только больше числа всех молекул в отдельной клетке или в отдельном организме. Оно невообразимо больше числа всех молекул в земной биосфере. Другими словами, если бы все эти конформации обладали одинаковой энергией, то во всей биосфере в какой-то момент времени могло не оказаться ни одной молекулы белка, обладающей биологически активной конформацией. Таким образом, если отсутствие определенной структуры даже у сложной мономерной молекулы не препятствует ее биологической функции, то в случае биополимеров отсутствие определенной структуры делает в принципе невозможным выполнение ими биологической функции.
Какие же силы «организуют» пространственную структуру биополимеров и удерживают ее в стабильном состоянии? Как ни странно, это очень слабые взаимодействия, энергия которых на два–три порядка меньше энергии ковалентных связей. Они действуют между отдельными атомами или небольшими группами атомов. Огромное число атомов в молекуле биополимера приводит к тому, что суммарная энергия этих слабых взаимодействий становится сравнимой с энергией ковалентного связывания.
Рис.
3.8. Схематическая
зависимость энергии ван-дер-ваальсовых
взаимодействий от расстояния между
центрами несвязанных атомов.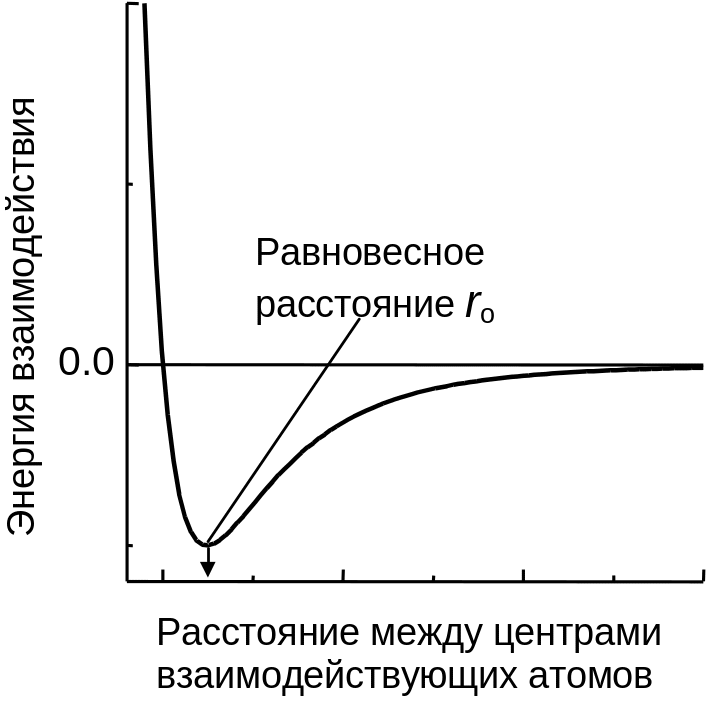
Электростатические взаимодействия. В белках возникновение электростатических взаимодействий обусловлено присутствием аминокислотных остатков, в боковых радикалах которых находятся группы, несущие при рН близких к нейтральным либо положительный (лизин и аргинин), либо отрицательный (аспарагиновая и глутаминовая кислоты) заряд. Среди различных видов нековалентных взаимодействий они обладают наибольшей энергией взаимодействия. На близких расстояниях (несколько Å) энергия кулоновского взаимодействия сравнима с энергией ковалентной связи. Кроме того, электростатические взаимодействия наиболее «дальнодействующие» из всех видов нековалентных взаимодействий (обратно пропорциональны лишь второй степени расстояния между ионами). Тем не менее, их вклад в общую энергию стабилизации пространственной структуры белка, как правило, относительно невелик, что связано с небольшим числом заряженных остатков в молекуле. В нуклеиновых кислота, которые являются полианионом, кулоновское отталкивание отрицательных зарядов повышает энергию структуры. Электростатические взаимодействия ненаправлены и ненасыщаемы.
Водородные связи. В противоположность электростатическим взаимодействиям, водородные связи направлены и насыщаемы. Энергия водородных связей на порядок меньше энергии ковалентных (2–10 ккал/моль). Они образуются между атомом водорода, связанным с атомом более электроотрицательным, чем углерод (донор), и атомом, несущим свободную электронную пару (акцептор). В качестве донора и акцептора выступают одни и те же атомы — азот, кислород, галоиды, сера. Расстояние между донором и акцептором составляет 2.8–3.0 Å. Природа водородной связи довольно сложна, упрощенно ее можно представить как нечто среднее между кулоновским взаимодействием и донорно-акцепторной связью:

Ван-дер-ваальсовы взаимодействия. Эти взаимодействия возникают за счет притяжения постоянных (ориентационные взаимодействия), наведенных (индукционные взаимодействия) и виртуальных (дисперсионные взаимодействия) диполей. Их характерной чертой является уменьшение энергии взаимодействия пропорционально шестой степени расстояния между взаимодействующими частицами. Энергия ван-дер-ваальсовых взаимодействий на порядок меньше энергии водородного связывания. Зависимость энергии ван-дер-ваальсовых взаимодействий схематически представлена на Рис. 3 .8.
Табл. 3.1. Значения ковалентных и ван-дер-ваальсовых радиусов основных биогенных атомов
Атом |
Ковалентный радиус, Å |
Ван-дер-ваальсов радиус, Å |
H |
0.28 |
1.2 |
Cl |
0.99 |
1.8 |
C |
0.77 |
0.17 |
N |
0.73 |
0.15 |
O |
0.74 |
0.14 |
S |
1.03 |
1.8 |
P |
1.1 |
1.9 |
Поскольку энергия отталкивания возрастает чрезвычайно резко, атомы разумно рассматривать как упругие сферы с радиусами, сумма которых соответствует ro (ван-дер-ваальсовых радиусов). Ван-дер-ваальсовы радиусы приблизительно вдвое больше ковалентных. В Табл. 3 .1 приведены значения ковалентных и ван-дер-ваальсовых радиусов некоторых атомов.
Гидрофобные взаимодействия. Прежде, чем рассмотреть природу гидрофобных взаимодействий, необходимо ввести понятия гидрофобных (и гидрофильных) функциональных групп и соединений. Сами названия указывают на то, что эти понятия относятся к водным растворам. Группы, которые могут образовывать водородные связи с молекулами воды, называются гидрофильными. Поскольку молекула воды может выступать как в роли донора водорода, так и в роли акцептора водорода, гидрофильными являются группы, имеющие либо «кислый» водород (водород, соединенный с атомом, более электроотрицательным, чем углерод), либо атомы с пеподеленной электронной парой. К таким группам относятся окси- и аминогруппы, карбонильная, карбоксильная, амидная группы и т.п. Молекулы или части молекулы не способные образовывать водородные связи с водой называются гидрофобными. К гидрофобным группам относятся алкильные и арильные (ароматические) радикалы. Как правило, гидрофильные соединения хорошо растворимы в воде, а гидрофобные — либо плохо, либо вовсе нерастворимы.
Экспериментально известно, что гидрофобные молекулы (например, бензол), будучи растворены в воде, «слипаются» в конгломераты. Физические модели, объясняющие этот экспериментальный факт, достаточно сложны и не буду здесь на них останавливаться. Скажу только, что энергия системы вода+гидрофобные молекулы понижается при уменьшении поверхности контакта воды с гидрофобными группами. Это явление принято называть гидрофобным взаимодействием.
Нековалентные взаимодействия, рассмотренные выше, в пределах каждой молекулы биополимера обеспечивают необходимую для ее функционирования пространственную структуру, обеспечивают надмолекулярную организацию биополимеров и важнейший этап их функционирования — «узнавание» ими своих партнеров.
Дисульфидные сшивки (S–S-мостики). В случае белков в стабилизации третичной структуры очень важную роль играют дисульфидные сшивки, образующиеся между сближенными в пространстве остатками цистеина:
![]()
S–S-Мостики образуются уже при действии растворенного в воде кислорода воздуха; для их восстановления обычно используют меркаптоэтанол, C2H5SH.
