- •Получение пероксида водорода
- •Химические свойства пероксида водорода
- •Применение пероксида
- •Вопрос 2
- •Изотопы кислорода
- •Нахождение в природе
- •Молекула кислорода
- •Аллотропные модификации
- •Получение кислорода
- •Химические свойства кислорода
- •Химические свойства йода
- •Фториды металлов
- •Восстановительные свойства
- •Получение
- •Йодная кислота
- •Получение
- •Получение
- •Получается действием h2so4 на её соли:
- •Вопрос №8
- •Химические свойства
- •Вопрос №9
- •Взаимодействие галогенов с водой
- •Вопрос№11
- •Химические свойства н2э.
- •Получение
- •Сульфиды металлов.
- •Вопрос№12
- •Для серной кислоты характерно образование двойных солей, называе-
- •Концентрированная серная кислота в обычных условиях пассивирует
- •Круговорот азота в природе
- •Вопрос 15
- •Нахождение в природе
- •Вопрос№16
- •Nh2oh — гидроксиламин
- •В промышленности азотную кислоту синтезируют в три этапа:
- •Вопрос 18
- •Фосфиты
- •Галогениды фосфора
- •Вопрос №20
Изотопы кислорода
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода: от 12О до 24О. Все радиоактивные изотопы кислорода имеют малый период полураспада, а 12O распадается за 5,8·10−22 секунды.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя
Степени окисления Бинарные соединения кислорода, в которых степень окисления атомов кислорода равна −2, называют оксидами (прежнее название — окислы). Примеры оксидов: оксид углерода (IV) CO2 ,оксид серы (VI) SO3, оксид меди (I) Cu2O, оксид алюминия Al2O3, оксид марганца (VII) Mn2O7.
Кислород образует также соединения, в которых его степень окисления равна −1 , содержащие пероксогруппу -О-О-. Это — пероксиды (старое название — перекиси), например, пероксид водорода Н2О2, пероксид бария ВаО2, пероксид натрия Na2O2 и другие. В этих соединениях содержится пероксидная группировка —О—О—.
С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода -½. Можно отметить, что часто формулы супероксидов записывают как К2О4, Rb2O4 и т. д.
С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2F2 степень окисления кислорода +1, а в соединении O2F — +2. Эти соединения принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем, например, действуя фтором F2 на разбавленные водные растворы КОН.
Нахождение в природе
Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Молекула кислорода
Молекулярный кислород, будучи ковалентным соединением, в воде растворяется плохо: в 100 объемах Н2О при обычном давлении и. 0; 20; 100°С растворяется 4,89; 3,16; 1,70 объемов 02 соответственно. Нo в неполярных жидкостях он растворяется очень охотно, и простого перемешивания таких жидкостей на воздухе часто бывает достаточно, чтобы насытить их кислородом воздуха.
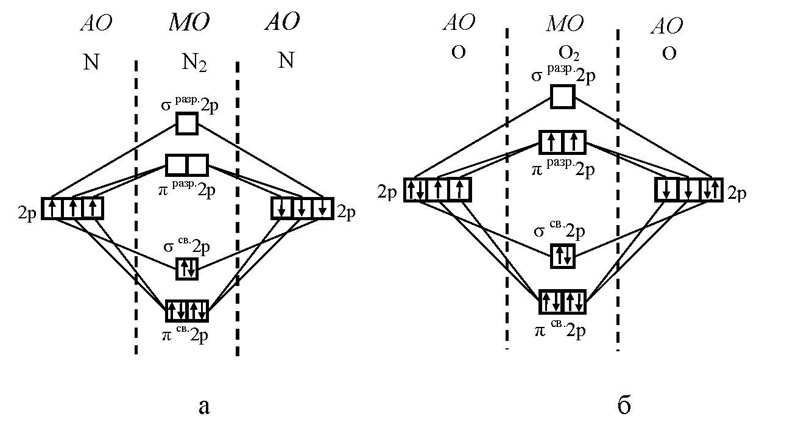
,парамагнетизм
В молекуле кислорода О2 в образовании
химических связей принимают участие
по четыре 2р-электрона каждого атома;
всего, следовательно, на МО должны
перейти восемь электронов. Шесть из них
занимают три связывающие МО, а два
размещаются на разрыхляющих молекулярных
орбиталях πразр2p; здесь избыток числа
связывающих электронов над числом
разрыхляющих равен четырем, а кратность
связи - двум. Обе орбитали πразр2p
энергетически равноценны, и электроны
должны размещаться здесь в соответствии
с правилом Хунда, которое сохраняет
свою справедливость и в приложении к
молекулам. Поэтому каждая из орбиталей
πразр2p занимается одним электроном и
притом так, что спины этих электронов
имеют одинаковое направление. Из схемы
на рис. 5.7, б вытекает, что в молекуле О2
имеются два неспаренных электрона,
вследствие чего эта молекула парамагнитна