
- •Гоу впо «Воронежский государственный
- •Молекулярная физика и термодинамика методические указания
- •Молекулярная физика и термодинамика
- •394026 Воронеж, Московский просп., 14
- •1. Молекулярно-кинетическая теория идеального газа
- •1.1. Теоретический материал
- •1.2. Основные типы задач и методы их решения Классификация
- •Примеры
- •1.3. Задачи для самостоятельного решения и контрольных заданий
- •2. Явления переноса в газах
- •2.1. Теоретический материал
- •2.2. Основные типы задач и методы их решения Классификация
- •Примеры
- •2.3. Задачи для самостоятельного решения и контрольных заданий
- •Контрольные задания по молекулярной физике и явлениям переноса
- •3. Первое начало термодинамики и его применение к изопроцессам в идеальном газе. Теплоемкость идеального газа
- •3.1. Теоретический материал
- •3.2. Основные типы задач и методы их решения
- •3.3. Задачи для самостоятельного решения и контрольных заданий
- •4. Второе начало термодинамики. Энтропия.
- •4.1. Теоретический материал
- •4.2. Основные типы задач и методы их решения
- •4.3. Задачи для самостоятельного решения и контрольных заданий
- •Контрольные задания по термодинамике
- •Библиографический список
- •Содержание
1.2. Основные типы задач и методы их решения Классификация
1. Определение неизвестных параметров идеального газа, смеси нереагирующих между собой газов.
Метод решения. Использование уравнения состояния идеального газа, закона Дальтона и основного уравнения кинетической теории газов.
2. Определение характеристик молекулярного движения по распределению Максвелла.
Метод решения. Прямое использование распределения Максвелла.
3. Определение характеристик молекулярного движения по распределению Больцмана.
Метод решения. Применение распределения Больцмана, барометрической формулы.
Примеры
Задача 1. Сколько молекул кислорода находится в объеме 1 л при температуре 0 С и давление 133,3 Па?
Решение
Воспользуемся формулой, выражающей давление газа через концентрацию молекул
![]() =
=![]() .
.
Откуда искомое число частиц
![]() .
.
После подстановки значений, получим:
![]()
Задача 2. В баллоне объемом 10 л находится гелий под давлением p1=1 MПа и температуре T1=300 К. После того как из баллона было взято m=10 г гелия, температура в баллоне понизилась до T2=290 К. Определить давление p2 гелия, оставшегося в баллоне.
Решение
Выразим искомое давление из уравнения Менделеева-Клапейрона, применив его к конечному состоянию газа:
![]() .
.
Массу гелия в баллоне в конечном состоянии m2 выразим через массу m1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона
![]() .
.
Массу m1 можно выразить из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
![]() .
.
С учетом этого выражения масса m2
![]() .
.
Окончательно для искомого уравнения имеем:
![]() ,
,
или
![]() .
.
После подстановки значений, получим:
![]()
Задача 3. Определить давление и молекулярную массу смеси газов, состоящей из 10 г кислорода (О2) и 10 г азота (N2), которые занимают объем 20 л при температуре 150 С.
Решение
По закону Дальтона давление смеси газа
![]() ,
,
где парциальное давление pi каждого газа можно выразить из уравнения Менделеева-Клапейрона
![]() .
.
Тогда давление смеси
![]() .
.
После подстановки значений, получим:
![]()
Молярную массу смеси выразим через массу и количество вещества смеси газа
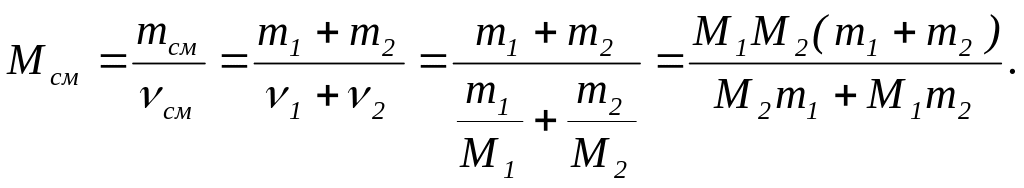
После подстановки значений, получим:
![]()
Задача 5. Давление газа равно 104 Па, а средняя квадратичная скорость равна 500 м/c. Найти плотность этого газа.
Решение
Основное уравнение молекулярно-кинетической теории может быть представлено следующим образом:
![]() .
.
Следовательно,
![]() кг/м3.
кг/м3.
Задача 4. Какая часть молекул воздуха (M=29·10-3 кг/моль) при температуре 17С обладает скоростями, отличающимися не более чем на 0,5 м/с от скорости = В?
Решение
Наиболее вероятная скорость
![]() .
.
Относительная скорость и относительная величина интервала
![]() ;
;
![]() =
1,210-3.
=
1,210-3.
Поскольку
![]() можно считать, что
можно считать, что
![]() ,
,
![]()
и согласно распределению Максвелла
![]() .
.
Задача 6. Найти отношение числа
молекул газа, скорости которых лежат в
интервале от до
(+![]() )
при температуре Т1 к числу молекул,
скорости которых лежат в том же интервале
при температуре Т2 = 2Т1.
Считать, что
)
при температуре Т1 к числу молекул,
скорости которых лежат в том же интервале
при температуре Т2 = 2Т1.
Считать, что
![]() ,
,
![]() .
.
Решение
Согласно распределению Максвелла, учитывая, что , число молекул газа, скорости которых лежат в интервале от до (+ ) в первом и втором случаях:
![]() ,
,
![]() ,
,
где
![]() ,
,
![]() ;
;
 ,
,
 .
.
Найдем отношение числа молекул газа:
![]() .
.
Задача 7. На какой высоте h над уровнем моря плотность воздуха уменьшается в 2 раза? Температура воздуха 0 С. Считать, что температура воздуха Т, молярная масса M и ускорение силы тяжести g не зависят от h.
Решение
Исходя из определения плотности и с учетом уравнения Менделеева-Клапейрона имеем
![]() .
.
Давление воздуха на высоте h в соответствии с барометрической формулой равно
![]() .
.
Таким образом, плотность воздуха на высоте h дается выражением
![]() .
.
После логарифмирования и преобразования данного выражения, получим окончательно
![]() =5,4
км.
=5,4
км.
Задача 8. Определить массу m газа, заключенного в вертикальном цилиндрическом сосуде. Площадь основания сосуда S, высота h. Давление газа на уровне нижнего основания цилиндра p0, температура газа Т, молярная масса газа M. Считать, что Т и g не зависит от h.
Решение
Поскольку давление, а, следовательно, и плотность газа, заключенного в вертикальном сосуде, зависит от высоты, то массу газа необходимо находить путем интегрирования выражения
![]() .
.
С учетом того, что плотность газа
уменьшается с высотой согласно закону
![]() ,
получим
,
получим
![]() .
.
Приведем данный интеграл к табличному виду, используя метод замены переменной:
![]() ,
где
,
где
![]() .
.
Откуда
![]() .
.
