
- •Ответы на вопросы части Кисиль Оглавление
- •Функциональные особенности.
- •Дополнительно.
- •Мал.1. Рослинна (1) і тваринна (2) клітини
- •Механізм трансляції Загальні відомості
- •А. Модель Михаэлиса-Ментен
- •Б. Определение V и Кm
- •Хлоропласт
- •Мітохондрія
- •If1 (inhibitory factor 1 — «інгібуючий фактор 1»)
- •Б удова і принцип роботи
- •Фізіологічна роль
- •Особенности протонного мотора бактерий:
Створення (завдяки окисленню в мітохондріях, чи поглинанню випромінювання в хлоропластах)
Н+АТФсинтаза
Хлоропласт
Мітохондрія
 дає
енергію для синтезу АТФ з АДФ і фосфорної
кислоти за допомогою ферменту
Н+АТФсинтази
.
дає
енергію для синтезу АТФ з АДФ і фосфорної
кислоти за допомогою ферменту
Н+АТФсинтази
.

Р ух
бактерій. Аналог
електродвигуна що працює на електростатичних
силах .
Дифузія
протонів викликає поступальний рух
білків MotA,Bщо
викликає обертання диску P.
Це заставляє обертатися джгутик. Для
одного оберту потрібно проходження
пари сотень іоній Н+.
Швидкість обертання 5-50 об/с.
ух
бактерій. Аналог
електродвигуна що працює на електростатичних
силах .
Дифузія
протонів викликає поступальний рух
білків MotA,Bщо
викликає обертання диску P.
Це заставляє обертатися джгутик. Для
одного оберту потрібно проходження
пари сотень іоній Н+.
Швидкість обертання 5-50 об/с.![]()
K-15. Теорія спряження біологічного окиснення та фосфорилювання.
Т ермодинамічне
представлення трансформації енергії
електронного транспорту (окисний процес)
у хімічну енергію молекул АТФ зображається
через два спряжені потоки—потік
окиснення Jp
і потік фосфорилювання Jф.
ермодинамічне
представлення трансформації енергії
електронного транспорту (окисний процес)
у хімічну енергію молекул АТФ зображається
через два спряжені потоки—потік
окиснення Jp
і потік фосфорилювання Jф.
Схематичне зображення спряження потоку окиснення Jр з потоком фосфорилювання Jф;ХF і Хф — узагальнені сили цих потоків
Схематично спряження цих двох потоків зображується у вигляді простого енергетичного перетворювача (конвертера) (рис. 12.6). За положеннями лінійної нерівноважної термодинаміки (частина І, розділ 2) дисипативну функцію для цих процесів запишемо таким чином:
Ф=JрХр+JфХф, (12.10)
де Хр і Хф — узагальнені сили, які спричинюють потоки Jр і .Jф. Спряжені потоки будуть залежати від Хр і Хф так:
Jp = L11Хр + L12Хф
Jф = L21Хр + L22Хф (12.11)
де LiJ — коефіцієнти зв'язку між потоками й узагальненими силами.
Ефективність спряження між потоками залежить від величини спряжених коефіцієнтів L12 i L21, які за співвідношенням взаємності Онзагера (2.22) однакові: L12 = L21 Визначимо відношення двох потоків з урахуванням (2.22):
J![]() ф
/
Jp
= (L21Хр
+ L22Хф
)/(
L11Хр
+ L12Хф)(12.12)
ф
/
Jp
= (L21Хр
+ L22Хф
)/(
L11Хр
+ L12Хф)(12.12)
Винесемо з виразу (12.12) Хр і домножимо чисельник і знаменник на
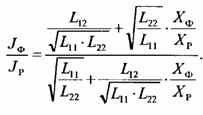
![]()
Введемо у вираз (12.13) такі позначення:
-![]() ступінь
спряженості двох потоків. Тоді
(12.13) набуде вигляду:при максимальній
спряженості потоків (# = 1)
—
= г.
ступінь
спряженості двох потоків. Тоді
(12.13) набуде вигляду:при максимальній
спряженості потоків (# = 1)
—
= г.
Анализуючи вараз
отримуємо
два крайніх
випадки: за відсутності спряженості
потоків окиснення і фосфорилювання
![]()
При
максимальній спряженості потоків
![]() Отже,
у реальній
ситуації
ступінь спряженості знаходиться в таких
межах:
0 <,= q
<,= 1
Отже,
у реальній
ситуації
ступінь спряженості знаходиться в таких
межах:
0 <,= q
<,= 1
K-16. Функции элктр\хим градиента протонов водорода в клетках зверей
Искусственная липидная мембрана для ионов практически не проницаема, биологические мембраны содержат «ионные каналы», по которым отдельные ионы избирательно проникают через мембрану. Проницаемость и полярность мембраны зависят от электрохимического градиента, т. е. от концентраций ионов по обе стороны мембраны (концентрационного градиента) и от разности электрических потенциалов между внутренней и внешней сторонами мембраны (мембранного потенциала).В состоянии покоя клеток мембранный потенциал составляет от -0,05 до -0,09 В, т.е. на внутренней стороне плазматической мембраны преобладает избыток отрицательных зарядов. Потенциал покоя обеспечивается катионами Na+ и K+, а также органическими анионами и ионом Cl- (1). Распределение ионов между внешней средой и внутренним объемом клетки описывается уравнением Нернста, где ΔΨG — трансмембранный потенциал (в вольтах, В), т.е. разность электрических потенциалов между двумя сторонами мембраны при отсутствии транспорта ионов через мембрану (потенциал равновесия). Для одновалентных ионов при 25оС множитель RT/Fn равен 0,026 В.
Ионы гидроксония («H+-ионы») также могут формировать электрохимический градиент. Такой протонный градиент имеет решающее значение для клеточного синтеза АТФ Как и в случае других ионов, свободная энергия переноса протона зависит от градиента концентрации, т. е. от разности рН (ΔpH) по ту и другую стороны мембраны. Кроме того, определенный вклад вносит и трансмембранный потенциал ΔΨ (см. А). Обе эти величины формируют протондвижущую силу Δp, являющуюся мерой работы ΔΨG , которую может совершать H+-градиент. Таким образом, протонный градиент через внутреннюю митохондриальную мембрану дает примерно 24 кДж на моль переносимых ионов H+.
Протонные градиенты формируются различными способами. Необычным протонным насосом является бактериородопсин, использующий энергию света При фотосинтезе восстановленный пластохинон (QH2) переносит протоны вместе с электронами через мембрану (Q-цикл, 2). Образование протонного градиента в дыхательной цепи также сопряжено с окислительно-восстановительным процессом. В комплексе III, по-видимому, как и при фотосинтезе, за перенос прогона ответствен Q-цикл В цитохром с-оксидазе (комплекс IV, 3) H+-транспорт сопряжен с электронным потоком от цитохрома с на О2.

K-17. Механізми транс локації електронів та протонів в мембранах мітохондрій.
Дане питання можна переформулювати в вигляді: які основні етапи та складові частини, що беруть участь в дихальному ланцюці.
В большынстве биохимических реакций дыхательной цепи окисление можно рассматривать как отщепление двух атомов водорода, каждый из которых состоит из протона и электрона. Протон в водном растворе существует в виде катиона Н+, и, если на время забыть об электронах, каждая из приведенных выше реакций будет сопровождаться закислением среды. Электроны в свободном виде в водном растворе существовать не могут, поэтому для протекания этих реакций белки-катализаторы должны содержать ловушку для электронов. В качестве такой ловушки в ферментах-дегидрогеназах служат относительно небольшие (по сравнению с размером белков) органические или неорганические молекулы или атомы разной химической природы. Эти молекулы принято называть кофакторами или простетическими группами. Существуют несколько типов свободных кофакторов. В качестве основного служит молекула никотинамидадениндинуклеотида (сокращенно NAD.
В процессе восстановления исходно окисленная молекула NAD (обозначают NAD+, по заряду участвующей в реакции группы) принимает два электрона и один протон. В грубом приближении можно считать, что все окислительные реакции, катализируемые дегидрогеназами, приводят к универсализации отщепленных атомов водорода и запасанию их в виде NADН. NAD+ и NADН хорошо растворимы в воде и присутствуют в значительных количествах в цитоплазме и митохондриях. Дыхательная цепь, состоящая из нескольких ферментов, прочно связанных с внутренней мембраной митохондрий, осуществляет окисление митохондриального NADН кислородом:
В присутствии кислорода два электрона в молекуле NADН стремятся перейти к молекуле кислорода, и такой переход сопровождается освобождением энергии.
Проследим теперь путь двух электронов от NADН к кислороду. Суммарный процесс разбит на три стадии, каждая из которых катализируется тремя липопротеидными комплексами, встроенными во внутреннюю мембрану митохондрий. Комплексы плавают в фосфолипидном море мембраны, так что верхушки и дно этих айсбергов контактируют с водными фазами матрикса и межмембранного пространства митохондрий. Жидкая липидная фаза разрешает двумерную диффузию комплексов в плоскости мембраны, так что комплексы могут встречаться между собой. Каждый комплекс катализирует окислительно-восстановительную реакцию - перенос электронов и, следовательно, как уже отмечалось, содержит в своем составе простетические группы, способные принимать и отдавать электроны. Комплекс I содержит в своем составе флавин (производное витамина рибофлавина) и более 20 атомов железа, упакованных в клетки, построенные из атомов серы. Комплекс III содержит железо как в серных клетках, так и в виде комплексов с порфиринами - сложными гетероциклическими молекулами, содержащими четыре атома азота. Такие комплексы называются гемами, а комплексы гемов с полипептидными цепями - цитохромами. В состав комплекса IV (дыхательный фермент Варбурга, цитохромоксидаза) помимо двух различных гемов входят несколько атомов меди, прочно связанных с белком. Кроме этих трех гигантских образований в состав дыхательной цепи входят еще два компонента. Один из них - небольшой белок (молекулярная масса около 13 тыс.), содержащий ковалентно связанный гем - цитохром с. Другой - нерастворимое в воде "жирное" соединение - убихинон, способное выполнять в гидрофобной фазе мембраны такую же функцию, какую выполняет NAD в водном окружении цитоплазмы или матрикса митохондрий, - запасать атомы водорода:
Убихинон (как окисленный, так и восстановленный) совершенно нерастворим в воде, но хорошо растворяется в средах с низкой диэлектрической постоянной ("жирные" среды). Длинный хвост убихинона, по-видимому, вытянут в плоскости гидрофобного слоя мембраны, а активная голова может располагаться либо в той же плоскости, либо приближаться к поверхностям мембраны, контактирующим с водными фазами. Важное свойство убихинона, которое понадобится нам при дальнейшем рассмотрении, состоит в том, что его голова может восстанавливаться ступенчато, принимая последовательно по одному электрону (и протону). При этом возникает полувосстановленная форма - убисемихинон.
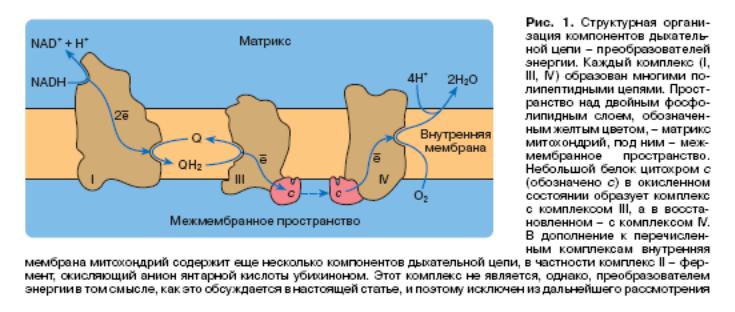
Первая стадия окисления NADН катализируется комплексом I, один активный центр которого контактирует с водной фазой матрикса (внутреннее пространство митохондрий) и связывает NADH. Два электрона, отщепленные от NADН, путешествуют по окислительно-восстановительным компонентам комплекса I и в конечном счете попадают на убихинон, который связывается с другим активным центром, расположенным внутри гидрофобной фазы мембраны. В результате происходит реакция

в ходе которой электроны из водного окружения (в молекуле NADН) попадают в "жирную" фазу мембраны (молекула убихинола). Энергетический потенциал (запас энергии) атомов водорода (Н+ + ) в молекуле убихинола существенно ниже, чем в молекуле NADН, и в результате реакции освобождается энергия.
Восстановленный убихинон (убихинол) отдает электроны из гидрофобной фазы в водное окружение - на атом железа гема цитохрома с. Этот процесс катализируется комплексом III (при этом электроны путешествуют по атомам железа в составе компонентов комплекса):

Энергетический потенциал электронов (теперь в цитохроме с) становится еще ниже. Окисленный цитохром с хорошо связывается с комплексом III, а восстановленный - с комплексом IV. Это означает, что комплексы III и IV умеют различать белковые молекулы окисленного и восстановленного цитохрома с (молекулярная масса около 13 тыс.), отличающиеся друг от друга всего на один электрон, - яркий пример того, что связывание малого по размеру лиганда (в данном случае электрона) способно приводить к изменению конформации белка!
Последняя стадия (теперь в реакцию дыхания вступает собственно кислород) катализируется комплексом IV:

и электроны, пройдя по атомам железа и меди в составе комплекса IV, попадают, наконец, на кислород, связывающийся в активном центре цитохромоксидазы, что приводит к образованию воды.
Суммарная реакция, катализируемая дыхательной цепью, таким образом состоит в окислении NADH кислородом, приводящем к образованию Н2О. Энергетический потенциал электронов в NADH, который по запасу энергии существенно больше, чем даже в молекуле водорода, оказывается плавно спущенным до стабильного состояния в молекуле воды. При этом освобождается энергия, достаточная для синтеза по крайней мере трех молекул АТР на каждую пару электронов, перенесенных от NADH к кислороду.
K-1 8. Молекулярна структура та модель функціонування Н+АТФ ази?
АТФ-синтаза — фермент що здійснює реакцію синтеза АТФ з АДФ і аніону фосфату зазвичай за рахунок енергії трансмембранного електрохімічного потенціалу протонів (тобто комбінації градієнту протонів і електричної напруги), а у деяких організмів за рахунок електрохімічного потенціалу іонів натрію, перетворюючи її, таким чином, на енергію хімічних зв'язків, яка потім може використовуватися клітиною в біохімічних реакціях. У випадку, коли фермент проводить зворотній процес — формує трансмембранний протонний градієнт за рахунок гідролізу АТФ, його можуть називати АТФазою. Дію ферменту інгібує антибіотик олігоміцин.

АТФ-синтаза F1F0 складається з двох субодиниць:
F0 мембранна частина комплексу
F1 частина комплексу в матриксі мітохондрій або цитоплазмі бактерій.
Номенклатура субодиниць АТФ-синтази досить складна та має довгу історію. F1-фракція отримала свою назву від терміну fraction 1 («фракція 1»), а F0 (що спочатку писалася з індексом «O», а не «ноль», як це більш прийнято зараз) отримала назву як фракція, що зв'язує олігоміцин.
За прикладом інших ферментів, більшість субодиниць отримали назви у вигляді грецьких (від α до ε) і латинських (від a до h) літер. Решта субодиниць отрималі більш складні назви:
