
Несколько лабораторных работ по химии / лабхим1
.docГосударственный комитет Российской Федерации
по высшему образованию
Санкт-Петербургский государственный университет
им. В. В. Ульянова (Ленина)
Кафедра физической химии
Определение эквивалентной массы металла
Отчёт по лабораторной работе №1
Преподаватель: Кузнецов Владимир
Владимирович
Студент, гр.: Фёдоров Денис
Сергеевич 2211
17.09.2002
2002г.
1.1. Цель работы:
Определение эквивалентной массы металла, которая находится методом вытеснения водорода из раствора кислоты.
1.2. Основные теоретические положения, лежащие в основе работы:
Эквивалентом вещества называется такое его количество, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой называется масса одного эквивалента вещества.
Согласно закону
эквивалентов массы, вступающих в реакцию
веществ, пропорциональны эквивалентам
этих веществ:
![]() ,
где m1
и m2
– массы
реагирующих веществ, кг; Э1
и Э2
– их эквиваленты.
,
где m1
и m2
– массы
реагирующих веществ, кг; Э1
и Э2
– их эквиваленты.
Эквивалентная
масса элемента:
![]() ,
где A
– масса
одного моля атомов элемента, n
– его валентность.
,
где A
– масса
одного моля атомов элемента, n
– его валентность.
1.3. Формулы для вычисления, перечень символов:
![]() ;
;
![]() ;
где Vt
– объём полученного водорода; V0
– объём
выделившегося водорода при нормальных
условиях (T0=273
К, P0=101325
Па), м3;
;
где Vt
– объём полученного водорода; V0
– объём
выделившегося водорода при нормальных
условиях (T0=273
К, P0=101325
Па), м3;
![]() – парциальное давление водорода, Па; T
– температура опыта, К.
– парциальное давление водорода, Па; T
– температура опыта, К.
![]() ;
где ЭМЕ
– эквивалентная масса металла, кг/моль;
mМЕ
– навеска металла, кг; 0,0112 – эквивалентный
объём водорода при нормальных условиях,
м3/моль.
;
где ЭМЕ
– эквивалентная масса металла, кг/моль;
mМЕ
– навеска металла, кг; 0,0112 – эквивалентный
объём водорода при нормальных условиях,
м3/моль.
Относительная
погрешность находится по формуле:
![]() .
.
2.1. Методика эксперимента:
Перед выполнением эксперимента у преподавателя были получены опилки неизвестного металла. После этого прибор был проверен на герметичность. Потом была собранна установка, приведённая на схеме.
В пробирку было налито 5 мл раствора соляной кислоты и помещены опилки металла. Выделяющийся водород собирался с помощью газоотводной трубки и эвдиометра.
После выполнения эксперимента были произведена обработка полученных результатов.
2
1
3
4
5


2
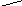

1 – штатив; 2 – чашка с водой; 3 – эвдиометр;
4 – пробирка с газоотводной трубкой; 5 – деревянный штатив
2.3. Экспериментальные результаты работы:
|
Навеска металла mМЕ, кг |
Условия опыта |
Объём водорода Vt, м3 |
Парциальное давление водорода PH2=P-h, Па |
||
|
Температура T, К |
Атмосферное давление P, Па |
Парциальное давление водяного пара h, Па |
|||
|
8,02*10-5 |
298 |
101800 |
3167,2 |
29,5*10-6 |
98632,8 |
2.4. Обработка результатов:
![]()
![]()
Zn:
A=65,38; n=2;
![]()
Mg: A=24,3; n=2; ЭТ=12,2
Al: A=26,9; n=3; ЭТ=9
Следовательно, металл, использованный в эксперименте, – это цинк.
Погрешность:
![]() ,
то есть относительная погрешность равна
4,3%.
,
то есть относительная погрешность равна
4,3%.
А абсолютная погрешность равна 32,7-34,1=-1,4.
2 H Cl + Zn→Zn Cl2 + H2↑
2 H+
+ 2
Cl-
+ Zn2+→Zn2+
+ 2
Cl-
+ H2↑
2 H+→ H2↑
Вывод:
В процессе выполнения лабораторной работы была достигнута цель работы, то есть мы определили химический эквивалент металла, использованного в эксперименте. Кроме того, по данным опыта и по теоретическим расчётам была найдена погрешность, и определёно название металла.
