
Несколько лабораторных работ по химии / лабхим3
.docГосударственный комитет Российской Федерации
по высшему образованию
Санкт-Петербургский государственный университет
им. В. В. Ульянова (Ленина)
Кафедра физической химии
Скорость химических реакций
Отчёт по лабораторной работе №3
Преподаватель: Кузнецов Владимир
Владимирович
Студент, гр.: Фёдоров Денис
Сергеевич 2211
30.10.2002
2002г.
Цель работы:
Изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции.
Основные теоретические положения, лежащие в основе работы:
Согласно закону действия масс для реакции типа mA + nB скорость равна v = k[A]m[B]n, где k – константа скорости реакции, зависящая от природы реагирующих веществ; [A], [B] – концентрации реагирующих веществ, моль·л-1; m, n – стехиометрические коэффициенты.
Скорость большинства гомогенных реакций согласно эмпирическому правилу Вант-Гоффа при повышении температуры на 10º увеличивается в 2-4 раза.
![]() ,
где γ – температурный коэффициент
реакции, принимающий значения 2-4 для
большинства реакций; vt1
и vt2
– скорости
реакции при температурах t1
и t2
.
,
где γ – температурный коэффициент
реакции, принимающий значения 2-4 для
большинства реакций; vt1
и vt2
– скорости
реакции при температурах t1
и t2
.
Условием реакции является столкновение молекул, однако результативными оказываются те столкновения, в которых принимают участие «активные» молекулы. При повышении температуры энергия вещества возрастет и перераспределяется между молекулами таким образом, что значительно увеличивается число активных молекул, то есть таких молекул, которые в момент столкновения обладают некоторым избытком энергии над средней энергией частиц. Избыточная энергия носит название энергии активации. Энергией активации реакции называется минимальная энергия (в расчёте на один моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к реакции.
Интегрирование в интервале T1 – T2 уравнения Аррениуса
![]() при допущении, что
в малом температурном интервале E не
зависит от температуры, позволяет
вычислить энергию активации:
при допущении, что
в малом температурном интервале E не
зависит от температуры, позволяет
вычислить энергию активации:
![]() , где E
– энергия активизации, кДж; R
– универсальная газовая постоянная
(8,314 кДж·моль-1·град-1);
T1,
T2
– абсолютная
температура, К.
, где E
– энергия активизации, кДж; R
– универсальная газовая постоянная
(8,314 кДж·моль-1·град-1);
T1,
T2
– абсолютная
температура, К.
Для приближённых расчётов отношение k2/k1 может быть заменено отношением vt2/vt1.
Для исследования зависимости скорости реакции от концентрации и температуры используется реакция взаимодействия серной кислоты H2SO4 и тиосульфата натрия Na2S2O2. Эта реакция протекает в две стадии:
-
Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4
-
H2S2O3 = H2O + SO2↑ + S↓
Экспериментально доказано, что первая стадия протекает с большой скоростью. Скорость всей реакции в целом определяется скоростью второй (медленной) стадии: v = k[H2S2O3].
Поскольку концентрация H2S2O3 в растворе прямо пропорциональна концентрации Na2S2O3 , скорость реакции можно рассматривать как:
v = k[Na2S2O3]
Содержание работы:
Опыт 1. Зависимость скорости реакции от концентрации Na2S2O3.
В три большие пробирки, согласно заданию, наливали раствор Na2S2O3 и воду. Затем в три маленькие пробирки, согласно заданию, наливали раствор H2SO4. В большую пробирку с раствором Na2S2O3 приливали раствор H2SO4 (из маленькой пробирки) и замеряли секундомером, через сколько секунд после сливания растворов наблюдалось появление серы (помутнение раствора).
Результаты измерений приведены в таблице 1.
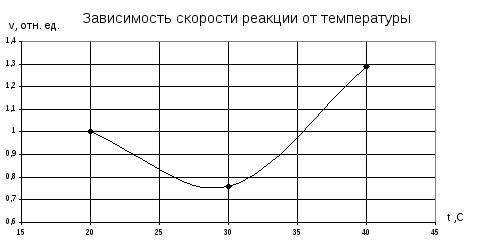
Опыт 2. Зависимость скорости реакции от температуры.
В большую пробирку было налито 10 мл раствора Na2S2O3 , в маленькую – 10 мл раствора H2SO4 . Сначала пробирки слили вместе и отметили время до образования серы при комнатной температуре ( 20º ). Затем тот же опыт проделали при 30º и 40º.
Результаты приведены в таблице 2.
Обработка результатов:
Таблица 1
|
№ зада-ния |
№ опы-та |
Объём, мл |
Концентрация Na2S2O3
|
Время τ, с |
Относ. ско-рость реакции |
|
|
Na2S2O3+H2O (a) (b) |
H2SO4 (c) |
|||||
|
1 |
1 2 3 |
5 + 5 10 + 10 15 + 15 |
5 5 5 |
0,33 0,4 0,43 |
τ1=72 τ2=65 τ3=68 |
1 τ1/τ2=1,11 τ1/τ3=1,06 |
|
2 |
1 2 3 |
5 + 10 10 + 5 15 + 0 |
5 5 5 |
0,25 0,5 0,75 |
τ1=90 τ2=62 τ3=44 |
1 τ1/τ2=1,45 τ1/τ3=2,05 |
|
3 |
1 2 3 |
10 + 10 15 + 5 20 + 0 |
5 5 5 |
0,4 0,6 0,8 |
τ1=58 τ2=54 τ3=34 |
1 τ1/τ2=1,07 τ1/τ3=1,71 |
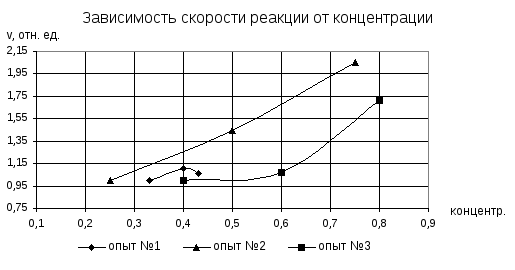
Таблица 2
|
№ опы-та |
Объём, мл |
Температура t, ºC |
Время τ, с |
Относ. скорость реакции |
|
|
Na2S2O3 |
H2SO4 |
||||
|
1 2 3 |
10 10 10 |
10 10 10 |
t1=20 t2=30 t3=40 |
τ1=22 τ2=29 τ3=17 |
1 τ1/τ2=0,76 τ1/τ3=1,29 |
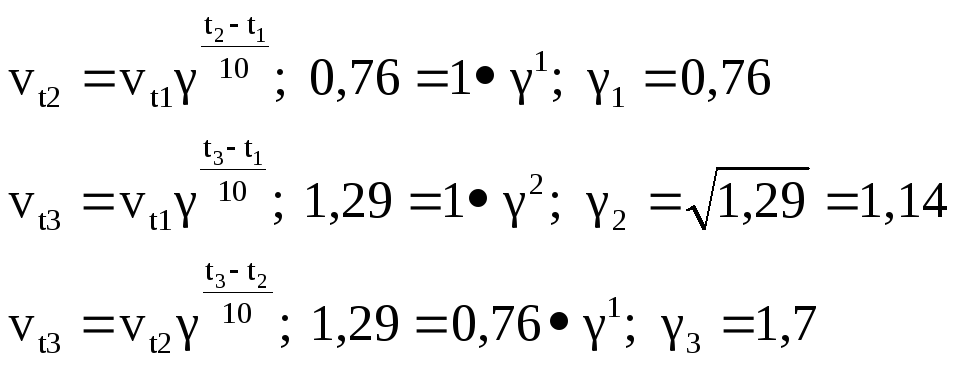
![]() ;
E21=-20223,9
Дж; E31=9692,3
Дж; E32=41650,5
Дж
;
E21=-20223,9
Дж; E31=9692,3
Дж; E32=41650,5
Дж
Вывод:
Мы на практике убедились в том, скорость гомогенной химической реакции зависит как от концентрации веществ, вступающих во взаимодействие, так и от температуры растворов используемых в опыте. К сожалению нам не удалось убедиться в правильности правила Вант-Гоффа из-за неточности измерений. Как видно график зависимости скорости реакции от температуры не является постоянно возрастающим. Соответственно коэффициент Вант-Гоффа получился меньше двух.
