
Семинары по химии / СЕМИНАР_3_с
.doc
СЕМИНАР 3. ХИМИЧЕСКАЯ
СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ. КОМПЛЕКСНЫЕ
СОЕДИНЕНИЯ
1. Химическая связь и строение молекул
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кристаллах, характеризуемый определенной энергией. При всем многообразии химических связей их природа едина и носит электростатический характер.
Механизм образования химической связи может быть смоделирован различными способами. Простейшим является метод валентных связей (ВС), предложенный Льюисом.
Метод валентных связей рассматривает химическую связь как результат притяжения ядер двух атомов к одной или нескольким общим для них электронным парам. Такая двух электронная и двух центровая связь, локализованная между двумя атомами, называется ковалентной.
Принципиально возможны два механизма образования ковалентной связи:
1. спаривание электронов двух атомов при условии противоположной ориентации их спинов;
2. донорно-акцепторное взаимодействие, при котором общей становится готовая электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора).
Причиной образования любого типа химической связи является понижение энергии системы, которая сопровождает этот процесс. Разность энергии начального и конечного состояния системы называется энергией связи (Есв) и определяется количеством теплоты, выделяющейся при её образовании. Энергия ковалентных химических связей оценивается значениями порядка 125-1050 кДж/моль.
Расстояние между ядрами двух связанных атомов называется длиной связи. Длина и энергия связи зависят от её кратности, которая определяется числом электронных пар, связывающих два взаимодействующих атома. Чем кратность связи выше, тем больше энергия связи и меньше длина.
Ковалентную связь характеризуют насыщаемость, направленность и полярность.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определённого числа связей, которое обычно лежит в пределах: от 1 до 6. Насыщаемостью ковалентной связи называется степень заполнения валентных орбиталей при образовании химического соединения. Когда все орбитали валентного уровня атома заполнены связь считается насыщенной.
Общее число валентных орбиталей в атоме определяет максимально возможную ковалентность элемента. Число уже использованных для этого орбиталей определяет ковалентность элемента в данном соединении.
Если атом образует все связи только за счёт спаривания электронов, то обычно говорят просто о его валентности, которая определяется числом неспаренных электронов в основном или возбуждённом состояниях.
Если атом образует связи по обменному и донорно-акцепторному механизмам, то говорят о ковалентности.
Пример. В
молекуле аммиака
![]() три электронные пары образуют три связи
три электронные пары образуют три связи
![]() ,
четвертая пара внешних электронов
является неподеленной, она может дать
связь с ионом водорода, в результате
чего получается ион аммония
,
четвертая пара внешних электронов
является неподеленной, она может дать
связь с ионом водорода, в результате
чего получается ион аммония
![]() .
Он имеет четыре ковалентные связи. При
этом все четыре связи
.
Он имеет четыре ковалентные связи. При
этом все четыре связи
![]() равноценны, а валентные уровни полностью
заполнены (т.е. нет свободных валентных
орбиталей, они насыщены). Поэтому процесс
присоединения еще одного атома водорода
с образованием иона NH52+
невозможно. В таком случае валентность
азота в молекуле
равноценны, а валентные уровни полностью
заполнены (т.е. нет свободных валентных
орбиталей, они насыщены). Поэтому процесс
присоединения еще одного атома водорода
с образованием иона NH52+
невозможно. В таком случае валентность
азота в молекуле
![]() равна трём, а в комплексном ионе
равна трём, а в комплексном ионе
![]() – ковалентность равна четырем.
– ковалентность равна четырем.
Аналогичен пример
с
![]() и
и
![]() .
Валентность бора в молекуле
.
Валентность бора в молекуле
![]() равна трём, а в комплексном ионе
равна трём, а в комплексном ионе
![]() – ковалентность равна четырем.
– ковалентность равна четырем.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счёт возможно большей электронной плотности между ядрами взаимодействующих атомов. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s- электронные орбитали, поскольку они имеют сферическую форму. Перекрывание орбиталей может осуществляться различным образом: , , - способами. При образовании - связи возникает одна область перекрывания орбиталей, осесимметричная относительно линии, соединяющей ядра – межъядерной оси.
После образования между двумя атомами - связи для остальных электронных орбиталей той же формы и с тем же главным квантовым числом остаётся только возможность бокового перекрывания по разные стороны от линии связи, перпендикулярно которой в этом случае проходит узловая плоскость. В результате образуются - или - связи. В первом случае возникают две, во втором – четыре области перекрывания.
Число - связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа.
Связи, образованные атомом за счёт орбиталей с различным значением орбитального квантового числа, должны быть энергетически неравноценными, что, однако, не подтверждается экспериментом. В подобных случаях пользуются представлением о гибридизации орбиталей (Л. Полинг), согласно которым при образовании связи орбитали разной симметрии смешиваются и превращаются в гибридные орбитали одинаковой формы и усредненной энергии, что обеспечивает равноценность образуемых ими связей.
Таким образом, гибридизацией атомных орбиталей называется перестройка электронной структуры атома при образовании химической связи, при которой вместо исходных атомных s-, p- и d-электронных облаков образуются равноценные “смешанные” или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов.
В гибридизации могут участвовать не только одноэлектронные, но так же двухэлектронные атомные орбитали. В этом случае, на гибридных орбиталях остаётся такое же число неподеленных электронных пар, которое было на исходных атомных орбиталях.
Геометрическая конфигурация молекул полностью определяется типом гибридизации орбиталей центрального атома только при условии, что все гибридные атомные орбитали участвуют в образовании связей. Если же хотя бы на одной из них остаётся неподеленная электронная пара, то конфигурация, определяемая типом гибридизации не реализуется.
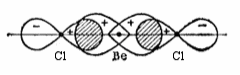
Пример. Рассмотрим молекулу хлорида бериллия. Каждый атом хлора, входящий в состав молекулы BeCl2, обладает одним неспаренным р-электроном, который участвует в образовании ковалентной связи:

Атом бериллия в невозбужденном состоянии (1s22s2) неспаренных электронов не имеет:
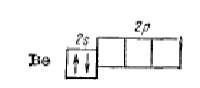
Поэтому для участия в образовании химических связей атом бериллия должен перейти в возбужденное состояние (1s22s1р1):

Образовавшийся возбужденный атом бериллия обладает двумя неспаренными электронами: электронное облако одного из них соответствует состоянию 2s, другого 2р. при перекрывании этих электронных облаков с р-электронными облаками двух атомов хлора образуются ковалентные связи

При затрате некоторой энергии вместо исходных s- и р-орбиталей атома бериллия образуются две равноценные гибридные sр-орбитали, вытянутые в противоположных направлениях, поскольку это состояние является наиболее энергетически выгодным (sр-гибридизация, которая носит название линейной или диагональной):
Следующий пример. Молекула фторида бора имеет симметричную треугольную форму, поскольку:
атомы фтора являются равноценными при образовании связей с атомом бора, следовательно, силы притяжения и отталкивания между ними равны;
каждый атом фтора, входящий в состав молекулы BF3, обладает одним неспаренным р-электроном, который участвует в образовании ковалентной связи
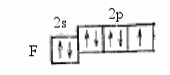
атом бора имеет следующую электронную конфигурацию на валентном уровне: 5В[2Нe]2s22p1
Таким образом,
имеет место sp2-гибридизация
и молекула
![]() имеет следующую форму:
имеет следующую форму:
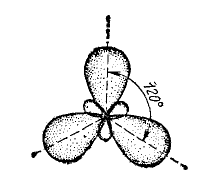
Метод валентных связей позволяет объяснить полярность ковалентной связи. Если электроотрицательность атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается симметрично по отношению к обоим ядрам. Такая ковалентная связь называется неполярной (гомоядерные молекулы).
Если электроотрицательность атомов различная, то электронная пара смещается в сторону более электроотрицательного атома. В этом случае центры (+) и (-) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов (+ и -), расстояние между которыми (l) называют длиной диполя. Подобные ковалентные связи называют полярными. Степень полярности такой связи оценивается значением электрического момента диполя- , равного произведению эффективного заряда на длину диполя
=q·l. (1)
Наконец, если разница электроотрицательностей () превышает 1,9, то образуется ионная связь – предельный случай ковалентной полярной связи. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.
Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов.
Вторым способом объяснения ковалентной химической связи является метод молекулярных орбиталей. В этом случае химическая связь рассматривается как результат распределения электронов в молекуле по соответствующим молекулярным орбиталям, которые находят в наиболее простом приближении методом линейной комбинации атомных орбиталей. Из n-го числа атомных орбиталей образуется n-ое число молекулярных орбиталей.
Перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей, одна из которых имеет более низкую, а другая более высокую энергию, чем первоначальные атомные орбитали. Соответственно эти молекулярные орбитали называют связывающей и разрыхляющей. Заполнение молекулярных орбиталей происходит так же как и атомных, т.е. в соответствии с принципом Паули и правилом Хунда.
Пример. Рассмотрим энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО) и то, как метод МО объясняет парамагнитные свойства молекулы кислорода.

На этой схеме по
краям нанесены энергии атомных орбиталей
(АО), а в середине - молекулярных (МО).
Взаимодействующие атомные и образующиеся
молекулярные орбитали соединены
линиями. Две нижние по энергии 2s- АО
порождают две нижние связывающую
![]() и разрыхляющую
и разрыхляющую
![]() МО.
Самой нижней по энергии молекулярной
орбиталью, образуемой двумя наборами
трижды вырожденных р-орбиталей, является
связывающая связывающая
МО.
Самой нижней по энергии молекулярной
орбиталью, образуемой двумя наборами
трижды вырожденных р-орбиталей, является
связывающая связывающая
![]() орбиталь, поскольку
орбиталь, поскольку
![]() -перекрывание
pz- pz АО больше, чем
-перекрывание
pz- pz АО больше, чем
![]() и
и
![]() .
Соответственно наибольшее расщепление
уровней приводит к тому, что самой
верхней по энергии является разрыхляющая
.
Соответственно наибольшее расщепление
уровней приводит к тому, что самой
верхней по энергии является разрыхляющая
![]() орбиталь.
Между
орбиталь.
Между
![]() связывающей
и
связывающей
и
![]() разрыхляющей
орбиталями находятся
разрыхляющей
орбиталями находятся
![]() и
и
![]() связывающие
и
связывающие
и
![]() ,
,
![]() разрыхляющие МО.
разрыхляющие МО.
![]() -молекулярные орбитали дважды вырождены,
так как перекрывание рх и рy
АО совершенно одинаково. Наличие двух
неспаренных электронов с параллельными
спинами на дважды вырожденных разрыхляющих
-молекулярные орбитали дважды вырождены,
так как перекрывание рх и рy
АО совершенно одинаково. Наличие двух
неспаренных электронов с параллельными
спинами на дважды вырожденных разрыхляющих
![]() *-орбиталях
объясняет парамагнетизм кислорода.
*-орбиталях
объясняет парамагнетизм кислорода.
Водородной называют связь образуемую атомом водорода, который ковалентно связан с атомом сильно электроотрицательного элемента А и другим подобным атомом В:
![]()
Чем выше
электроотрицательность атомов А и
В, тем больше эффективные заряды
![]() на атоме Н и
на атоме Н и
![]() на атоме В, а следовательно, тем сильнее
между ними электростатическое
взаимодействие и прочнее водородная
связь.
на атоме В, а следовательно, тем сильнее
между ними электростатическое
взаимодействие и прочнее водородная
связь.
Силы взаимодействия между молекулами, которые называют ван-дер-ваальсовыми или межмолекулярными, обусловлены тремя видами взаимодействия: ориентационное, индукционное и дисперсионное. С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают и, как следствие, повышаются температуры плавления и кипения веществ.
2 Комплексные соединения
Строение комплексных соединений и их поведение в растворе объясняет координационная теория, созданная в конце 19-го века швейцарским химиком Вернером.
Комплексными называют соединения, в структуре которых можно выделить центральный атом - акцептор электронов, находящийся в донорно-акцепторной связи с определенным числом доноров – лигандов (аддендов). Лигандами могут быть как ионы, так и нейтральные молекулы. Центральный атом и лиганды образуют внутреннюю сферу комплексного соединения, которую при записи формулы выделяют квадратными скобками. Внутренняя сфера часто имеет заряд, который компенсируют противоположно заряженные ионы, располагающиеся во внешней сфере. Внешнесферные ионы не имеют связей с центральным атомом, а образуют ионные связи с комплексными ионами. Поэтому в полярных растворителях комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
![]() калия гексацианоферрат (Ш)
калия гексацианоферрат (Ш)
![]() сульфатотетраамминокобальта (Ш) хлорид
сульфатотетраамминокобальта (Ш) хлорид
В первом случае в растворе практически отсутствуют цианид-ионы, поэтому соединение не относится к сильнодействующим ядам. Второе соединение будет давать в растворе качественную реакцию на хлорид-ион (образование осадка AgCl) и не будет давать осадок BaSO4 с растворами солей бария.
Первое соединение
является анионным комплексом, поскольку
содержит в своей структуре и образует
при диссоциации в растворе комплексные
анионы. Второе соединение является
катионным комплексом. Существуют и
нейтральные комплексы, у которых
внутренняя сфера не имеет заряда,
соответственно, внешняя сфера отсутствует,
например:
![]() - дихлородиамминоплатина (П).
- дихлородиамминоплатина (П).
Число связей,
образуемых лигандом с центральным
атомом, называют дентатностью лиганда.
Например,
![]() ,
,
![]() - монодентатные лиганды, а сульфат-ион
- бидентатный лиганд. Число связей,
образуемых центральным атомом с
лигандами, называют координационным
числом. Если лиганды монодентатные,
координационное число равно числу
лигандов: в первом примере - 6, в третьем
примере - 4. Однако во втором примере
число лигандов равно 5, а координационное
число кобальта - 6, поскольку сульфат-ион
бидентатен.
- монодентатные лиганды, а сульфат-ион
- бидентатный лиганд. Число связей,
образуемых центральным атомом с
лигандами, называют координационным
числом. Если лиганды монодентатные,
координационное число равно числу
лигандов: в первом примере - 6, в третьем
примере - 4. Однако во втором примере
число лигандов равно 5, а координационное
число кобальта - 6, поскольку сульфат-ион
бидентатен.
Таким образом, координационным числом (или координационной валентностью) называется общее количество лигандов, входящих в состав внутренней сферы комплекса (собственно комплексный ион). Известны координационные числа от 1 до 9 (по порядку) и 12. чаще других встречаются координационные числа 2, 4, 6. эти числа соответствуют наиболее симметричным пространственным конфигурациям комплексных соединений:
6 – октаэдрической;
4 – тетраэдрической;
2 – линейной.
Координационное число зависит от природы комплексообразователя, соотношения размеров атома-комплексообразователя и лигандов, концентрации раствора комплексного соединения. Следует помнить, что:
1. чем выше степень окисления комплексообразователя, тем больше координационное число.
Пример.
![]()
2. незаряженые лиганды обычно присоединяются к атому-комплексообразователю в количестве большем, чем заряженые
Пример.
![]()
При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды - анионы и в конце формулы записывают внешнесферные анионы.
Названия комплексных соединений утверждены комиссией по номенклатуре неорганических соединений Международного Союза по теоретической и прикладной химии (IUPAC) и подчиняются следующим правилам образования:
-
первым называется катион, затем анион;
-
нейтральные группы называются также, как молекулы; исключениями являются “акво-” (
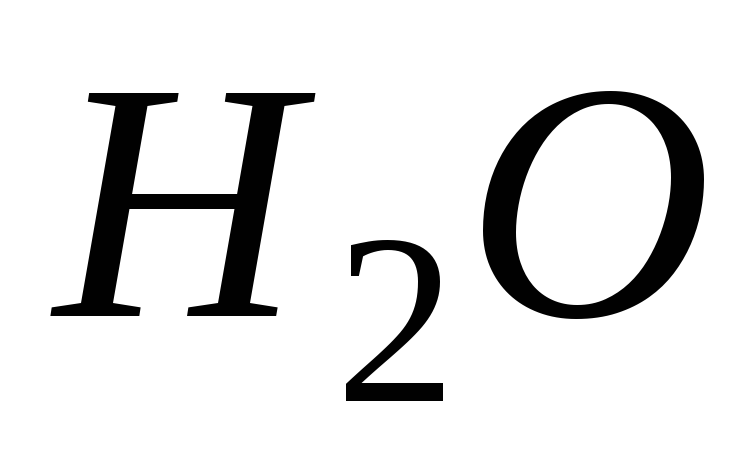 )
и “амино-” (
)
и “амино-” (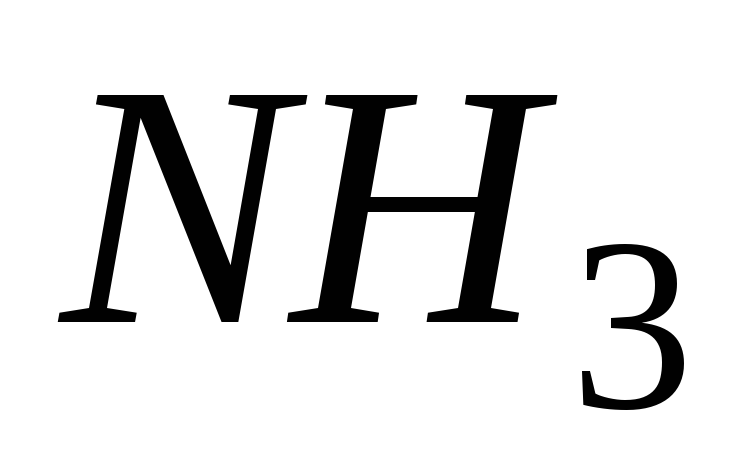 );
); -
название внутренней сферы произносят в одно слово, используя соединительную гласную -о-, название комплексного аниона заканчивают суффиксом –ат;
-
степень окисления центрального атома при записи названия комплекса указывают римской цифрой в круглых скобках, заряды ионов - арабскими цифрами.
Пример.
Рассмотрим определение заряда комплекса,
степень окисления комплексообразователя
и его координационное число в следующих
соединениях
![]() и
и
![]() ,
и напишем уравнения диссоциации
(первичной и вторичной) этих соединений.
,
и напишем уравнения диссоциации
(первичной и вторичной) этих соединений.
![]() калия
тетрайодомеркурат. Заряд комплексного
аниона = -2, степень окисления
комплексообразователя = +2, координационное
число = 4.
калия
тетрайодомеркурат. Заряд комплексного
аниона = -2, степень окисления
комплексообразователя = +2, координационное
число = 4.
![]() - первая ступень
- первая ступень
![]() - вторая ступень
- вторая ступень
![]() пероксооксотетрагидрованадия
хлорид. Заряд комплексного катиона =
+1, степень окисления комплексообразователя
= +3, координационное число = 6.
пероксооксотетрагидрованадия
хлорид. Заряд комплексного катиона =
+1, степень окисления комплексообразователя
= +3, координационное число = 6.
![]()
K3[Y(SO4)3]: заряд комплекса (-3)
степень окисления комплексообразователя (+6)
координационное число комплексообразователя в соединении три
название калия трисульфоиттрит
первичная
диссоциация:![]()
вторичная
диссоциация:
![]()
[Ti(H2O)4Cl2]Cl: заряд комплекса (+1)
степень окисления комплексообразователя (+3)
координационное число комплексообразователя в соединении шесть
название дихлортетрагидротитана хлорид
