
- •2.1.Углеводороды.
- •2.1.1.Алканы.
- •2.1.2.Циклоалканы.
- •Номенклатура
- •2.1.3.Алкены
- •2.1.4.Алкины
- •2.1.5.Алкадиены
- •2.1.6.Арены
- •2.2.Гидроксисоединения.
- •2.2.1.Одноатомные спирты.
- •2.2.2.Фенолы.
- •2.2.3.Простые эфиры.
- •Приведенное выше расщепление диметилового эфира представляет собой sn2 реакцию. Однако другие простые эфиры могут расщепляться и по механизму sn1. I
- •2.2.6.Двухатомные фенолы.
- •2.3.Оксосоединения.
- •Номенклатура карбонильных соединений.
- •2.4.Карбоновые кислоты
- •2.4.1.Особенности дикарбоновых кислот.
- •2.5.Функциональные производные карбоновых кислот.
- •2.6.Амины.
2.2.3.Простые эфиры.
Простые эфиры можно рассматривать как производные спиртов или фенолов, в которых атом водорода замещен на какой-либо углеводородный радикал:
R-O - R R-O - C6H5
Согласно номенклатуре ИЮПАК простые эфиры называют, прибавляя к названию главной цепи в качестве префикса название алкокси-группы (R-O ) или для эфиров фенолов - арилоксигруппы (Ar-O-), например:
CH3- CH2 - O- CH2-CH2- CH3 C6H5 -O - C6H13
этоксипропан феноксигептан
Простые эфиры называют так же, используя названия радикалов с добавлением окончания - овый эфир, например:
CH3-CH2-O- CH2CH3 CH3- O- CH=CH2
диэтиловый эфир метилвиниловый эфир
Получение простых эфиров.
Общим способом получения простых эфиров является действие алкоксидов или феноксидов на алкилгалогениды:
RO-Na + R - I R-O- R + NaI
С6Н5- ОNa + R- Br C6H5OR + NaBr
Простые эфиры спиртов можно получать дегидратацией двух молекул спирта в присутствии кислоты. Этим методом получают лишь симметричные эфиры:
кислота
2 R-OH R-O-R + H2O
Образование эфира в результате межмолекулярной дегидратации служит примером нуклеофильной атаки на протонированный по гидроксилу спирт другой молекулой спирта:
Физические свойства простых эфиров.
Простые эфиры – жидкости с низкими температурами кипения. Объясняется это тем, что простые эфиры не образуют водородных связей из - за отсутствия подвижного атома водорода. Так, этиловый спирт кипит при 780С, а диэтиловый эфир с большей молекулярной массой - 360 С. Большинство простых эфиров не смешиваются с водой, хорошо растворяют многие органические вещества и поэтому часто используются как растворители, но они весьма огнеопасны.
Химические свойства.
Простые эфиры –значительно более инертные соединения, чем спирты, где химическая активность обусловлена наличием гидроксильной группы. Простые эфиры устойчивы к действию щелочных металлов и щелочей, однако эфиры являются слабыми основаниями: в сильнокислой среде за счет протонирования атома кислорода превращаются в нестойкие оксониевые соединения, легко гидролизующиеся при действии избытка воды:
![]()
гидрохлорид диэтилоксония
Наиболее важной реакцией простых эфиров является их расщепление под действием иодистоводородной или бромистоводородной кислоты при нагревании.
![]()
Приведенное выше расщепление диметилового эфира представляет собой sn2 реакцию. Однако другие простые эфиры могут расщепляться и по механизму sn1. I
П ри
хранении, особенно на свету, простые
эфиры медленно окисляются кислородом
воздуха, образуя крайне взрывчатые
гидропероксиды, поэтому работа с простыми
эфирами требует крайней осторожности.
ри
хранении, особенно на свету, простые
эфиры медленно окисляются кислородом
воздуха, образуя крайне взрывчатые
гидропероксиды, поэтому работа с простыми
эфирами требует крайней осторожности.
2.2.4. α - Оксиды
-Оксиды (эпоксиды) являются так же простыми эфирами, например:
 Этиленоксид
Циклогексеноксид
Этиленоксид
Циклогексеноксид
- Оксиды - это особого рода эфиры, так как валентные углы в их молекулах искажены и атомы не могут быть расположены так, чтобы обеспечить максимальное перекрывание орбиталей, следствием чего является их высокая реакционная способность. α-Оксиды очень легко вступают в реакции, катализируемые как кислотой, так и основанием. Важная особенность эпоксисоединений - образование соединений, содержащих две функциональные группы. Так, при взаимодействии с водой образуются 1,2-диолы (гликоли) – (1), с аминами - аминоспирты(2), cо спиртами - алкоксиспирты(3) и т.д.
Н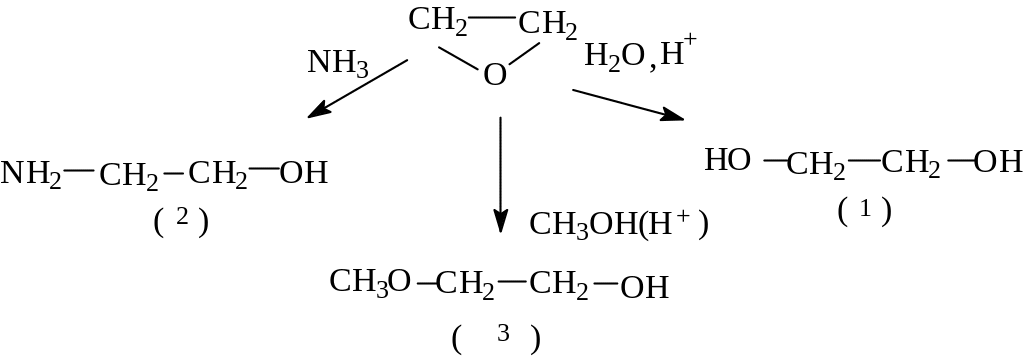 апример:
апример:
Считается, что введение гидроксильной группы во многие природные соединения происходит через стадию - эпоксида - промежуточного соединения, образующегося при действии кислорода на двойную углерод - углеродную связь в присутствии соответствующего фермента (оксигеназы).
Из соединений, относящихся к простым эфирам, большой интерес представляют так называемые “краун” эфиры. Свое название они получили в соответствии с особенностями их пространственного строения. Это макроциклические структуры, в состав которых входят атомы кислорода. При их названии вначале указывается общее число атомов в цикле, а затем - число атомов кислорода в нем. Например:

18-краун-6
Уникальное свойство краун-эфиров состоит в способности образовывать комплексы с солями щелочных металлов. Эти комплексы получаются за счет электростатического взаимодействия соответствующего катиона и отрицательных концов С-О - диполей циклического эфира. Краун – эфиры - перспективные комплексообразователи, c помощью них можно моделировать транспорт ионов через клеточные мембраны. Примером может служить 18-краун-6, образующий прочный комплекс с ионом калия:

2.2.5.Двухатомные спирты, или гликоли.
Если в углеводороде заместить два атома водорода у разных атомов углерода на гидроксильные группы, то образуются двухатомные спирты, или гликоли. Если две или три гидроксильные группы содержатся у одного атома углерода, то такие соединения нестабильны: они легко теряют воду и превращаются в карбонильные соединения (1) или кислоты (2):
 (1)
(2)
(1)
(2)
Физические свойства гликолей.
Увеличение числа гидроксильных групп в диолах приводит к тому, что увеличивается число межмолекулярных водородных связей между молекулами спирта, вследствие чего температуры кипения диолов еще выше, чем у спиртов Так, этандиол-1,2( этиленгликоль) кипит при температуре 1980С (этанол имеет температуру кипения 780С).
Химические свойства гликолей.
Гликоли - это спирты, и большая часть химических свойств гликолей является химическими свойствами спиртов, которые были уже обсуждены. Отметим лишь некоторые отличия. По сравнению с одноатомными спиртами гликоли обладают большей кислотностью (для этиленгликоля рН =14,7), поэтому водород в гликолях более подвижен, чем в спиртах. Так, качественной реакцией на диолы является образование окрашенных хелатных соединений с гидроксидами тяжелых металлов:
 cинее
окрашивание
cинее
окрашивание
Г ликоли
дают все реакции, характерные для
одноатомных спиртов, с той лишь разницей,
что реакция может затрагивать либо
одну, либо две гидроксильные группы,
давая два ряда производных: моно - и
дизамещенные производные гликолей.
Например, при взаимодействии со спиртом
получаются
ликоли
дают все реакции, характерные для
одноатомных спиртов, с той лишь разницей,
что реакция может затрагивать либо
одну, либо две гидроксильные группы,
давая два ряда производных: моно - и
дизамещенные производные гликолей.
Например, при взаимодействии со спиртом
получаются
монометиловый эфир диметиловый эфир этиленгликоля этиленгликоля
(метилцеллозольв) (моноглим)
Эти и этиловые эфиры широко используются как растворители.
Весьма специфической реакцией на гликоли является реакция окисления иодной кислотой. В этом случае происходит разрыв углерод-углеродной связи с образованием по месту разрыва карбонильной группы:

Это реакция аналитическая и играет большую роль в определении структур сахаров.
