
- •2.1.Углеводороды.
- •2.1.1.Алканы.
- •2.1.2.Циклоалканы.
- •Номенклатура
- •2.1.3.Алкены
- •2.1.4.Алкины
- •2.1.5.Алкадиены
- •2.1.6.Арены
- •2.2.Гидроксисоединения.
- •2.2.1.Одноатомные спирты.
- •2.2.2.Фенолы.
- •2.2.3.Простые эфиры.
- •Приведенное выше расщепление диметилового эфира представляет собой sn2 реакцию. Однако другие простые эфиры могут расщепляться и по механизму sn1. I
- •2.2.6.Двухатомные фенолы.
- •2.3.Оксосоединения.
- •Номенклатура карбонильных соединений.
- •2.4.Карбоновые кислоты
- •2.4.1.Особенности дикарбоновых кислот.
- •2.5.Функциональные производные карбоновых кислот.
- •2.6.Амины.
2.1.6.Арены
Существуют вещества, молекулы которых при формальной ненасыщенности не дают характерных для непредельных соединений реакций (не обесцвечивают ни бромную воду, ни раствор перманганата калия), а ведут себя скорее как предельные соединения. Их характерными особенностями являются устойчивость к действию окислителей, температуры, легкость вступления в реакции замещения. Первые соединения, известные химикам, с такими свойствами имели приятный запах, поэтому их стали называть ароматическими. В настоящее время термином “ароматичность” обозначают указанные выше особенности химических свойств, а не запах соединений. Ароматические углеводороды нельзя описать одной общей формулой, например:
бензол С6Н6 нафталин С10Н8 дифенил С12Н10
Важнейшим представителем ароматических углеводородов является бензол, С6Н6 Молекула бензола состоит из шести атомов углерода и шести атомов водорода, образующих шестичленный цикл. Молекулу бензола принято изображать следующей формулой:
![]()
Н о
эта формула не полностью отражает
строение бензола. Так, при таком
изображении для бензола дизамещенные
изомеры должны быть разными веществами:
о
эта формула не полностью отражает
строение бензола. Так, при таком
изображении для бензола дизамещенные
изомеры должны быть разными веществами:
Однако хорошо известно, что такие изомеры не существуют и обе формулы отражают строение одного и того же соединения. Еще Кекуле, чтобы разрешить это противоречие, предположил, что реальная молекула представляет собой нечто среднее между следующими структурами:
П![]() о
современным представлениям молекула
бензола представляет собой правильный
плоский шестиугольник. Все атомы углерода
находятся в состоянии sp2-гибридизации.
Углы между
- связями равны 1200.
Облака шести р - орбиталей (по одной у
каждого атома углерода) направлены
перпендикулярно плоскости кольца.
Каждая из шести этих орбиталей
перекрывается по
- типу одновременно с двумя соседними,
в результате чего образуется единая
замкнутая
- система. Такая полная симметричность
бензольного кольца, обусловленная
сопряжением, придает ему особую
устойчивость. Энергия молекулы бензола
примерно на 150 кДж/моль меньше, чем можно
было ожидать для отдельной молекулы
Кекуле. Это означает, что ароматическая
система обладает повышенной устойчивостью.
В 1931 году Хюккель на основании квантово
- механических расчетов сформулировал
правило, согласно которому соединение
должно проявлять ароматические свойства,
если в молекуле содержится плоское
кольцо, содержащее непрерывную сопряженную
систему, с (4n+2)
электронами, где n может принимать
значения 0,1,2,3 и т.д. Согласно этому
правилу, молекулы с 2,6,10,14 и т.д. обобщенными
- электронами являются ароматическими.
Исходя из этих представлений, наиболее
удовлетворительным является изображение
молекулы бензола (n=1)
в виде круга, вписанного в шестиугольник.
Однако структуры Кекуле широко
используются, поскольку они удобны для
написания механизмов реакций, хотя
нужно помнить, что это лишь символ, а не
точное представление структуры. Условию
ароматичности удовлетворяют также
нафталин (n=2),
антрацен, фенантрен (n
=3) и др.
о
современным представлениям молекула
бензола представляет собой правильный
плоский шестиугольник. Все атомы углерода
находятся в состоянии sp2-гибридизации.
Углы между
- связями равны 1200.
Облака шести р - орбиталей (по одной у
каждого атома углерода) направлены
перпендикулярно плоскости кольца.
Каждая из шести этих орбиталей
перекрывается по
- типу одновременно с двумя соседними,
в результате чего образуется единая
замкнутая
- система. Такая полная симметричность
бензольного кольца, обусловленная
сопряжением, придает ему особую
устойчивость. Энергия молекулы бензола
примерно на 150 кДж/моль меньше, чем можно
было ожидать для отдельной молекулы
Кекуле. Это означает, что ароматическая
система обладает повышенной устойчивостью.
В 1931 году Хюккель на основании квантово
- механических расчетов сформулировал
правило, согласно которому соединение
должно проявлять ароматические свойства,
если в молекуле содержится плоское
кольцо, содержащее непрерывную сопряженную
систему, с (4n+2)
электронами, где n может принимать
значения 0,1,2,3 и т.д. Согласно этому
правилу, молекулы с 2,6,10,14 и т.д. обобщенными
- электронами являются ароматическими.
Исходя из этих представлений, наиболее
удовлетворительным является изображение
молекулы бензола (n=1)
в виде круга, вписанного в шестиугольник.
Однако структуры Кекуле широко
используются, поскольку они удобны для
написания механизмов реакций, хотя
нужно помнить, что это лишь символ, а не
точное представление структуры. Условию
ароматичности удовлетворяют также
нафталин (n=2),
антрацен, фенантрен (n
=3) и др.
 бензол
нафталин антрацен фенантрен
бензол
нафталин антрацен фенантрен
Эти соединения, как и бензол, проявляют ароматические свойства: они легко вступают в реакции замещения, устойчивы к действию окислителей и для них нехарактерны реакции присоединения. Ароматичностью обладают гетероциклические соединения, содержащие в цикле атом, отличный от атома углерода. В природных соединениях таким гетероатомом обычно является азот, кислород или сера. Примером ароматических систем ( n =2) с одним гетероатомом являются тиофен (1) пиррол, (2) фуран, (3) пиридин. (4)
А роматическим
характером обладают системы, содержащие
несколько гетероатомов. К ним относятся,
например, пиримидин(5), имидазол (6), пурин
(7) и многие другие.
роматическим
характером обладают системы, содержащие
несколько гетероатомов. К ним относятся,
например, пиримидин(5), имидазол (6), пурин
(7) и многие другие.
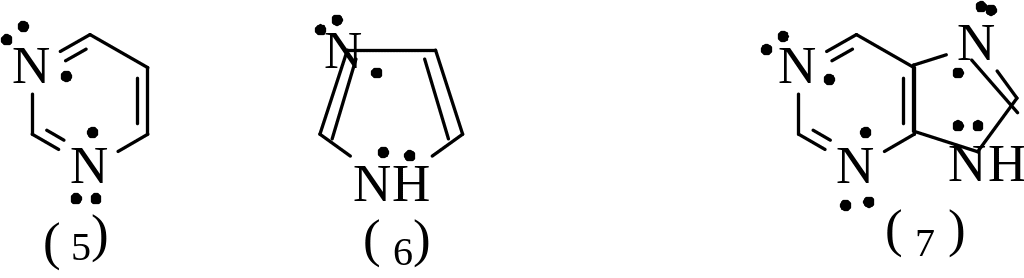
Гетероциклические ароматические системы обладают высокой термодинамической устойчивостью. Неудивительно, они имеют широкое распространение в биологических соединениях – порфине, структура которого входит в состав гемина крови, витамина В12, хлорофилла. Пиримидиновые и пуриновые основания являются структурными единицами важнейших биологических полимеров –нуклеиновых кислот
Номенклатура и изомерия углеводородов ряда бензола.
Общая формула гомологического ряда бензола СnH2n-6. Первый гомолог бензола, толуол или метилбензол, как и все другие однозамещенные бензолы, не имеет изомеров. Для дизамещенных бензолов возможны три типа изомеров: орто -, мета- и пара- дизамещенные бензолы, или 1,2-,1.3-и 1,4-дизамещенные бензолы, соответственно:
 орто-(1,2)
мета- (1,3) пара-(1,4) изомеры
орто-(1,2)
мета- (1,3) пара-(1,4) изомеры
Радикал бензола С6Н 5_называется фенил. Общее название всех ароматических радикалов арилы, аналогично названию алкилы для названия радикалов алканов. Радикал С6Н5-СН2- называется бензилом. Примеры названия дизамещенных бензолов:
2 -гидроксибензой-
1,3-диметил- 4-метиламино-
-гидроксибензой-
1,3-диметил- 4-метиламино-
ная кислота бензол бензол
Химические свойства аренов.
Для бензола и его производных характерными реакциями являются следующие: нитрования(1), галогенирования(2), сульфирования(3), алкилирования(4), ацилирования(5):

Все приведенные выше реакции протекают по механизму реакции электрофильного замещения (SE):
![]() субстрат электрофил
продукт электрофил
субстрат электрофил
продукт электрофил
реакции
Механизм реакции электрофильного замещения
(SE ).
Механизм реакции включает ряд стадий.
Первая стадия включает образование электрофильной частицы (Е +), которая образуется при взаимодействии реагента ЕУ с катализатором:
![]() поляризация
разрыв
поляризация
разрыв
связи связи
Вторая стадия заключается в образовании так называемого - комплекса, в котором электрофил связан со всей - электронной системой бензола:
 π - комплекс
π - комплекс
Следующей стадией реакции является образование - комплекса (медленная стадия реакции), в котором электрофил присоединяется к одному из атомов бензольного ядра
 -
комплекс
-
комплекс
В - комплексе ароматичность нарушена, поскольку один из атомов углерода находится в sp3 - гибридном состоянии. Последняя стадия (быстрая) - отщепление протона от - комплекса, при этом ароматическая система восстанавливается, а протон связывается нуклеофильной частью реагента.
 σ- комплекс
продукт реакции
σ- комплекс
продукт реакции
Теперь настала очередь рассмотреть более подробно механизм образования электрофила в реакции SE
Механизм образования электрофила в реакциях SE.
1. Галогенирование. Галогенирование осуществляется только при наличии катализаторов- кислот Льюиса. В качестве электрофила выступает катион галогена, образовавшийся в результате диссоциации комплекса с кислотой Льюиса:
![]()
2. Нитрование. Азотная кислота ведет себя как основание по отношению к более сильной серной кислоте. Она протонируется и образует новую кислоту, которая в свою очередь диссоциирует с образованием новой кислотно-основной пары: воды и катиона нитроила (нитроний катиона) NO2+:

3![]() .
Сульфирование. Сульфирование проводится
олеумом, раствором триоксида серы (SO3
) в серной кислоте. Предполагается, что
сульфирующим агентом является SO3
или ион HSO3+:
.
Сульфирование. Сульфирование проводится
олеумом, раствором триоксида серы (SO3
) в серной кислоте. Предполагается, что
сульфирующим агентом является SO3
или ион HSO3+:
4. Алкилирование и ацилирование. Эти реакции протекают с участием комплекса галогенпроизводного или ацилгалогенида с кислотой Льюиса, чаще всего с AlCl3:

Ориентирующее действие заместителей в бензольном кольце.
При реакции замещения в бензоле может получиться лишь один продукт реакции. При проведении реакции замещения с монозамещенными производными бензола возможно образование трех изомеров- : продуктов орто-, мета- и пара-замещения. Соотношение продуктов замещения, а также реакционная способность замещенного бензола по сравнению с незамещенным бензолом определяется в первую очередь природой имеющегося заместителя. На основании большого экспериментального материала сформулированы простые, но важные эмпирические правила, позволяющие предсказать продукты реакции. По влиянию на реакции электрофильного замещения заместители, уже имеющиеся в бензольном ядре, делятся на две группы.
1.Заместители (ориентанты) 1 рода, или орто -, пара - ориентанты. К ним относятся заместители, имеющие положительный индуктивный эффект (алкильные заместители) и имеющие положительный мезомерный эффект (группы - ОН, - NH2, - OR, NHR,- SH,- NHCOR). Это электронодонорные заместители.
Заместители 1 рода ускоряют реакцию электрофильного замещения по сравнению с незамещенным бензолом и направляют новый заместитель преимущественно в о- и п- положения:
продукт о - замещения

продукт п - замещения
Х – ориентант 1 рода.
 Так,
фенол, имеющий OH –группу (ориентант 1
рода), легко бромируется в отсутствие
катализаторов при комнатной температуре
водным раствором брома («бромная вода»)
с образованием 2,4,6-трибромфенола. Эта
реакция является качественной реакцией
на фенол.
Так,
фенол, имеющий OH –группу (ориентант 1
рода), легко бромируется в отсутствие
катализаторов при комнатной температуре
водным раствором брома («бромная вода»)
с образованием 2,4,6-трибромфенола. Эта
реакция является качественной реакцией
на фенол.
2,4,6- трибромфенол
Заместители 2 рода это мета-ориентанты. К ним относятся группы с отрицательным индуктивным эффектом (-NH3+, - NR3+) или с отрицательным мезомерным и индуктивным эффектами (- NO2,-SO3H, -CN, -CHO, -COOH, -COOR), это электроноакцепторные заместители. Заместители 2 рода затрудняют реакцию электрофильного замещения по сравнению с бензолом и направляют новый заместитель в мета-положение:
 продукт
мета-замещения
продукт
мета-замещения
Х-ориентант 2 рода
Бензойная кислота нитруется в жестких условиях при нагревании с нитрующей смесью , при этом образуется продукт мета-замещения - 3-нитробензойная кислота.

бензойная 3-нитробензойная кислота
кислота (мета-нитробензойная)
Р ассмотрим
эти эмпирические правила с учетом
электронных эффектов заместителей.
Первый пример с заместителем 2
рода-нитробензол. В этом случае
нитро-группа обладает отрицательным
индуктивным и мезомерными эффектами.
В силу - I эффекта атом углерода,
непостредственно связанный с нитро-группой,
имеет пониженную электронную плотность
за счет поляризации связи N-O. Это приводит
к сдвигу -
электронов связи атома углерода ядра
с этим заместителем по направлению от
кольца, и такое индуктивное влияние
(-I) вызывает общее обеднение ядра
электронами и появление некоторого
положительного заряда у всех атомов
углерода бензольного ядра. Однако на
-I эффект накладывается - М эффект
нитро-группы, который проявляется таким
образом,что его влияние проявляется в
орто- и пара-положениях, следствием чего
является еще большее обеднение электронами
в этих положениях. Так как реакция
происходит с электрофильной частицей,
то она будет атаковывать места с
наибольшей электронной плотностью,
приводя к образованию мета-изомера.
ассмотрим
эти эмпирические правила с учетом
электронных эффектов заместителей.
Первый пример с заместителем 2
рода-нитробензол. В этом случае
нитро-группа обладает отрицательным
индуктивным и мезомерными эффектами.
В силу - I эффекта атом углерода,
непостредственно связанный с нитро-группой,
имеет пониженную электронную плотность
за счет поляризации связи N-O. Это приводит
к сдвигу -
электронов связи атома углерода ядра
с этим заместителем по направлению от
кольца, и такое индуктивное влияние
(-I) вызывает общее обеднение ядра
электронами и появление некоторого
положительного заряда у всех атомов
углерода бензольного ядра. Однако на
-I эффект накладывается - М эффект
нитро-группы, который проявляется таким
образом,что его влияние проявляется в
орто- и пара-положениях, следствием чего
является еще большее обеднение электронами
в этих положениях. Так как реакция
происходит с электрофильной частицей,
то она будет атаковывать места с
наибольшей электронной плотностью,
приводя к образованию мета-изомера.
Иная картина распределения электронной плотности наблюдается при наличии ориентанта 1 рода.
В толуоле метильная группа в силу
положительного индуктивного эффекта
увеличивает электронную плотность в
бензольном ядре, а вследствие +М эффекта
электронная плотность наиболее повышена
в орто - и пара - положениях.
толуоле метильная группа в силу
положительного индуктивного эффекта
увеличивает электронную плотность в
бензольном ядре, а вследствие +М эффекта
электронная плотность наиболее повышена
в орто - и пара - положениях.
Особо необходимо рассмотреть случай, когда заместителем является атом галогена (например, хлор). Как известно, хлор обладает отрицательным индуктивным эффектом и вызывает общее обеднение электронами бензольного ядра. Однако за счет +М эффекта этот невыгодный положительный заряд несколько понижается в орто- и пара- положениях. Поэтому замещение в первую очередь идет в о- и п-положения по отношению к атому галогена, но значительно труднее, чем в незамещенном бензоле.
Р
 еакция
боковой цепи алкилбензолов.
еакция
боковой цепи алкилбензолов.
Кроме реакций электрофильного замещения алкилбензолы можно окислять, при этом бензольное ядро сохраняется, а боковая цепь окисляется до карбоновой
к ислоты:
толуол бензойная кислота
ислоты:
толуол бензойная кислота
Подобное окисление широко распространено в биологических системах. Толуол гораздо менее токсичен, чем бензол, из-за легкости окисления его до бензойной кислоты.
А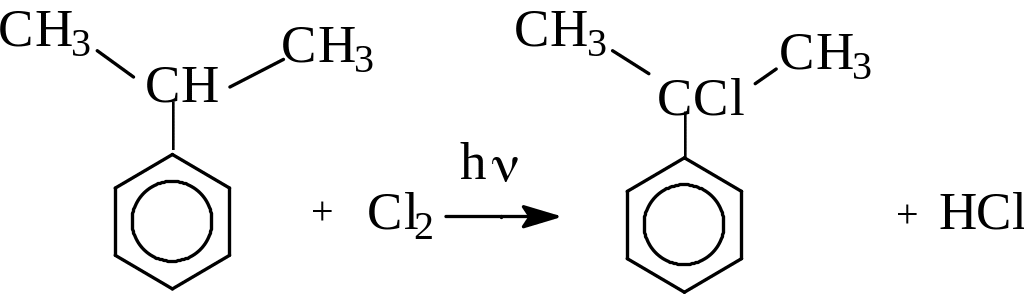 лкилбензолы
вступают также в реакции свободнорадикального
хлорирования по боковой цепи:
лкилбензолы
вступают также в реакции свободнорадикального
хлорирования по боковой цепи:
