
- •2.1.Углеводороды.
- •2.1.1.Алканы.
- •2.1.2.Циклоалканы.
- •Номенклатура
- •2.1.3.Алкены
- •2.1.4.Алкины
- •2.1.5.Алкадиены
- •2.1.6.Арены
- •2.2.Гидроксисоединения.
- •2.2.1.Одноатомные спирты.
- •2.2.2.Фенолы.
- •2.2.3.Простые эфиры.
- •Приведенное выше расщепление диметилового эфира представляет собой sn2 реакцию. Однако другие простые эфиры могут расщепляться и по механизму sn1. I
- •2.2.6.Двухатомные фенолы.
- •2.3.Оксосоединения.
- •Номенклатура карбонильных соединений.
- •2.4.Карбоновые кислоты
- •2.4.1.Особенности дикарбоновых кислот.
- •2.5.Функциональные производные карбоновых кислот.
- •2.6.Амины.
2.1.2.Циклоалканы.
Углеводороды, в которых углеродные цепи образуют циклы, относятся к классу алициклических (т.е. алифатических, циклических углеводородов). Циклоалканы - это предельные углеводороды. Их состав выражается формулой CnH2n, но их углеродные атомы связаны лишь простыми σ- связями.
Номенклатура
По номенклатуре ИЮПАК их называют циклоалканами. Название углеводорода строится из прибавления префикса цикло- к названию соответствующего ациклического неразветвленного углеводорода с тем же числом углеродных атомов. Например:
![]()
циклопропан циклобутан циклопентан циклогексан
Для замещенных циклоалканов заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров заместителей была минимальной:
1 -метил-3-изопропилциклопентан
-метил-3-изопропилциклопентан
( а не 1-метил-4-изопропилциклопентан)
Изомерия. В ряду алициклов возможны следующие типы изомерии.1) Структурная изомерия, обусловленная различием в размере цикла. Например:

циклобутан метилциклопропан
2) Изомерия, обусловленная различным положением заместителей в цикле:
В связи с тем, что
в циклах свободное вращение вокруг
простых С-С связей невозможно, при
наличии и цикле заместителей у разных
атомов углерода возможна цис – транс
- из омерия
омерия
.
 цис(Z) - 1,2- дихлор- транс(E)-1,2-дихлор-
цис(Z) - 1,2- дихлор- транс(E)-1,2-дихлор-
циклопропан циклопропан
Конформация циклов. В то время, как молекулы с открытой цепью очень гибки, циклические молекулы не обладают такой гибкостью и преимущественно существуют в определенной форме, конформации (см.раздел “Конформация циклов”).
Циклопропан и циклобутан относят к малым циклам, а к обычным циклам - пяти- ,шести- и семичленные циклы.
За исключением циклопропана и, в меньшей степени, циклобутана, все остальные циклоалканы по реакционной способности не отличаются от обычных алканов.
Особенности химического поведения “малых циклов”.
Циклопропан занимает в этом ряду особое место. По современным представлениям, σ- связи в циклопропане отличаются от обычных σ- связей, и гибридизация атомов углерода отлична от sp3-гибридизации. Это объясняется тем, что максимумы перекрывания электронных облаков вследствие взаимного отталкивания располагаются не на прямых, соединяющих атомы углерода. За счет этого напряжение уменьшается ( угол между связями, который должен быть 600 увеличивается до 1060), но связи приобретают частично ненасыщенный характер, “банановые связи”, так как в этом случае максимальная электронная плотность расположена вне линии связи между атомами, так же, как у π-связи в алкенах. Так циклопропан легко гидрируется, присоединяет галоген и галогеноводороды, в результате чего образуются продукты присоединения с размыканием цикла:

2.1.3.Алкены
Углеводороды, содержащие двойную связь, являются гомологами простейшего алкена, этилена, и по первому члену этого ряда называются этиленовыми углеводородами. Общая формула этого ряда СnH2n.
В соответствии с правилами ИЮПАК алкен получает название алкана, в котором окончание - ан меняется на суффикс -ен, при этом цепь нумеруется таким образом, чтобы атомы углерода, образующие двойную связь, получали наименьший номер:
Н3С-СН2-СН=СН2 бутен - 1
В случае разветвленных алкенов радикалы называются и нумеруются как и в случае алканов. Для некоторых простейших алкенов широко используются тривиальные названия, как уже упомянутый этилен, давший названию всего ряда алкенов, пропилен, бутилены.
CH2=CH2 этилен CH3-CH=CH2 пропилен
Широко используются тривиальные названия и простейших алкенильных радикалов, например :
CH2=CH- винил CH2=CH- CH2- аллил.
Для алкенов помимо изомерии углеродного скелета появляется еще и изомерия, связанная с положением двойной связи. Так, для алкена C4H8 возможны три изомера:
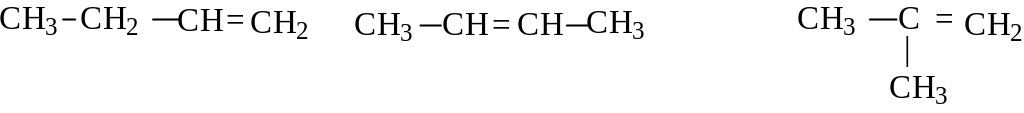 бутен-1
бутен-2 2-метилпропен-2
бутен-1
бутен-2 2-метилпропен-2
Д ля
алкенов характерна цис,- транс- изомерия.
Вследствие затрудненного вращения
вокруг двойной связи алкены, содержащие
разные заместители при двойной связи,
могут существовать в виде двух изомеров,
отличающихся друг от друга только
различным расположением заместителей
при двойной связи, например:
ля
алкенов характерна цис,- транс- изомерия.
Вследствие затрудненного вращения
вокруг двойной связи алкены, содержащие
разные заместители при двойной связи,
могут существовать в виде двух изомеров,
отличающихся друг от друга только
различным расположением заместителей
при двойной связи, например:
транс -бутен-2 цис -бутен-2
Физические свойства алкенов близки к свойствам соответствующих алканов. Обычно алкены имеют более низкие температуры кипения и плавления по сравнению с алканами. Алкены не растворимы в воде, но они хорошо растворимы в органических растворителях.
Химические свойства алкенов.
Химические свойства алкенов определяются наличием в их молекулах двойной связи, -связи. Для разрыва этой связи требуется значительно меньше энергии, чем для разрыва - связи. Так, энергия разрыва С-С связи равна 339 кДж /моль, энергия разрыва С = С связи равна 611кДж/моль, то энергия разрыва -связи составляет 272 кДж/моль. Более того, - электроны значительно легче поляризуются, чем σ-электроны. Высокая электронная плотность двойной связи, легкая поляризуемость и небольшая энергия диссоциации объясняет то, что для алкенов наиболее характерными реакциями являются реакции присоединения, при этом из-за высокой нуклеофильности алкенов для них наиболее характерны реакции электрофильного присоединения (AE). Следовательно, алкены являются значительно более реакционноспособными соединениями по сравнению с алканами и, используя реакции присоединения, из алкенов можно получать большое разнообразие органических соединений. Так, наиболее характерными реакциями алкенов являются следующие:
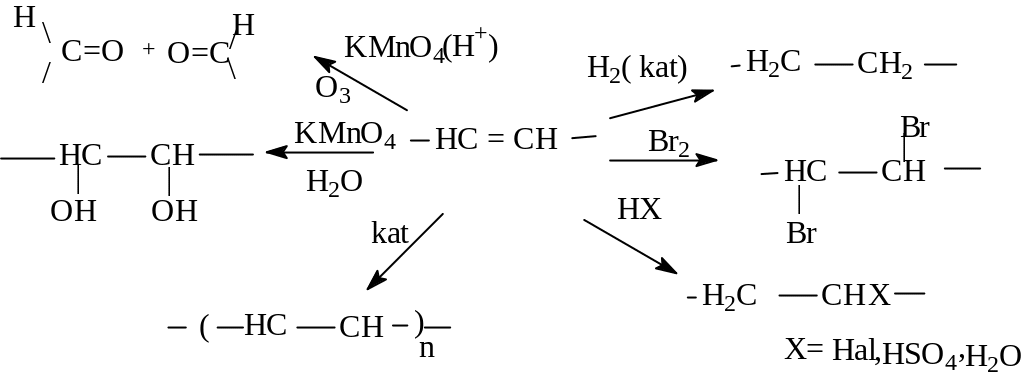
Рассмотрим механизм некоторых реакций. Алкены присоединяют галогены с образованием 1,2-дигалогеналканов. Обесцвечивание бромной воды является качественной реакцией на двойную связь. Установлен механизм этой реакции как реакции электрофильного присоединения по двойной связи(AE). Общая схема реакции:
О днако
это только суммарный итог реакции.
Реакция проходит ступенчато, через
несколько стадий:
днако
это только суммарный итог реакции.
Реакция проходит ступенчато, через
несколько стадий:
1.Образование - комплекса.
При приближении галогена к π- связи молекула галогена поляризуется и своим положительным концом атакует алкен, вытягивая на себя подвижные π-электроны двойной связи, образуя неустойчивый - комплекс:
π -
комплекс
-
комплекс
2.Образование галогенониевого иона.
Неустойчивый - комплекс превращается в “ониевый” ион вследствие того, что электрофил присоединился одновременно к двум атомам углерода с образованием циклического интермедиата:
π -
комплекс циклический ион бромония
-
комплекс циклический ион бромония
3. Нуклеофильная атака галогенониевого иона.
Нуклеофил атакует галогенониевый ион со стороны, противоположной к уже имеющемуся в нем атому галогена, в результате образуется продукт реакции транс - присоединения:
П ри
бромировании циклогексена образуется
транс-1,2-дибромциклогексан:
ри
бромировании циклогексена образуется
транс-1,2-дибромциклогексан:
Э тот
результат подтверждает транс-присоединение
и служит доказательством того, что
реакция протекает в несколько стадий.
тот
результат подтверждает транс-присоединение
и служит доказательством того, что
реакция протекает в несколько стадий.
Реакция присоединения кислот (H2SO4, HHal), воды в кислой среде протекает по другому механизму. В этом случае реагент НХ (Х=НSO4-, Hal-, H2O) диссоциирует на ионы.
Механизм этих реакций включает атаку протоном (H+) электронов π-связи алкена с образованием σ-связи с атомом углерода, в результате чего положительный заряд переходит на соседний атом углерода. Ионы, в которых положительный заряд находится на атоме углерода, называются карбкатионами. Такие ионы являются химически очень активными, так как для углерода нехарактерно заряженное состояние. Они тут же реагируют с анионом кислоты, давая конечный продукт присоединения.
Схема реакции электрофильного присоединения (AE) кислоты к алкену:
 Алкен
карбкатион продукт реакции
Алкен
карбкатион продукт реакции
В случае несимметричных алкенов эта реакция приводит к получению одного из двух возможных изомеров, т.е. является региоселективной. Региоселективными называются реакции, приводящие к получению одного из нескольких возможных изомерных продуктов.
В случае, если к несимметричному алкену присоединяется несимметричная молекула, то возможно образование двух продуктов, но получается, как правило, один. Реакция может осуществляться по двум направлениям:
Ф актором,
определяющим направление присоединения,
является устойчивость того или иного
промежуточного карбкатиона, в стабилизации
которого участвуют алкильные или
арильные заместители, соединенные с
атомом углерода, несущим положительный
заряд. Чем устойчивее катион, тем ниже
его энергия и, следовательно, тем легче
он образуется. Относительная устойчивость
карбкатионов следующая:
актором,
определяющим направление присоединения,
является устойчивость того или иного
промежуточного карбкатиона, в стабилизации
которого участвуют алкильные или
арильные заместители, соединенные с
атомом углерода, несущим положительный
заряд. Чем устойчивее катион, тем ниже
его энергия и, следовательно, тем легче
он образуется. Относительная устойчивость
карбкатионов следующая:

R= алкил, арил
При электрофильном присоединении к алкену образуется тот продукт, который получается из более стабильного карбкатиона, например, как в приведенной выше схеме, RCHX-CH3. Это наблюдение было обобщено эмпирически открытым Марковниковым правилом: присоединение галогеноводородов, воды в присутствии сильных минеральных кислот к алкенам происходит так, что атом водорода присоединяется к тому атому углерода, с которым уже связано большее число атомов водорода, т.е. к наиболее гидрогенизированному.
В настоящее время в связи с учетом электронных факторов заместителей в молекуле алкена направление присоединения реагентов типа HX определяется относительной устойчивостью промежуточно образующихся карбкатионов. Так, при действии на алкен, содержащий электроноакцепторную группу, галогеноводородной кислоты присоединение последней идет против правила Марковникова:
Например:
![]()
Если подвести итог рассмотренных реакций, то можно сказать, что реакция электрофильного присоединения протекает тем легче, чем сильнее электрофильный агент. Например, в ряду галогеноводородных кислот чем сильнее кислота, тем сильнее электрофил:
HI > HBr > HCI
Строение алкена также оказывает влияние на скорость реакции электрофильного присоединения: чем выше электронная плотность на двойной связи, тем выше скорость присоединения. Заместители, обладающие электронодонорными свойствами, способствуют ускорению реакции, например:

Полимеризация алкенов.
Алкены могут быть полимеризованы до соединений с высокой молекулярной массой нагреванием их в присутствии свободнорадикальных катализаторов. Такая полимеризация происходит по радикальному механизму. В качестве инициатора для проведения радикальной полимеризации используют пероксидные соединения или другие вещества, способные служить источниками свободных радикалов.
и т.д.
т.д.
Полимеризация – это цепная реакция, важная для получения политена (полиэтилена), полипропена (полипропилена), полистирола. Полимеризацию алкенов можно проводить с такими катализаторами, как кислоты, основания или металлоорганические соединения. Так, полимеризация этена и пропена в настоящее время проводится с использованием катализатора Натта-Циглера, состоящего из (C2H5)3Al и TiCI4 .При использования такого катализатора можно получать полимеры с очень регулярной структурой, так называемые изотактические полимеры, в то время как при свободнорадикальной полимеризации получаются полимеры с беспорядочно ориентированными группами, например:
С труктура
труктура
изотактического и атактического
полипропилена
