
- •Глава 4. Количественный химический анализ Титриметрический анализ
- •4.1. Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
- •4.2. Кривая титрования. Подбор индикаторов
- •4.2.1. Кривая титрования и ее области
- •4.2.2 Индикаторы и их подбор
- •4.2.3. Теории, объясняющие изменение окраски индикаторов.
- •4.2.4 Определение интервала перехода для отдельных групп
- •4.2.5 Индикаторные ошибки в кислотно-основном методе титрования.
- •4.3. Методы и способы титрования. Титр, титр по определяемому веществу
- •4.3.1 Способы титрования.
- •4.3.2 Титр раствора и титр по определяемому веществу.
- •4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
- •4.5. Кислотно-основное титрование (протолитометрия). Особенности кривой титрования
- •4.6. Факторы, влияющие на ход кривой титрования, величину скачка и положение точки эквивалентности в протолитометрии
- •4.7. Буферные растворы, классификация буферов и их применение в анализе
- •4.7.1 Классификация буферных систем.
- •4.7.2 Роль буферных растворов в аналитике
- •4.8. Расчет кислотно-основных (протолитических)
- •4.8.1. Растворы гидролизующихся солей.
- •4.8.2. Растворы сильных кислот и оснований.
- •4.8.3. Растворы слабых кислот и оснований.
- •4.8.4 Расчет концентрации протонов в кислотных и основных буферах
- •4.8.5 Определение кислотности среды при смешении растворов.
- •4.8.5.1 Смешение растворов, компоненты в которых не взаимодействуют
- •4.8.5.2 Смешение растворов, компоненты которых взаимодействуют
- •4.8.6 Многоосновные кислоты и многокислотные основания.
- •4.9. Особенности хода кривых титрования различных систем. Условия титрования многокомпонентных систем, многоосновных кислот и их солей
- •4.9.1 Кривая титрования системы сильное – сильное
- •4.9.2 Кривые титрования системы слабое – сильное
- •А) Кривая титрования слабой одноосновной кислоты сильным основанием
- •3. Область скачка, содержащая т.Э.
- •4.9.3 Титрование многоосновных (полипротонных) кислот и оснований
- •4.9.3 Кривые титрования смеси 2-х веществ
- •4.10. Окислительно-восстановительное титрование (редоксиметрия), Кривая титрования и ее особенности.
- •4.11. Расчет кривой титрования с учетом и без учета кислотности
- •4.11.1 Расчет молярной массы эквивалента в редоксиметрии.
- •4.12. Расчет потенциала в точке эквивалентности и значения константы равновесия
- •4.13. Основные виды редоксиметрии и их применение
- •4.13.1. Перманганатометрия
- •4.13.2. Иодометрия
- •4.14. Комплексометрический анализ
- •4.15. Виды комплексов. Понятие дентатности и координационного числа
- •4.16. Комплексоны, используемые для титрования. Применение комплексонометрии
- •4.17. Метод седиментации (осадительное титрование). Кривая титрования, особенности определения точки эквивалентности. Методы Фольгарда и Мора
- •4.17.2 Безиндикаторные способы определения точки эквивалентности.
- •4.17.3. Меркурометрия
4.3.2 Титр раствора и титр по определяемому веществу.
Концентрацию
растворов, применяемых в титриметрии,
выражают не только через моль-экв/л
(нормальность), но и через титр раствора
(![]() )
и титр по определяемому веществу
(
)
и титр по определяемому веществу
(![]() ).
Эти концентрации более удобны, так как
непосредственно позволяют вычислять
массу определяемого компонента по
результатам титрования. Формулы,
приведенные в стандартных методиках
титриметрического анализа, предназначенных
для большого числа однотипных измерений,
содержат значение титра по определяемому
веществу
).
Эти концентрации более удобны, так как
непосредственно позволяют вычислять
массу определяемого компонента по
результатам титрования. Формулы,
приведенные в стандартных методиках
титриметрического анализа, предназначенных
для большого числа однотипных измерений,
содержат значение титра по определяемому
веществу
![]() .
.
Титр вещества
![]() или простой
или простой
Титр вещества показывает содержание компонента А, выраженное в граммах, в 1 мл его раствора и вычисляется по формуле:
![]() =
=
![]() (4.8)
(4.8)
где
![]() – масса вещества А (г) в растворе с
объемом
– масса вещества А (г) в растворе с
объемом
![]() (мл),
– его титр в г/мл.
(мл),
– его титр в г/мл.
Иногда титр для удобства в расчетах выражают в мг/мл. Через простой титр легко рассчитать молярную концентрацию (молярность) или молярную концентрацию эквивалента (нормальность) раствора, подставив туда выражение массы вещества через титр.
![]() и
и
![]() (4.9)
(4.9)
Пример. Пусть
в растворе соли, объемом 250 см3
содержится 0,5 г
![]() .
Определить титр и нормальность такого
раствора.
.
Определить титр и нормальность такого
раствора.
Исходя из формул
(4.8) и (4.9), Т(Na2CO3)
= 0,005/250 =
![]() (г/мл),
а нормальность:
(г/мл),
а нормальность:
![]() =
=
![]() 1000/53
=
1000/53
=
![]() (моль-экв/л), где 53 – молярная масса
эквивалента
(г-экв/моль).
(моль-экв/л), где 53 – молярная масса
эквивалента
(г-экв/моль).
Титр по
определяемому веществу
![]() (условный)
(условный)
Титр по определяемому веществу или условный показывает какое количество вещества А (г) эквивалентно массе титранта В, которая содержится в 1 мл раствора титранта В. Так как масса титруемого вещества А и объем раствора В относятся к разным веществам, то размерность такого титра не указывается. Титр по определяемому веществу (условный) позволяет вычислить какое количество вещества А в граммах титруется 1-м миллилитром титранта В.
=
![]() (4.10)
(4.10)
Между титрами Т(В) и существует простая связь, вытекающая из закона эквивалентов. Ее легко получить, учитывая, что
m(В)
=
![]() и m(А) =
и m(А) =![]() ,
,
где V(B) в мл – объем раствора В, пошедший на реакцию (титрование) с веществом А; m(В) – масса вещества реагента В (титранта), m(А) – масса вещества А, эквивалентная массе реагента В в его растворе объемом V(B).
![]() или
или
![]() (4.11)
(4.11)
Тогда молярная концентрация эквивалента (нормальность) раствора В через значение может быть определена как:
![]() (4.12)
(4.12)
Если для рабочего
раствора В известно значение
,
то масса определяемого компонента А
(г) в пробе объемом
![]() легко вычисляется по объему раствора
титранта
легко вычисляется по объему раствора
титранта
![]() ,
израсходованному на титрование аликвоты
:
,
израсходованному на титрование аликвоты
:
![]() (4.13)
(4.13)
4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
В титриметрии используют растворы, концентрация которых установлена каким-либо способом с высокой степенью точности. Такие растворы называют стандартными титрованными или просто титрованными. Растворы классифицируют по назначению и по способу установления их концентрации.
По назначению их условно делят на рабочие растворы и растворы стандартов (первичные и вторичные).
Рабочими называют растворы, которые используются непосредственно в анализе при определении содержания вещества. Если рабочий раствор не относится к стандартным, то его необходимо отстандартизировать непосредственно перед выполнением анализа, так как концентрация в процессе хранения могла существенно измениться. Точную концентрацию рабочего раствора находят путем титрования стандартного раствора или установочных веществ (метод точных навесок). Это касается, например, таких рабочих растворов, как: NaOH, Na2S2O35H2O.
Под стандартным раствором понимают такой титрованный раствор, который устойчиво сохраняет свою концентрацию при длительном хранении. Основное назначение стандартных растворов определение точной концентрации рабочих и иных растворов, применяемых в титровании.
Процесс установления точной концентрации раствора путем его титрования по стандарту называется стандартизацией.
По способу определения концентрации различают первичные стандарты или растворы с приготовленным титром и стандартизированные растворы.
Стандартизированные растворы это такие растворы, концентрация которых устанавливается по стандарту и заранее не может быть точно определена. К ним относятся растворы кислот, щелочей, гидролизующихся и гигроскопичных солей, а также веществ, которые могут реагировать с атмосферным кислородом и углекислотой. Известно множество способов приготовления стандартизированных растворов. Наиболее часто для этой цели применяют: приготовление по приближенной навеске (щелочи, соли), методы разбавления или смешения растворов (кислоты, соли), методы ионного обмена (растворы солей).
Стандартные растворы классифицируют по способу определения их концентрации. Различают: первичные стандарты или растворы с приготовленным титром и вторичные стандарты растворы с установленным титром.
Первичные стандарты это растворы, которые готовят либо по точной навеске вещества (рис. 4.10), либо путем разведения специально приготовленных стандартизированных реагентов – фиксаналов (рис. 4.11). Фиксанал представляет собой стеклянную запаянную ампулу, выпускаемую промышленностью и содержащую строго нормированное количество реагента, обычно рассчитанного на 1 л 0,1 н. раствора.
Приготовление раствора по точной навеске начинают с расчета ее массы по заданной концентрации (титру или нормальности) и объему колбы. Навеску стандартного вещества взвешивают на аналитических весах с точностью до 1104 г и количественно переносят в мерную колбу, где ее растворяют при перемешивании (рис. 4.10).
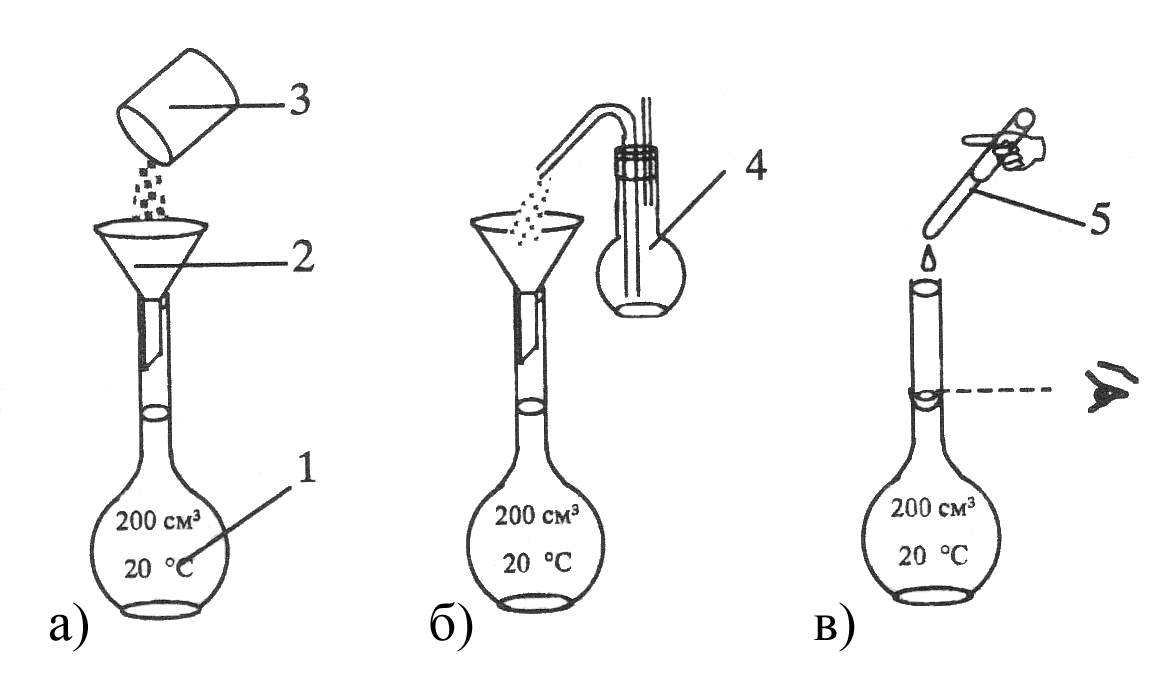
Рисунок 4.10 – Порядок операций при приготовлении раствора первичного
стандарта по точной навеске: 1 – мерная колба Мора; 2 – воронка;
3 – бюкс с навеской вещества; 4 – промывалка с дистиллированной водой;
5 – пипетка или капельница.
а – перенос навески вещества в мерную колбу; б – ополаскивание воронки;
в – доведение объема раствора стандарта до метки.
Этим методом обычно готовят растворы солей, таких как бура (Na2B4O710H2O), K2Cr2O7. Количество вещества в растворе находят или по значению точно взятой массы навески (при ее переносе необходимо тщательно промыть бюкс), или рассчитывают методом разности, определяя точную массу бюкса сначала с навеской, а затем – пустого, уже после переноса вещества в колбу. В случае необходимости концентрацию раствора заново пересчитывают с учетом фактически взятой массы навески.
Порядок приготовления раствора методом разведения из фиксанала показан на рисунке 4.11. Чтобы стандарт, полученный этим методом, был качественным и отвечал всем требованиям, необходимо исключить потери вещества при вскрытии ампулы и переносе его в колбу, а также следить, чтобы осколки ампулы не попали в раствор. Это во многом зависит от правильности обращения с ампулой.
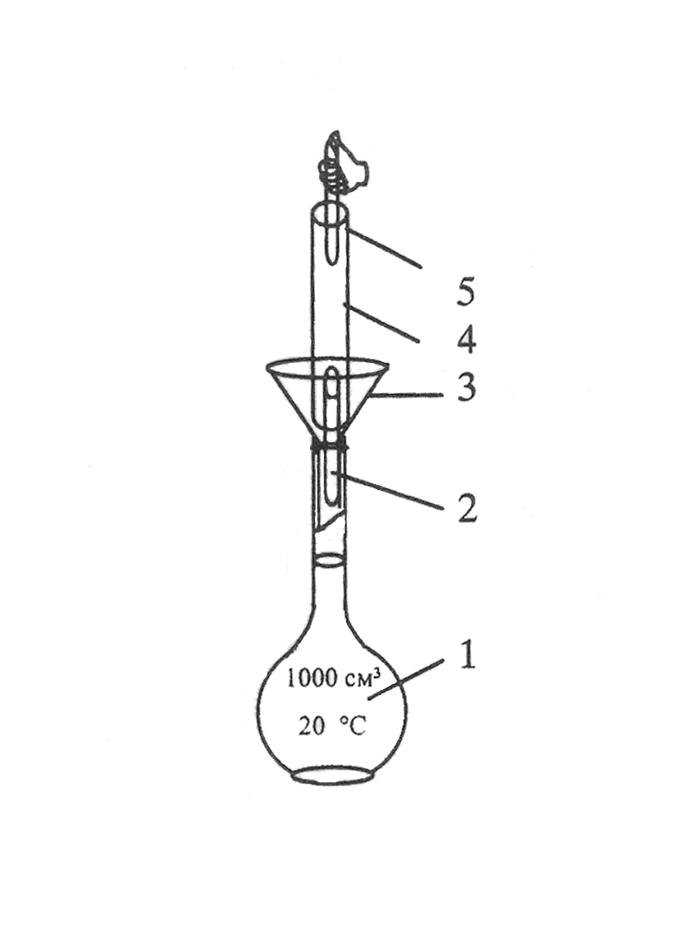
Рисунок 4.11 – Способ приготовления растворов первичного стандарта
методом разведения из фиксанала: 1 – мерная колба Мора на 1л;
2 – нижний боек; 3 – воронка; 4 – ампула фиксанала; 5 – верхний боек.
Перед использованием, ампулу следует ополоснуть дистиллированной водой и только затем ее вскрывать специальным бойком. Сразу же после переноса вещества в колбу, нужно тщательно промыть ампулу дистиллированной водой, не менее, чем 6-ти кратным ее объемом. Этот метод приготовления первичного стандарта проще, чем по точным навескам, но уступает ему в точности. Его используют не только для получения растворов солей, но и различных кислот.
Так как для приготовления раствора первичного стандарта пригодны только точная мерная посуда и аналитические весы, то и к веществам, применяемым для этой цели, предъявляют ряд обязательных требований. В качестве первичного стандарта можно использовать только такие реактивы, которые характеризуются:
высокой чистотой (обычно не хуже, чем 99,99 – 99,999% квалификации ч.д.а. и о.с.ч.);
точным соответствием формульному составу и относительно высокой молекулярной массой;
устойчивостью при хранении как в твердом виде, так и в растворе (отсутствие процессов гидратации, гидролиза, окисления и карбонизации);
простотой в приготовлении и хорошей растворимостью;
необратимостью реакции при стандартизации, селективностью;
возможностью точной фиксации Т. Э. каким-либо методом.
Вторичным стандартом называют такие стандартизированные растворы, которые устойчивы при хранении и могут быть использованы для стандартизации других растворов.
Вторичные стандарты готовят как растворы приблизительной концентрации любым известным методом, а перед употреблением определяют их точную концентрацию путем стандартизации по первичному стандарту. Поэтому при приготовлении вторичных стандартов не требуется высокая точность измерения массы вещества или объема раствора, как в случае первичных стандартов. Для этой цели вполне пригодны технохимические весы и неточная мерная посуда (цилиндры, мензурки, градуированные пробирки).
Примером раствора, обладающего свойствами вторичного стандарта, является соляная кислота. Ее разбавленные растворы могут храниться длительное время, до 1-го месяца и более, без заметного изменения концентрации. Бура, используемая в протолитометрии для стандартизации HCl, относится к первичным стандартам и готовится по точной навеске. Тогда, как рабочий раствор NaOH – свойствами стандарта не обладает вообще и его концентрацию приходится устанавливать заново при каждом использовании.
