
- •Глава 4. Количественный химический анализ Титриметрический анализ
- •4.1. Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
- •4.2. Кривая титрования. Подбор индикаторов
- •4.2.1. Кривая титрования и ее области
- •4.2.2 Индикаторы и их подбор
- •4.2.3. Теории, объясняющие изменение окраски индикаторов.
- •4.2.4 Определение интервала перехода для отдельных групп
- •4.2.5 Индикаторные ошибки в кислотно-основном методе титрования.
- •4.3. Методы и способы титрования. Титр, титр по определяемому веществу
- •4.3.1 Способы титрования.
- •4.3.2 Титр раствора и титр по определяемому веществу.
- •4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
- •4.5. Кислотно-основное титрование (протолитометрия). Особенности кривой титрования
- •4.6. Факторы, влияющие на ход кривой титрования, величину скачка и положение точки эквивалентности в протолитометрии
- •4.7. Буферные растворы, классификация буферов и их применение в анализе
- •4.7.1 Классификация буферных систем.
- •4.7.2 Роль буферных растворов в аналитике
- •4.8. Расчет кислотно-основных (протолитических)
- •4.8.1. Растворы гидролизующихся солей.
- •4.8.2. Растворы сильных кислот и оснований.
- •4.8.3. Растворы слабых кислот и оснований.
- •4.8.4 Расчет концентрации протонов в кислотных и основных буферах
- •4.8.5 Определение кислотности среды при смешении растворов.
- •4.8.5.1 Смешение растворов, компоненты в которых не взаимодействуют
- •4.8.5.2 Смешение растворов, компоненты которых взаимодействуют
- •4.8.6 Многоосновные кислоты и многокислотные основания.
- •4.9. Особенности хода кривых титрования различных систем. Условия титрования многокомпонентных систем, многоосновных кислот и их солей
- •4.9.1 Кривая титрования системы сильное – сильное
- •4.9.2 Кривые титрования системы слабое – сильное
- •А) Кривая титрования слабой одноосновной кислоты сильным основанием
- •3. Область скачка, содержащая т.Э.
- •4.9.3 Титрование многоосновных (полипротонных) кислот и оснований
- •4.9.3 Кривые титрования смеси 2-х веществ
- •4.10. Окислительно-восстановительное титрование (редоксиметрия), Кривая титрования и ее особенности.
- •4.11. Расчет кривой титрования с учетом и без учета кислотности
- •4.11.1 Расчет молярной массы эквивалента в редоксиметрии.
- •4.12. Расчет потенциала в точке эквивалентности и значения константы равновесия
- •4.13. Основные виды редоксиметрии и их применение
- •4.13.1. Перманганатометрия
- •4.13.2. Иодометрия
- •4.14. Комплексометрический анализ
- •4.15. Виды комплексов. Понятие дентатности и координационного числа
- •4.16. Комплексоны, используемые для титрования. Применение комплексонометрии
- •4.17. Метод седиментации (осадительное титрование). Кривая титрования, особенности определения точки эквивалентности. Методы Фольгарда и Мора
- •4.17.2 Безиндикаторные способы определения точки эквивалентности.
- •4.17.3. Меркурометрия
4.17. Метод седиментации (осадительное титрование). Кривая титрования, особенности определения точки эквивалентности. Методы Фольгарда и Мора
Метод седиментации (осадительное титрование) основан на образовании малорастворимых соединений в результате реакции между титрантом и титруемым веществом. Наиболее важными требованиями, которые предъявляются к реакциям осаждения в титриметрическом анализе, являются следующие:
достаточно малая растворимость осадка (ПР 108 1010) и быстрое его образование;
минимальное соосаждение примесей;
наличие индикатора, позволяющего фиксировать конец реакции.
Отсутствие надежных индикаторов сдерживает применение этого метода, поэтому практическое значение имеют аргентометрия, основанная на осаждении анионов нитратом серебра и меркурометрия, где осадителем является раствор нитрата ртути (1).
Аргентометрические методы используют для определения главным образом галогенидов, например хлоридов, по реакции:
Ag+ + С1 = AgCl↓
Основными рабочими растворами в аргентометрии являются: нитрат серебра, хлорид натрия и тиоцианат калия или аммония. Хранят раствор AgNO3 в склянках из темного стекла, так как на свету соли серебра неустойчивы. Точную концентрацию AgNO3 устанавливают по стандартному раствору NaCl, а KSCN (NH4SCN) по титрованному раствору AgNO3. Кривые титрования в аргентометрии обычно строят в координатах pAg – Vт-та, где pAg = logC(Ag+) – показатель концентрации ионов Ag+, Vт-та – объем титранта. Характерные кривые осадительного титрования представлены на рис. 4.26.
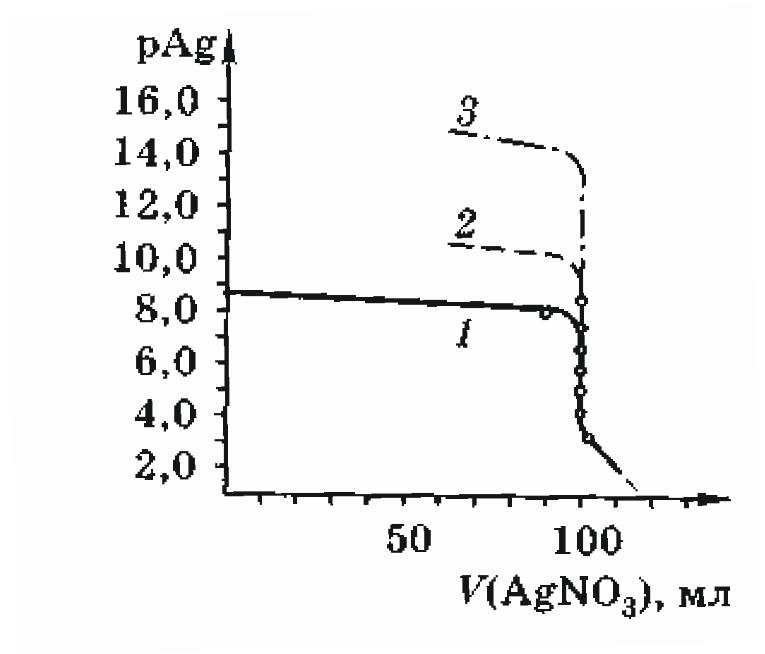
Рисунок 4.26 – Кривые аргентометрического титрования растворов
галогенидов: 1 – NaCl; 2 – NaBr; 3 – NaJ;
значение ПР для: AgCl 1,81010, AgBr 5,31013, AgJ 8,31017
При расчете кривых титрования учитывают тот факт, что выделение осадка начинается, когда справедливо неравенство: [Ag+] [X] ≥ ПР(AgX),
где [Ag+] и [X] – концентрации ионов Ag+ и галогенидиона X в растворе, а ПР(AgX) – произведение растворимости образующегося осадка (табличное значение).
Величина скачка титрования, при прочих равных условиях, определяется значением ПР, что хорошо видно на рисунке 4.26: чем меньше значение ПР, тем выше скачок. Скачок возрастает также с ростом концентрации реагирующих веществ и с понижением температуры среды, что приводит к уменьшению значения ПР. В аргентометрии применяют различные способы, в том числе и специфические, установления точки эквивалентности: как с помощью индикаторов, так и без них.
Индикаторные методы
а) Метод Мора (индикатор – хромат калия).
В основе метода образовании осадка Ag2CrO4 кирпично-красного цвета при определении хлоридов путем прямого титрования рабочим раствором AgNO3 (0,1 M) с индикатором K2CrO4. В конце титрования достаточно всего 1-й капли титранта, чтобы образование Ag2CrO4 привело к хорошо заметному на глаз окрашиванию осадка AgCl. Титрование выполняется в нейтральной или слабощелочной среде при значениях рН = 6,510,5, так как в более кислой области происходит протонирование хромата по реакции СrО42 + Н+ = HCrO4, что значительно снижает чувствительность индикатора. При рН 10,5, оксид или гидроксид серебра могут выпадать в осадок ранее хромата. Иодиды и тиоцианаты методом Мора не определяются, из-за сложности в установлении точки эквивалентности вследствии адсорбции этих ионов и существенном возрастании погрешность анализа.
б) Метод Фольгарда [индикатор – раствор соли железа(III)].
Этот метод основан на реакции взаимодействия раствора нитрата серебра с ионами SCN и используется для определения галогенидов методом обратного титрования. К анализируемому раствору галогенида (хлорида или бромида) добавляют в избытке точный объем вспомогательного раствора AgNO3, не вступившие в реакцию ионы Ag+ оттитровывают рабочим раствором KNCS или NH4NCS. В качестве индикатора используют раствор соли 3-х валентного железа . Появление тиоцианат-ионов можно обнаружить в растворе при концентрации порядка 105 моль/л по появлению оранжевой окраски за счет образования комплексного соединения Fe(SCN)3.
Достоинством метода Фольгарда является возможность проведения анализа галогенидов в кислой среде. Этот метод используют также для определения арсенатов, оксалатов, фосфатов, сульфидов и других анионов, образующих малорастворимые соединения с Ag+. Более сложные методики применяются определение фторидов.
