
- •Глава 4. Количественный химический анализ Титриметрический анализ
- •4.1. Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
- •4.2. Кривая титрования. Подбор индикаторов
- •4.2.1. Кривая титрования и ее области
- •4.2.2 Индикаторы и их подбор
- •4.2.3. Теории, объясняющие изменение окраски индикаторов.
- •4.2.4 Определение интервала перехода для отдельных групп
- •4.2.5 Индикаторные ошибки в кислотно-основном методе титрования.
- •4.3. Методы и способы титрования. Титр, титр по определяемому веществу
- •4.3.1 Способы титрования.
- •4.3.2 Титр раствора и титр по определяемому веществу.
- •4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
- •4.5. Кислотно-основное титрование (протолитометрия). Особенности кривой титрования
- •4.6. Факторы, влияющие на ход кривой титрования, величину скачка и положение точки эквивалентности в протолитометрии
- •4.7. Буферные растворы, классификация буферов и их применение в анализе
- •4.7.1 Классификация буферных систем.
- •4.7.2 Роль буферных растворов в аналитике
- •4.8. Расчет кислотно-основных (протолитических)
- •4.8.1. Растворы гидролизующихся солей.
- •4.8.2. Растворы сильных кислот и оснований.
- •4.8.3. Растворы слабых кислот и оснований.
- •4.8.4 Расчет концентрации протонов в кислотных и основных буферах
- •4.8.5 Определение кислотности среды при смешении растворов.
- •4.8.5.1 Смешение растворов, компоненты в которых не взаимодействуют
- •4.8.5.2 Смешение растворов, компоненты которых взаимодействуют
- •4.8.6 Многоосновные кислоты и многокислотные основания.
- •4.9. Особенности хода кривых титрования различных систем. Условия титрования многокомпонентных систем, многоосновных кислот и их солей
- •4.9.1 Кривая титрования системы сильное – сильное
- •4.9.2 Кривые титрования системы слабое – сильное
- •А) Кривая титрования слабой одноосновной кислоты сильным основанием
- •3. Область скачка, содержащая т.Э.
- •4.9.3 Титрование многоосновных (полипротонных) кислот и оснований
- •4.9.3 Кривые титрования смеси 2-х веществ
- •4.10. Окислительно-восстановительное титрование (редоксиметрия), Кривая титрования и ее особенности.
- •4.11. Расчет кривой титрования с учетом и без учета кислотности
- •4.11.1 Расчет молярной массы эквивалента в редоксиметрии.
- •4.12. Расчет потенциала в точке эквивалентности и значения константы равновесия
- •4.13. Основные виды редоксиметрии и их применение
- •4.13.1. Перманганатометрия
- •4.13.2. Иодометрия
- •4.14. Комплексометрический анализ
- •4.15. Виды комплексов. Понятие дентатности и координационного числа
- •4.16. Комплексоны, используемые для титрования. Применение комплексонометрии
- •4.17. Метод седиментации (осадительное титрование). Кривая титрования, особенности определения точки эквивалентности. Методы Фольгарда и Мора
- •4.17.2 Безиндикаторные способы определения точки эквивалентности.
- •4.17.3. Меркурометрия
4.1. Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
К основным понятиям титриметрии относятся: аликвота, рабочий раствор, стандартный раствор, титрование, титрованный раствор, титрант; кривая титрования, конец титрования и точка эквивалентности. Приведем определение этих понятий.
Аликвота (аликвотная часть) (Va) – точно отмеренный объем раствора (мл) взятый для титрования. Обычно это раствор, содержащий определяемый компонент, который помещают в колбу для титрования.
Рабочий раствор – раствор реагента точно известной концентрации, используемый непосредственно при выполнении анализа вещества.
Стандартный раствор – это раствор точно известной концентрации применяемый для стандартизации других растворов; может выполнять функции рабочего раствора.
Титрованный раствор (стандартный титрованный раствор) – любой раствор, концентрация которого точно установлена тем или иным способом.
Титрант – раствор реагента или определяемого вещества, объем которого изменяется в процессе титрования и точно фиксируется в точке эквивалентности.
Кривая титрования – график зависимости изменения параметров титруемого раствора от объема израсходованного титранта (Vт-та), например, при измерении кислотности среды: рН = f(Vт-та); потенциала системы: Е = f(Vт-та), где f знак функциональной зависимости измеряемого параметра.
Конец титрования – это реально фиксируемый каким-либо методом момент окончания реакции. Он близок, но не точно совпадает с точкой эквивалентности. Чем ближе фиксируемый конец титрования к точке эквивалентности, тем точнее титрование (меньше погрешность).
Точка эквивалентности (стехоиметричности), обозначаемая Т.Э. или Е – это теоретически рассчитанный момент титрования, когда реагент и определяемый компонент взяты в стехиометрических количествах.
Титрование это такой процесс, когда раствор титранта добавляют в титруемую пробу малыми порциями до момента фиксации окончания реакции (точке эквивалентности).
Показатель титровании (рТ) – это значение, при котором заканчивается титрование с данным индикатором при правильном его подборе. При этом показатель титрования должен быть как можно ближе к середине интервала перехода индикатора, т.е. к значению рК. Вид параметра рТ определяется типом индикатора (рТ = рН; рЕ).
Показатель индикатора (рК) – это значение, которое соответствует середине интервала перехода индикатора и рассчитывается через его константу (диссоциации, устойчивости и т.д.).
Все расчеты в титриметрии основываются на законе эквивалентов и выполняются, исходя из объема титранта, измеренного в точке конца реакции, хотя на практике вместо «конец реакции» обычно употребляют термин «точка эквивалентности». Это удобнее, однако, смешивать по сути понятия «конец реакции» и «точка эквивалентности» нельзя. Одина из главных причин погрешности титриметрического метода заключается в несовпадении фиксируемого конца реакции и реальной точки эквивалентности.
В основе титриметрических определений лежит химическая реакция между титруемым раствором и титрантом, но далеко не любая химическая реакция пригодна для ее использования в титриметрии. Их выбор обусловлен следующими требованиями:
реакция должна идти количественно, т.е. быть необратимой (Креак.>>1);
остаточная концентрация титруемого вещества в Т.Э. не может превышать 10-6 моль/л;
должен существовать способ точной фиксации точки эквивалентности (конца реакции) визуальный или инструментальный;
скачок и Т.Э. четко фиксируются и находятся в узком интервале расхода титранта (обычно 1 2 капли);
отсутствуют сопряженные реакции, влияющие на ход кривой титрования и положение Т.Э.;
скорость реакции достаточно высока, чтобы исключить перетитровывания раствора.
Отбор пробы для титрования (аликвоты) осуществляют пипеткой Мора, а расход титранта фиксируют по шкале бюретки в момент окончания реакции. Точность выполненных определений во многом зависит от правильности обращения с пипеткой Мора (рис. 4.5) и бюреткой (рис. 4.6). Особенно это касается измерения объемов. Объем будет определен правильно, если отсчет проводится по центральной части нижнего края мениска, расположенного на уровне глаз (рис. 4.5 и 4.6)
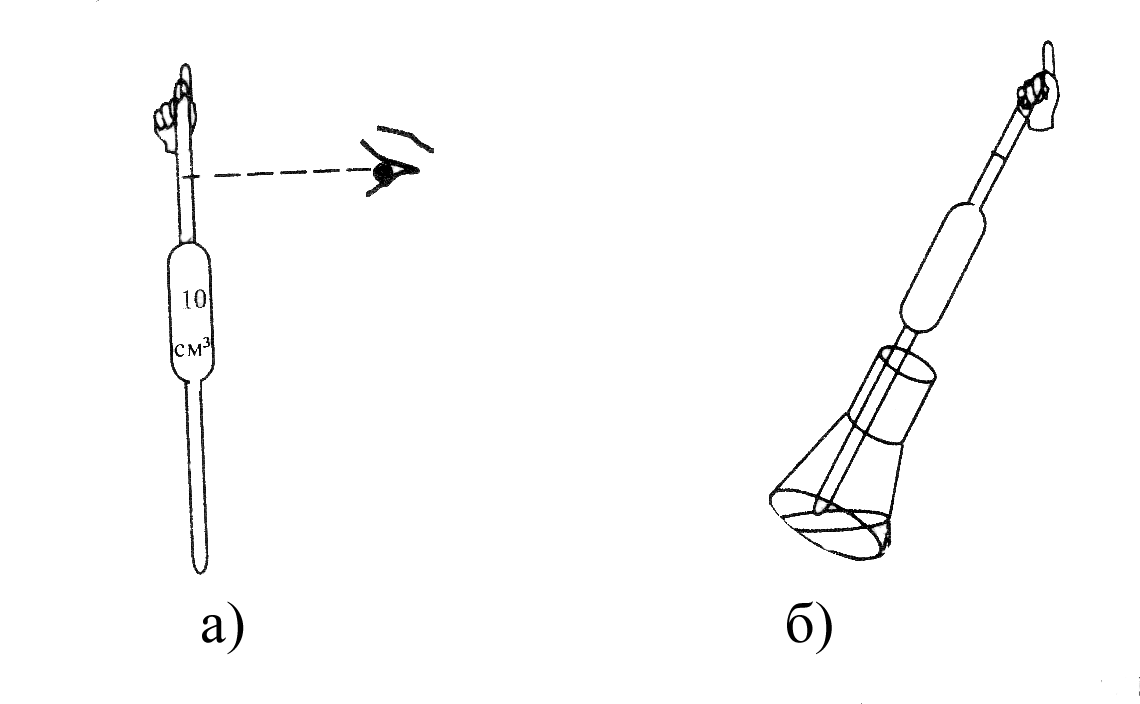
Рисунок 4.5 – Определение объема раствора при работе с пипеткой
Мора (а) и перенос аликвоты (снятие последней капли) в колбу
для титрования (б).
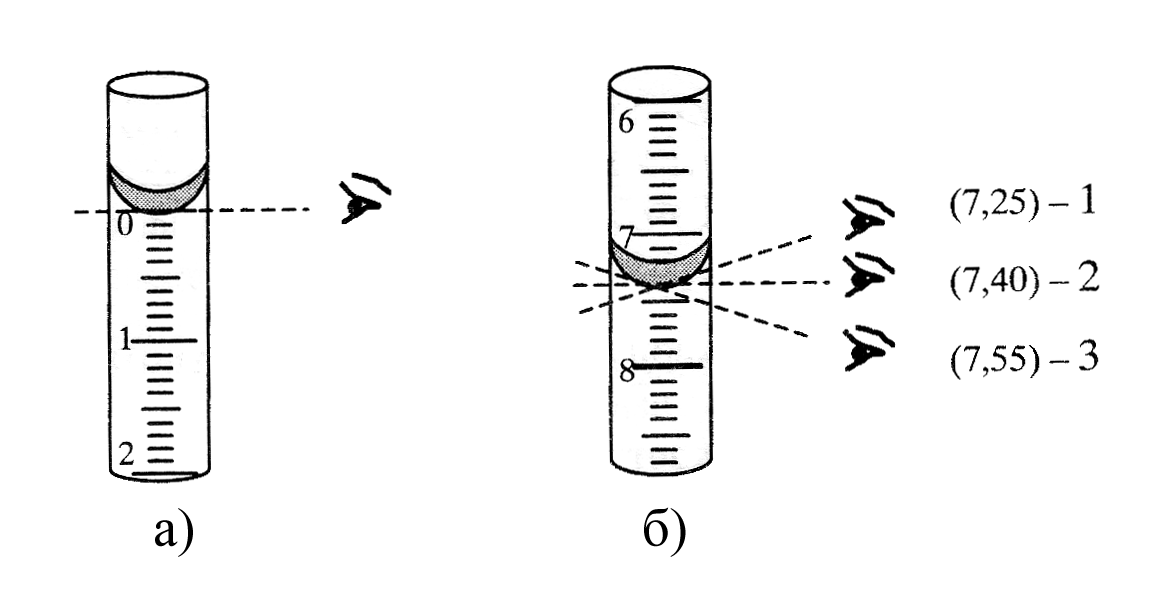
Рисунок 4.6 – Положение глаз при отсчете объема по бюретке:
а – определение нулевого положения перед началом титрования;
б – определение объема израсходованного титранта:
1 и 3 – неправильное положение глаз: объем раствора или занижен (1),
или завышен (3); 2 – правильное положение глаз при отсчете.
Титрование в лаборатории при визуальной фиксации точки эквивалентности выполняют на установке, показанной ниже на рисунке 4.6. Существуют два варианта проведения титриметрического анализа, обусловленные методикой отбора титруемой пробы: метод пипетирования и метод отдельных навесок. Они отличаются точностью и трудоемкостью.
Метод пипетирования (рис. 4.5) заключается в отборе аликвотных частей (аликвот) титруемого раствора из мерной колбы с помощью пипеток Мора. Обычно отбирают и титруют аликвоты до получения не менее 3-х сходящихся результатов. Метод прост, экспрессен, но уступает в точности методу отдельных навесок.
Метод отдельных навесок состоит во взвешивании на аналитических весах рассчитанной массы навески вещества, необходимой для каждого титрования, которые не должны значительно отличаться. Навески количественно переносят в колбы для титрования, растворяют примерно равными объемами воды и титруют. Титрование выполняю до получения не менее 3-х сходящихся значений по содержанию вещества.
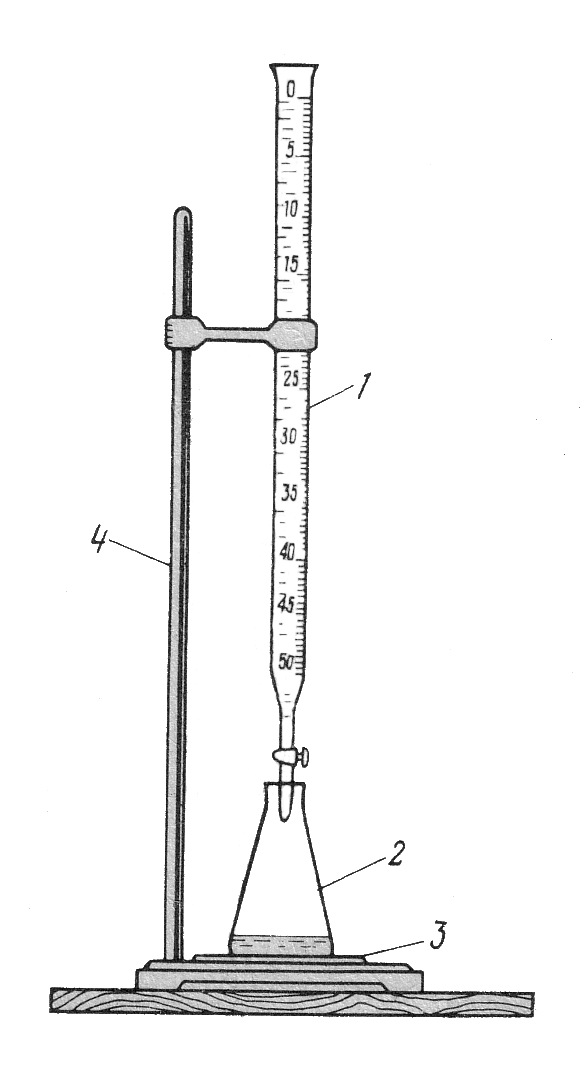
Рисунок 4.6 – установка для титрования: 1 – бюретка с раствором
титранта; 2 – колба с титруемым раствором; 3 – белая плитка или лист
белой бумаги; 4 – штатив с лапками.
Способы фиксации точки эквивалентности.
Конец реакции (точку эквивалентности) фиксируют 2-мя способами: визуальным и инструментальным.
При визуальной фиксации Т.Э. необходимо, чтобы цвет титруемого раствора контрастно изменялся от одной капли титранта в момент окончания титрования. Различают безиндикаторный и индикаторный способы визуальной фиксации Т.Э.
Безиндикаторный способ применяют тогда, когда титруемый раствор в Т.Э. контрастно изменяет свой цвет. Это возможно, если один из исходных растворов, титруемого вещества или титранта, интенсивно окрашен. Например, в перманганатометрии при определении Fe3+ в Т.Э. бесцветный титруемый раствор приобретает розовую окраску за счет появления в нем избытка ионов MnO4.
Индикаторный способ основан на добавлении в титруемый раствор незначительных количеств специального реагента – индикатора, контрастно изменяющего свой цвет от одной капли титранта вблизи Т.Э.
Инструментальный способ заключается в измерении физико-химических параметров среды в ходе титрования с помощью каких-либо приборов. К таким параметрам относятся электропроводность, потенциал (рН среды), оптическая плотность растворов и т. д. Визуальная фиксация Т.Э. невозможна, если анализируемые растворы окрашены, мутные или сильно разбавлены. Поэтому инструментальные методы используют в том случае, когда исключено применение индикаторов, а также при необходимости повышения селективности и точности методики определения.
