
- •Глава 4. Количественный химический анализ Титриметрический анализ
- •4.1. Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
- •4.2. Кривая титрования. Подбор индикаторов
- •4.2.1. Кривая титрования и ее области
- •4.2.2 Индикаторы и их подбор
- •4.2.3. Теории, объясняющие изменение окраски индикаторов.
- •4.2.4 Определение интервала перехода для отдельных групп
- •4.2.5 Индикаторные ошибки в кислотно-основном методе титрования.
- •4.3. Методы и способы титрования. Титр, титр по определяемому веществу
- •4.3.1 Способы титрования.
- •4.3.2 Титр раствора и титр по определяемому веществу.
- •4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
- •4.5. Кислотно-основное титрование (протолитометрия). Особенности кривой титрования
- •4.6. Факторы, влияющие на ход кривой титрования, величину скачка и положение точки эквивалентности в протолитометрии
- •4.7. Буферные растворы, классификация буферов и их применение в анализе
- •4.7.1 Классификация буферных систем.
- •4.7.2 Роль буферных растворов в аналитике
- •4.8. Расчет кислотно-основных (протолитических)
- •4.8.1. Растворы гидролизующихся солей.
- •4.8.2. Растворы сильных кислот и оснований.
- •4.8.3. Растворы слабых кислот и оснований.
- •4.8.4 Расчет концентрации протонов в кислотных и основных буферах
- •4.8.5 Определение кислотности среды при смешении растворов.
- •4.8.5.1 Смешение растворов, компоненты в которых не взаимодействуют
- •4.8.5.2 Смешение растворов, компоненты которых взаимодействуют
- •4.8.6 Многоосновные кислоты и многокислотные основания.
- •4.9. Особенности хода кривых титрования различных систем. Условия титрования многокомпонентных систем, многоосновных кислот и их солей
- •4.9.1 Кривая титрования системы сильное – сильное
- •4.9.2 Кривые титрования системы слабое – сильное
- •А) Кривая титрования слабой одноосновной кислоты сильным основанием
- •3. Область скачка, содержащая т.Э.
- •4.9.3 Титрование многоосновных (полипротонных) кислот и оснований
- •4.9.3 Кривые титрования смеси 2-х веществ
- •4.10. Окислительно-восстановительное титрование (редоксиметрия), Кривая титрования и ее особенности.
- •4.11. Расчет кривой титрования с учетом и без учета кислотности
- •4.11.1 Расчет молярной массы эквивалента в редоксиметрии.
- •4.12. Расчет потенциала в точке эквивалентности и значения константы равновесия
- •4.13. Основные виды редоксиметрии и их применение
- •4.13.1. Перманганатометрия
- •4.13.2. Иодометрия
- •4.14. Комплексометрический анализ
- •4.15. Виды комплексов. Понятие дентатности и координационного числа
- •4.16. Комплексоны, используемые для титрования. Применение комплексонометрии
- •4.17. Метод седиментации (осадительное титрование). Кривая титрования, особенности определения точки эквивалентности. Методы Фольгарда и Мора
- •4.17.2 Безиндикаторные способы определения точки эквивалентности.
- •4.17.3. Меркурометрия
3. Область скачка, содержащая т.Э.
В Т.Э. слабое основание полностью прореагировало с прибавленной сильной кислотой. В растворе присутствует только соль, образованная катионом слабого основания, которая подвергается гидролизу по катиону:
NH4OH + HCl = NH4Cl + H2O – уравнение Т.Э.
![]() + HOH
NH4OH
+ H+
уравнение гидролиза
+ HOH
NH4OH
+ H+
уравнение гидролиза
Т.к. в следствии гидролиза NH4Cl в растворе присутствует избыток ионов H+, то Т.Э. в этой системе смещена в кислую среду и для ее фиксации применяют индикаторы, срабатывающие при pH < 7, например метиловый оранжевый.
4.
![]()
область после Т.Э.
область после Т.Э.
Значение pH титруемого раствора после Т.Э. определяется концентрацией Сизб(T) – сильной кислоты, в присутствии которой гидролиз образовавшейся соли подавляется и практически не вносит заметного вклада в величину pH раствора. Концентрация протонов возрастает пропорционально изменению концентрации избытка титранта HCl в растворе, т. е. рН меняется достаточно быстро (убывает).
4.9.3 Титрование многоосновных (полипротонных) кислот и оснований
Кривая титрования многоосновной кислоты содержит несколько точек эквивалентности (рис. 4.18) и до первой Т.Э. рассчитывается по тем же соотношениям, которые использовались для расчета кривой титрования одноосновной кислоты, учитывая диссоциацию многоосновной кислоты только по первой ступени. Возможность титрования многоосновной кислоты с заданной точностью по первой точке эквивалентности зависит от соотношения ступенчатых констант диссоциации.
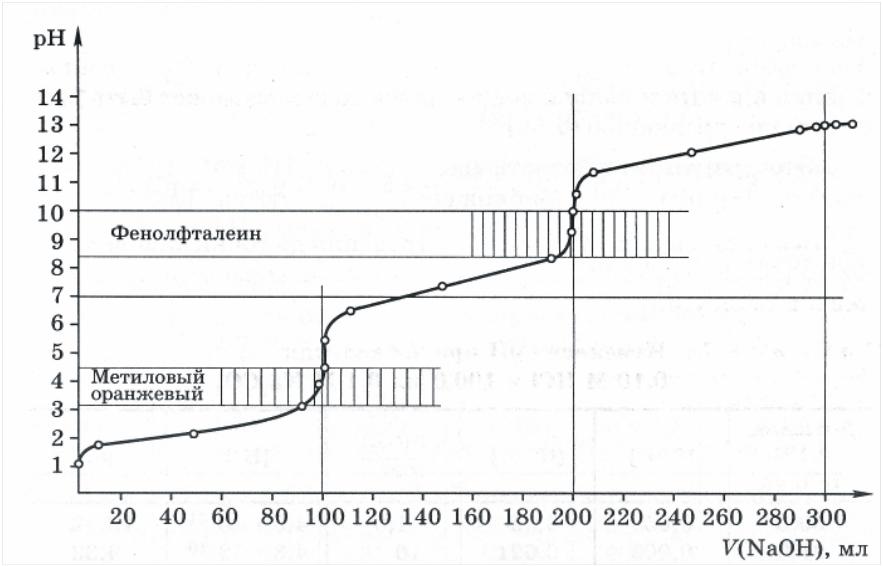
Рисунок 4.18 – Кривая титрования 100,0 мл 0,3 н. H3PO4
рабочим раствором 0,1 н. NaOH.
На рисунке 4.18 представлен типичный вид такой кривой титрования на примере 3-х основной кислоты H3PO4. Как видно из хода кривой титровании, она имеет три точки эквивалентности и соответственно – 3-и скачка титрования, однако величина их не равноценна. Чем сильнее оттитрована кислота, тем больше становится влияние реакции гидролиза продуктов. В частности, прямым титрованием 3-я точка эквивалентности для кислоты H3PO4 определена быть не может в следствии малости величины скачка.
Расход титранта для каждой из ступеней – одинаков (100 мл), так как титруется одинаковое количество протонов. Молярная масса эквивалента титруемого вещества рассчитывается, исходя из количества замещенных в ходе реакции протонов или гидроксо-групп. Так, для ортофосфорной кислоты эти значения составляют: 98 г-экв/моль; 49 г-экв/моль и 32,67 г-экв/моль в соответствии с числом замещенных протонов по 1-, 2- или 3-й ступени.
Ход КТ в промежутке между 12-й и 23-й ТЭ определяется формированием солевых буферных систем, поэтому обычно такие кислоты и основания, особенно слабые, титруют по методу замещения или обратным. Если это невозможно, то определение выполняют прямым титрованием по 1-й, реже – по 2-й точке эквивалентности, где величина скачка еще значительна.
Титрование соли слабой многоосновной (полипротонной) кислоты
Кривые титрования солей слабых полипротонных кислот аналогичны КТ самих кислот (рис. 4.18 и 4.19).
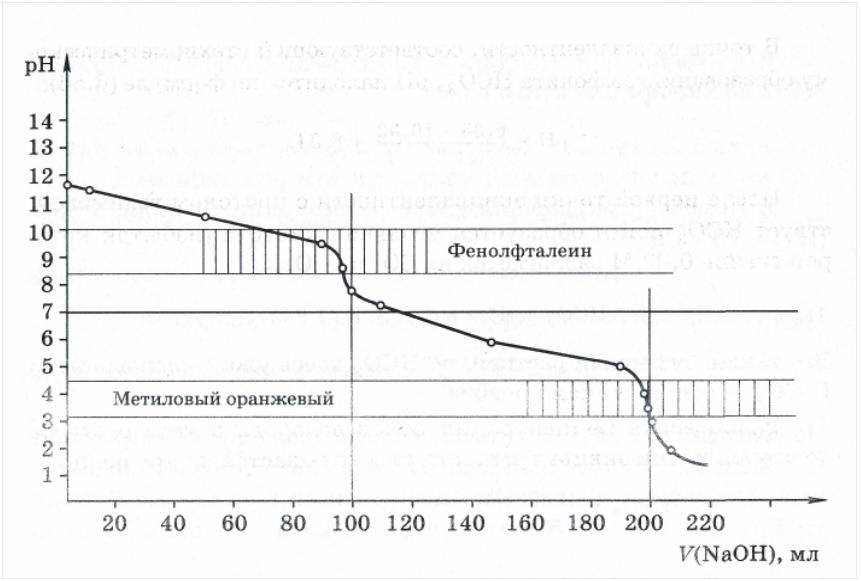
Рисунок 4.19 – Кривая титрования 100,0 мл 0,2 н. раствора Na2CO3
0,1 н. рабочим раствором HCl
На рисунке 4.19 представлен ход кривой титрования соли угольной кислоты карбоната натрия. Кривая имеет 2-е точки эквивалентности (количество точек эквивалентности определяется основностью кислотного аниона) и представляет зеркальное отражение кривой титрования самой угольной кислоты. Расход титранта на каждой из ступеней – одинаков и соответствует титрованию 1-го протона (100 мл).В зависимости от числа оттитрованных протонов, меняется и масса эквивалента соли, по которой выполняется расчет:
1-я ступень: Na2CO3 + HCl = NaHCO3 + NaCl; Мэкв(Na2CO3) = М(Na2CO3)
2-я ступень: Na2CO3 + 2HCl = H2CO3 + NaCl; Мэкв(Na2CO3) = 1/2М(Na2CO3)
