
- •Глава 4. Количественный химический анализ Титриметрический анализ
- •4.1. Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
- •4.2. Кривая титрования. Подбор индикаторов
- •4.2.1. Кривая титрования и ее области
- •4.2.2 Индикаторы и их подбор
- •4.2.3. Теории, объясняющие изменение окраски индикаторов.
- •4.2.4 Определение интервала перехода для отдельных групп
- •4.2.5 Индикаторные ошибки в кислотно-основном методе титрования.
- •4.3. Методы и способы титрования. Титр, титр по определяемому веществу
- •4.3.1 Способы титрования.
- •4.3.2 Титр раствора и титр по определяемому веществу.
- •4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
- •4.5. Кислотно-основное титрование (протолитометрия). Особенности кривой титрования
- •4.6. Факторы, влияющие на ход кривой титрования, величину скачка и положение точки эквивалентности в протолитометрии
- •4.7. Буферные растворы, классификация буферов и их применение в анализе
- •4.7.1 Классификация буферных систем.
- •4.7.2 Роль буферных растворов в аналитике
- •4.8. Расчет кислотно-основных (протолитических)
- •4.8.1. Растворы гидролизующихся солей.
- •4.8.2. Растворы сильных кислот и оснований.
- •4.8.3. Растворы слабых кислот и оснований.
- •4.8.4 Расчет концентрации протонов в кислотных и основных буферах
- •4.8.5 Определение кислотности среды при смешении растворов.
- •4.8.5.1 Смешение растворов, компоненты в которых не взаимодействуют
- •4.8.5.2 Смешение растворов, компоненты которых взаимодействуют
- •4.8.6 Многоосновные кислоты и многокислотные основания.
- •4.9. Особенности хода кривых титрования различных систем. Условия титрования многокомпонентных систем, многоосновных кислот и их солей
- •4.9.1 Кривая титрования системы сильное – сильное
- •4.9.2 Кривые титрования системы слабое – сильное
- •А) Кривая титрования слабой одноосновной кислоты сильным основанием
- •3. Область скачка, содержащая т.Э.
- •4.9.3 Титрование многоосновных (полипротонных) кислот и оснований
- •4.9.3 Кривые титрования смеси 2-х веществ
- •4.10. Окислительно-восстановительное титрование (редоксиметрия), Кривая титрования и ее особенности.
- •4.11. Расчет кривой титрования с учетом и без учета кислотности
- •4.11.1 Расчет молярной массы эквивалента в редоксиметрии.
- •4.12. Расчет потенциала в точке эквивалентности и значения константы равновесия
- •4.13. Основные виды редоксиметрии и их применение
- •4.13.1. Перманганатометрия
- •4.13.2. Иодометрия
- •4.14. Комплексометрический анализ
- •4.15. Виды комплексов. Понятие дентатности и координационного числа
- •4.16. Комплексоны, используемые для титрования. Применение комплексонометрии
- •4.17. Метод седиментации (осадительное титрование). Кривая титрования, особенности определения точки эквивалентности. Методы Фольгарда и Мора
- •4.17.2 Безиндикаторные способы определения точки эквивалентности.
- •4.17.3. Меркурометрия
4.8.6 Многоосновные кислоты и многокислотные основания.
Для 2-х основных кислот расчет рН в первом приближении можно выполнять как для одноосновных, подставляя К1 вместо значения К, в том случае, если отношение К1/К2 103, так как диссоциация по 2-й ступени и тем более последующим будет практически подавлена.
При близких значениях констант диссоциации, определение рН проводят, исходя из равновесных концентраций всех форм ионов, на основе уравнений материального баланса.
Многоосновные кислоты (основания) в водных растворах диссоциируют ступенчато, образуя сложные многокомпонентные системы. Так для кислоты Н3Х (например, Н3РО4) необходимо записать три протолитических уравнения в соответствии с числом констант:
для К1 Н3Х + Н2О Н3О+ + Н2Х (4.43)
для К2 Н2Х + Н2О Н3О+ + НХ2 (4.44)
для К3 НХ2 + Н2О Н3О+ + Х3 (4.45)
и составить систему расчетных уравнений
![]() (4.46)
(4.46)
Если необходимо найти равновесные концентрации всех частиц в растворе многоосновных кислот (оснований), то в этом случае можно провести вычисления по следующему алгоритму:
записать уравнения реакций диссоциации по всем ступеням в ионной форме;
записать формулы констант равновесия (диссоциации) и найти в справочнике их численные значения;
обозначить буквой х наименьшую равновесную концентрацию и выразить через х концентрации остальных частиц;
подставить равновесные концентрации частиц в выражение для константы равновесия и выполнить расчет.
Например, необходимо вычислить равновесные концентрации частиц в 0,1моль/л растворе ортофосфорной кислоты.
I
ступень H3PO4
H+
+ H2PO4
; К1 =
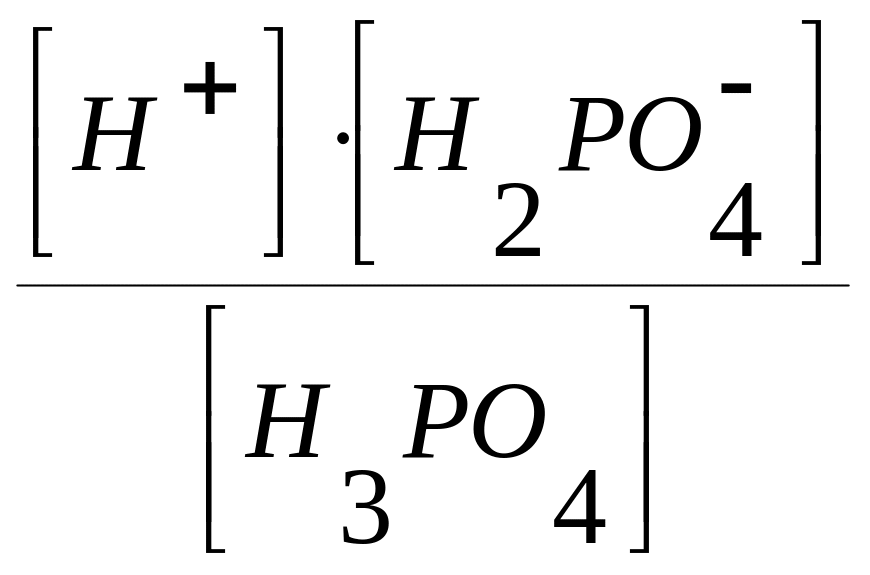 = 7,6103
;
= 7,6103
;
II
ступень Н2РО4
H+ + HPO4
2
; К2 =
 = 6,2108
;
= 6,2108
;
III
ступень HPO4 2
H+ + PO4
3
; К3 =
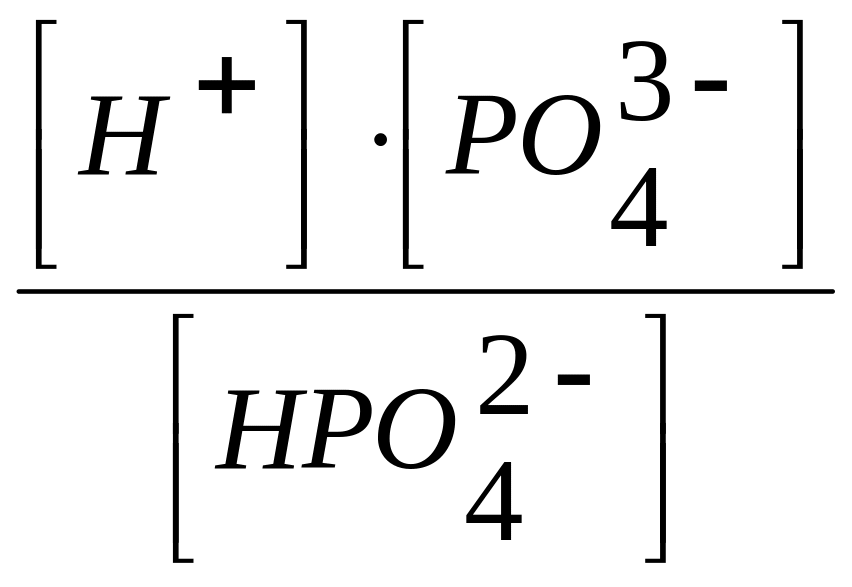 = 4,21013
.
= 4,21013
.
В первом приближении
расчет можно провести по I
ступени из-за большой разности в
константах. Обозначим через х
концентрацию протонов [H+],
тогда [H+] = [H2PO4]
= x, а [H3PO4]
= 0,1 – х ; и К1 =
![]() = 7,6103
,
= 7,6103
,
откуда х2 + 7,6103х 7,6103 .
Решение квадратного уравнения относительно х дает [H+] = [H2PO4] = 2,4102 моль/л и [H3PO4] = 0,1 – 0,024 = 0,076 моль/л.
Для более точного вычисления рН необходимо составить уравнения материального баланса по каждой ступени, без введения упрощений. Такой расчет достаточно сложен и требует значительных затрат времени. Для решения большинства задач титриметрического анализа такая точность не требуется, поэтому достаточно провести приближенную оценку параметров среды, используя формулы, приведенные в таблице 4.4.
4.9. Особенности хода кривых титрования различных систем. Условия титрования многокомпонентных систем, многоосновных кислот и их солей
Знать особенности хода кривых титрования различных систем важно, так как это позволяет не только правильно подобрать индикатор и снизить погрешность при визуальном определении точки эквивалентности, но и в ряде случаев выполнить титрование смеси компонентов без их предварительного разделения, что актуально с точки зрения экономии времени и повышения качества определения (чем меньше стадий в методике, тем выше общая точность для данного метода).
