
- •Глава 4. Количественный химический анализ Титриметрический анализ
- •4.1. Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
- •4.2. Кривая титрования. Подбор индикаторов
- •4.2.1. Кривая титрования и ее области
- •4.2.2 Индикаторы и их подбор
- •4.2.3. Теории, объясняющие изменение окраски индикаторов.
- •4.2.4 Определение интервала перехода для отдельных групп
- •4.2.5 Индикаторные ошибки в кислотно-основном методе титрования.
- •4.3. Методы и способы титрования. Титр, титр по определяемому веществу
- •4.3.1 Способы титрования.
- •4.3.2 Титр раствора и титр по определяемому веществу.
- •4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
- •4.5. Кислотно-основное титрование (протолитометрия). Особенности кривой титрования
- •4.6. Факторы, влияющие на ход кривой титрования, величину скачка и положение точки эквивалентности в протолитометрии
- •4.7. Буферные растворы, классификация буферов и их применение в анализе
- •4.7.1 Классификация буферных систем.
- •4.7.2 Роль буферных растворов в аналитике
- •4.8. Расчет кислотно-основных (протолитических)
- •4.8.1. Растворы гидролизующихся солей.
- •4.8.2. Растворы сильных кислот и оснований.
- •4.8.3. Растворы слабых кислот и оснований.
- •4.8.4 Расчет концентрации протонов в кислотных и основных буферах
- •4.8.5 Определение кислотности среды при смешении растворов.
- •4.8.5.1 Смешение растворов, компоненты в которых не взаимодействуют
- •4.8.5.2 Смешение растворов, компоненты которых взаимодействуют
- •4.8.6 Многоосновные кислоты и многокислотные основания.
- •4.9. Особенности хода кривых титрования различных систем. Условия титрования многокомпонентных систем, многоосновных кислот и их солей
- •4.9.1 Кривая титрования системы сильное – сильное
- •4.9.2 Кривые титрования системы слабое – сильное
- •А) Кривая титрования слабой одноосновной кислоты сильным основанием
- •3. Область скачка, содержащая т.Э.
- •4.9.3 Титрование многоосновных (полипротонных) кислот и оснований
- •4.9.3 Кривые титрования смеси 2-х веществ
- •4.10. Окислительно-восстановительное титрование (редоксиметрия), Кривая титрования и ее особенности.
- •4.11. Расчет кривой титрования с учетом и без учета кислотности
- •4.11.1 Расчет молярной массы эквивалента в редоксиметрии.
- •4.12. Расчет потенциала в точке эквивалентности и значения константы равновесия
- •4.13. Основные виды редоксиметрии и их применение
- •4.13.1. Перманганатометрия
- •4.13.2. Иодометрия
- •4.14. Комплексометрический анализ
- •4.15. Виды комплексов. Понятие дентатности и координационного числа
- •4.16. Комплексоны, используемые для титрования. Применение комплексонометрии
- •4.17. Метод седиментации (осадительное титрование). Кривая титрования, особенности определения точки эквивалентности. Методы Фольгарда и Мора
- •4.17.2 Безиндикаторные способы определения точки эквивалентности.
- •4.17.3. Меркурометрия
Глава 4. Количественный химический анализ Титриметрический анализ
Количественный анализ вещества это экспериментальное определение (измерение) содержания химических элементов, соединений или их форм в анализируемом веществе, выраженное в численном виде. Цель количественного анализа – определение содержания (концентрации) компонентов в образце. Его можно осуществлять, используя различные методы: химические, физико-химические, физические, биологические.
Химические методы включают гравиметрические (весовые) и титриметрические или объемные виды анализа.
Гравиметрические методы основаны на точном измерении массы определяемого компонента, либо количественно связанного с ним соединения с точно известным составом.
Под титриметрическим анализом понимают определение содержания вещества по точно измеренному количеству реагента (массе или объему), вступившего в реакцию с определяемым компонентом в эквивалентном количестве.
Методы количественного химического анализа не требуют сложной аппаратуры, обладают хорошей точностью и воспроизводимостью. Так как погрешность многих титриметрических методов не превышает ± 0,5 0,1%, а гравиметрических – не более 0,1%, то эти методы до сих пор используются в качестве метрологических при проведении аттестации методик анализа. Однако им присущ ряд недостатков. Наиболее существенными являются недостаточная селективность и чувствительность, что требует тщательной подготовки пробы и применяемых реагентов.
Для проведения химического анализа используют реактивы следующих квалификаций: ч.(чистые), ч.д.а. – чистые для анализа; х.ч. – химически чистые; о.с.ч. – особо чистые. Наименьшее содержание примесей имеют реагенты марки о.с.ч. и ч.д.а., тогда как реактивы квалификации х.ч.(чистые) и ниже не всегда пригодны для количественных определений и требуют дополнительной очистки.
Качество полученных результатов во многом определяется правильностью подбора посуды и оборудования. Для проведения количественного анализа используют самую разнообразную лабораторную посуду и весы. По назначению ее классифицируют на:
посуду специального назначения – применяется для выполнения узкого круга операций. Это различного рода пикнометры, ареометры, холодильники, круглодонные колбы, колбы Кьельдаля ;
посуду общего назначения – наиболее часто применяемая в самых разных видах работ: кипячении, титровании, фильтрации и т.д. Это пробирки, воронки, химические стаканы, плоскодонные круглые и конические колбы (Эрленмейера), кристаллизаторы, чашки Петри, бюксы, эксикаторы (рис. 4.1 и 4.2);
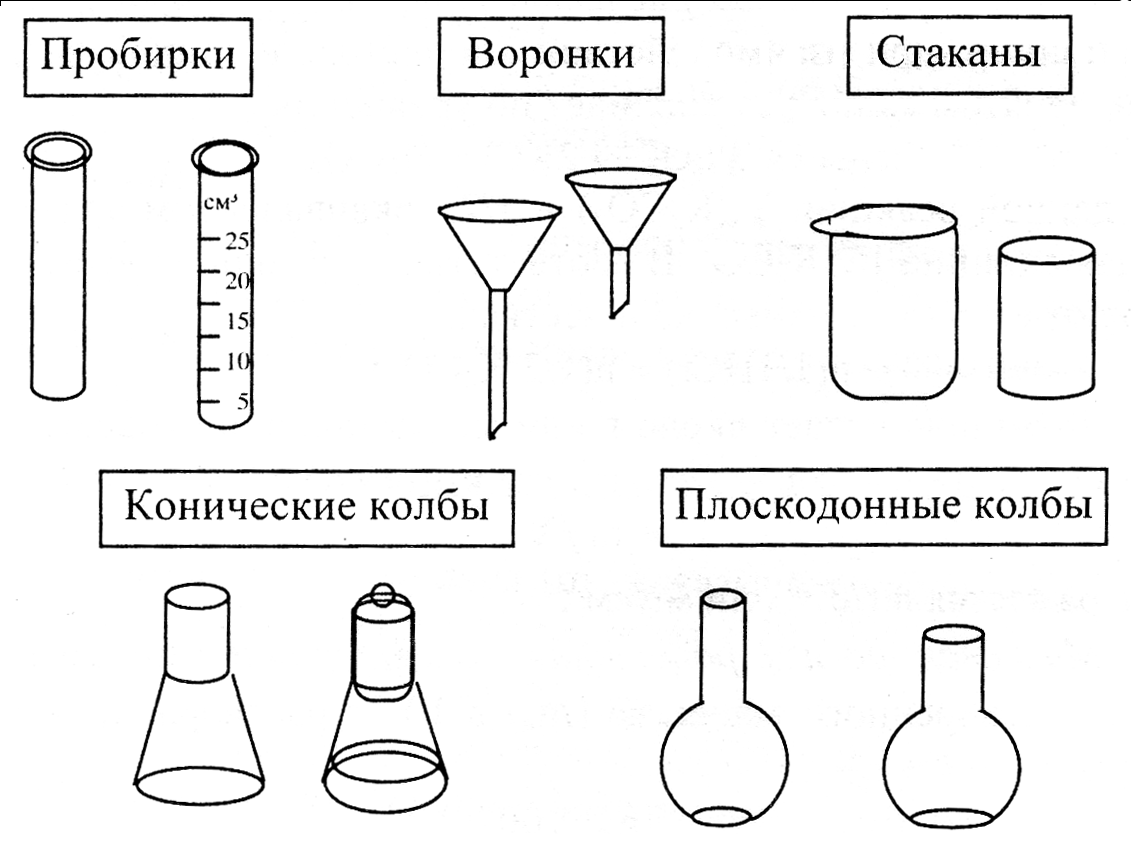
Рисунок 4.1 – лабораторная посуда общего назначения, применяемая в различных методах анализа.
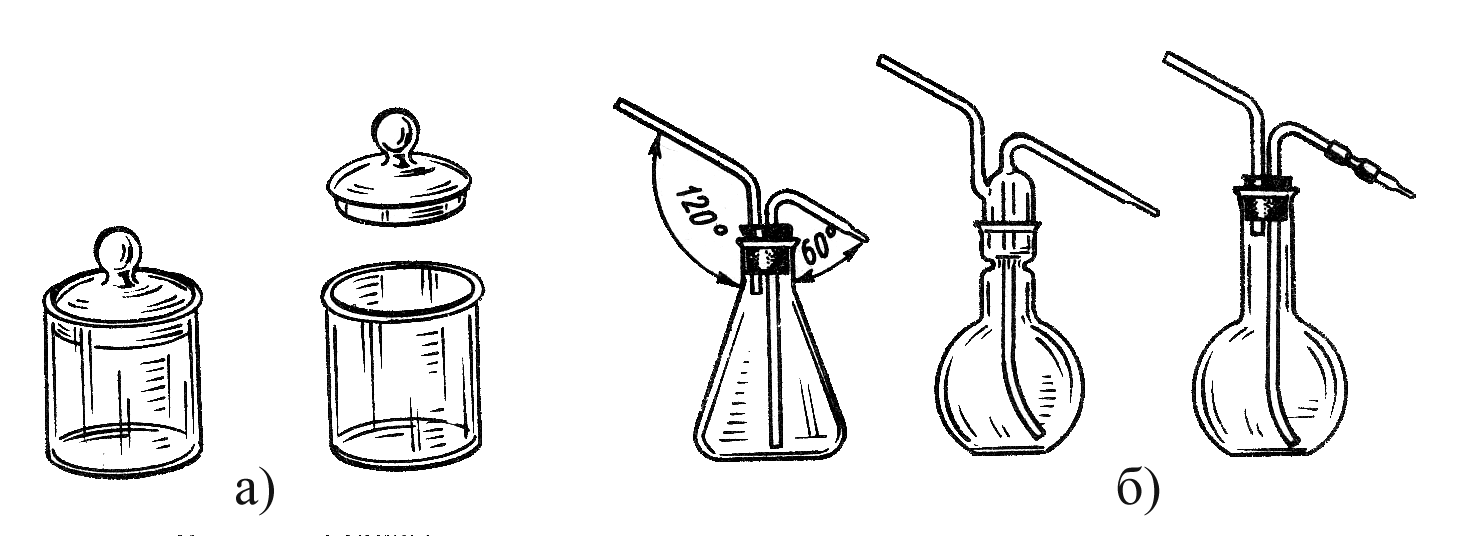
Рисунок 4.2 – посуда общего назначения: а) стеклянные бюксы с крышками для взвешивания и хранения гигроскопичных веществ; б) различного вида промывалки для ополаскивания посуды.
мерную посуда – служит для измерения объемов жидкости. Ее делят на посуду точного измерения: пипетки (Мора и градуированные), бюретки, мерные колбы Мора (рис.4.3) и неточную измерительную посуду: мерные цилиндры, мензурки, стаканы, колбы с делениями, градуированные пробирки: цилиндрические и конические или пальчиковые (рис. 4.4).
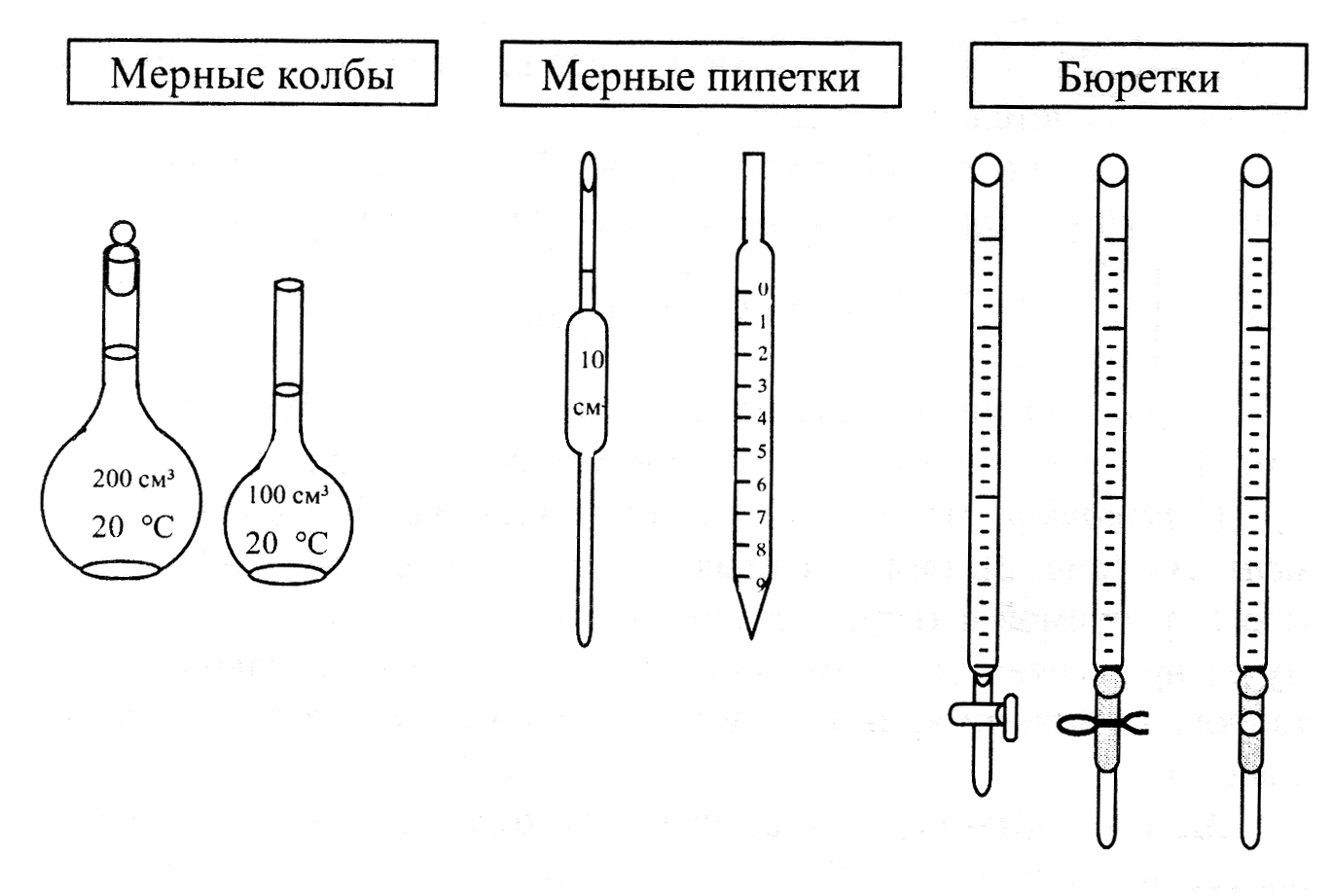
Рисунок 4.3 посуда для точного измерения объема, применяемая при
отборе аликвот, приготовлении стандартных растворов и в титровании.
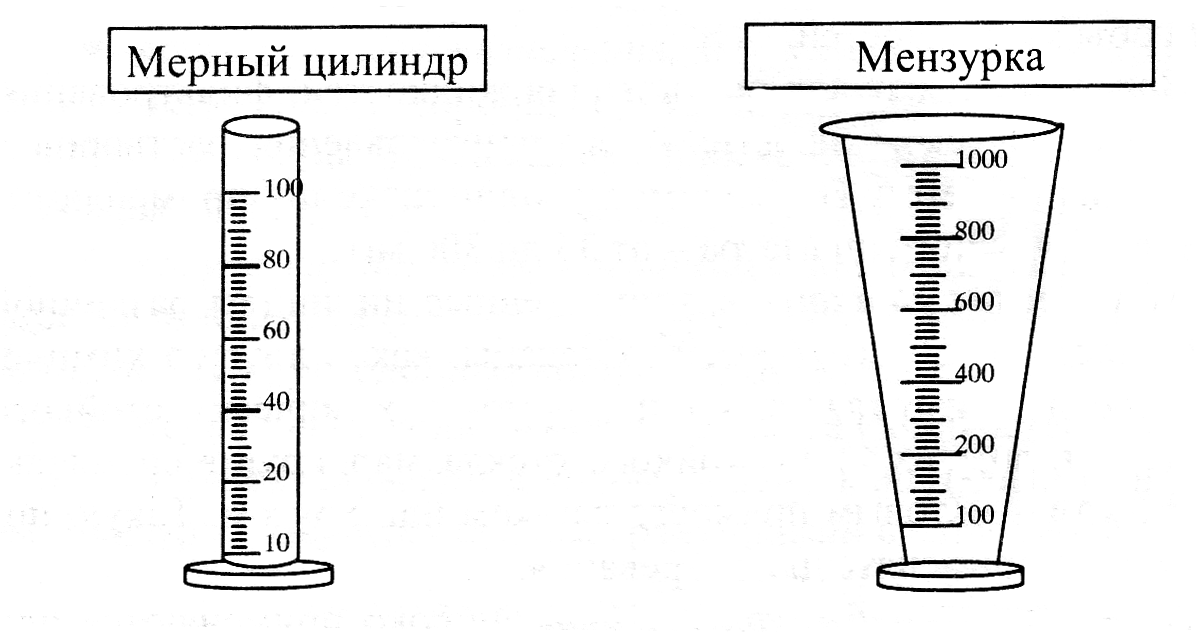
Рисунок 4.4 Посуда для неточного измерения объема, применяемая
для приготовлении растворов подлежащих стандартизации и реагентов
в качественном анализе.
Для взятия аликвот в титриметрии, при количественном осаждении из растворов, а также при приготовлении стандартных растворов различного назначения используют всегда только посуду точного измерения и аналитические весы! Посуду для неточного измерения объема и технохимические весы применяют: при приготовлении стандартизируемых растворов, измерении объемов растворов, применяемых для поддержании кислотности среды (буферов), проведения осаждения и титрования аликвот. При работе с мерной посудой, особенно точной, необходимо соблюдать ее чистоту. С этой целью посуду перед применением всегда ополаскивают дистиллированной водой и сушат. Точную посуду сушат на воздухе с применением эфира или спирта, а неточную и общего назначения – на сушилках с обогревом или в сушильном шкафу. Для исключения ошибки при отборе аликвот и работе с бюретками, их дополнительно ополаскивают еще и измеряемым раствором.
Изменение температуры среды приводит к возникновению погрешности измерения: завышению или занижению определяемого объема, а значит и рассчитываемой концентрации. Поэтому, вся мерная посуда имеет штамп с указанием ее объема при 20ºС, а посуду точного измерения дополнительно калибруют дистиллированной водой, используя аналитические весы и внося поправку на плотность воды при данной температуре. Иногда имеется дополнительная маркировка, указывающая на термостойкость и химическую устойчивость. Термостойкость стекла обозначается матовым квадратом или кругом. В такой посуде нагревают и кипятят жидкости на плитках и газовых горелках.
Весы. Устройства, применяемые для определения массы тел называют весами. В химическом анализе используют два вида весов: технические и аналитические. Они могут быть как механическими, так и электронными; иметь одну чашку (квадрантные механические и электронные) или две (чашечные и демпферные весы). Под взвешиванием понимают сравнение массы данного предмета с массой калиброванных грузов (разновесов) или же измерение давления, которое предмет оказывает на чашку весов в пересчете его на единицы массы. Разновесы необходимы при работе на демпферных или чашечных весах, а в квадрантных и электронных одночашечных весах шкалы уже проградуированы в единицах массы.
Весы различаются по классу точности и пределам измерения. Технические весы – наименее точные и применяются для взвешивания относительно больших по массе образцов. Для химических целей обычно используют квадрантные или чашечные технические весы на 0,2 – 1 кг (иногда до 5 кг). Точность их не превышает 0,01 – 20 г. Технические весы с точностью 0,1 – 0,01 г называют технохимическими и используют в лаборатории для взятия навесок от 1 до 500 г. В современных электронных технических весах точность измерений может быть и выше: при предельной массе предмета в 500 г, она варьирует от 0,001 г до 0,2 г.
Аналитические весы служат для точного определения массы навески при приготовлении стандартных растворов, проведении гравиметрических измерений и др. Точность демпферных весов составляет ± 2104 2105 г , а электронных до 2106 г. В среднем такие весы рассчитаны на предельную массу предмета 50 – 200 г, но выпускаются весы и повышенной точности на предельную массу навески 1 – 20 г, которые применяют в некоторых видах инструментального анализа, например в спектральном.
При работе на весах необходимо строго соблюдать правила обращения с ними. Из-за неправильной установки или небрежного обращения можно получить недостоверные результаты, а также вывести весы из строя. Особенно это важно помнить при использовании электронных и аналитических демпферных весов.
