
- •Тепловые эффекты изохорно - изотермических и изобарно - изотермических химических реакций.Закон гесса и его следствия.
- •Источники тепла и тепловые режимы.Привести примеры источников тепла заданной температуры и заданной интенсивности.
- •Основные уравнения процессов течения жидкости и газа. Уравнение бернулли и его физический смысл.
- •Основной закон теплопроводности или закон фурье.Градиент температуры, плотность теплового потока.
ЧТО ИЗУЧАЕТ ТЕРМОДИНАМИКА КАК НАУКА? ЧТО ОТРАЖЕНО В 1-ОМ И ВО 2-ОМ НАЧАЛАХ ТЕРМОДИНАМИКИ. ДАТЬ ОПРЕДЕЛЕНИЕ ГОМОГЕННОЙ И ГЕТЕРОГЕННОЙ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМАМ, РАСКРЫТЬ ПОНЯТИЯ ЭКСТЕНСИВНЫХ И ИНТЕНСИВНЫХ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ СОСТОЯНИЯ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ.
Термодинамика – наука о закономерностях превращения энергии.
В ее основе 2 закона:
Закон позволяет оценить количественную сторону процессов превращения энергии. Связан с законом сохранения и превращения энергии, частный случай этого закона.
Закон оценить качественную сторону физических и химических процессов.
ГОМОГЕННАЯ СИСТЕМА хим.соствав и физ.свойства одинаковы во всех ее частях, или монотонно изменяются от точки к точке. Все чистые минералы, расплавленные горные породы.
ГЕТЕРОГЕННАЯ СИСТЕМА состоит из двух и более гомогенных областей или фаз при переходе из фазы к фазе хим.состав и физ. свойства изменяются скачкообразно. Все горные породы.
ИНТЕНСИВНЫЕ ПАРАМЕТРЫ не зависят от количества вещества (температура и давление).
ЭКСТЕНСИВНЫЕ ПАРАМЕТРЫ зависят от количества вещества (объем, теплоемкость, внутренняя энергия)
Если экстенсивные параметры разделить на массу, то они приобретают смысл интенсивных (удельный объем, удельная теплоемкость, энтальпия).
По закону сохранения энергии можно записать:


Математическое выражение первого закона термодинамики.
ЭНТАЛЬПИЯ И ЭНТРОПИЯ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ. ВОЗРАСТАНИЕ ЭНТРОПИИ В НЕОБРАТИМЫХ ПРОЦЕССАХ. МАТЕМАТИЧЕСКИЕ ВЫРАЖЕНИЯ ЭНТРОПИИ ДЛЯ ОБРАТИМЫХ И НЕОБРАТИМЫХ ПРОЦЕССОВ В ИЗОЛИРОВАННОЙ И НЕ ИЗОЛИРОВАННОЙ СИСТЕМАХ. ЭНТАЛЬПИЯ, ЭНТРОПИЯ.
ЭНТАЛЬПИЯ
– (экстенсивный параметр) это сумма
полной внутренней энергии, и произведения
давления в системе на ее объем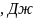 .
.

В
обратимом процессе разность между
подведенным количеством энергии в
прямом направлении (Q1)
и отведенным в обратном направлении
(Q2)
равна энергии затрачиваемой на внешнюю
работу ,
отсюда можно найти КПД термодинамического
процесса:
,
отсюда можно найти КПД термодинамического
процесса:

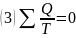
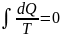
Подынтегральное выражение Клаузиус заменил на:

Клаузиус сформулировал 2 закон термодинамики: теплота не может сама собой переходить от более холодного тела к более нагретому.
По закону сохранения энергии общее изменение энтропии равно:
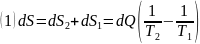 т.к.
т.к.
 >
>
 по второму закону,
то
энтропия в необратимом процессе
изолированной системы всегда возрастает.
по второму закону,
то
энтропия в необратимом процессе
изолированной системы всегда возрастает.
Если система не изолирована, то уравнение (1) принимает вид:

Вывод:
энтропия любых процессов не может
уменьшаться. Для обратимых процессов
она постоянная ,
а для необратимых процессов она возрастает
,
а для необратимых процессов она возрастает
Изолированная система |
Неизолированная система |
Обратимый процесс |
|
dS=0 |
dS=dQ/T |
Необратимый процесс |
|
dS>0 |
dS>dQ/T |
dS≥ 0 |
dS≥dQ/T |
Тепловые эффекты изохорно - изотермических и изобарно - изотермических химических реакций.Закон гесса и его следствия.
Основой химической термодинамики являются I и II закон:
I закон позволяет определить тепловые эффекты реакции.
II закон позволяет определить условия при которых будет протекать химическая реакция.
Химическая реакция:
с выделением тепла называется ЭКЗОТЕРМИЧЕСКАЯ
с поглощением тепла называется ЭНДОТЕРМИЧЕСКАЯ.
Количество тепла, выделяющееся или поглощающееся в результате химической реакции при постоянном объеме и температуре или давлении и температуре и отсутствии внешней работы называется ТЕПЛОВЫМ ЭФЕКТОМ ХИМИЧЕСКОЙ РЕАКЦИИ.
Тепловые эффекты бывают:
Для изохорно-изотермических(V=const, T=const) Qv
dV=0 и первый закон термодинамики имеет вид:
 ,
т.е.
тепловой эффект равен изменению
внутренней энергии системы в результате
химической реакции
,
т.е.
тепловой эффект равен изменению
внутренней энергии системы в результате
химической реакции
Для изобарно-изотермических (P=const, T=const) Qp
dP=0 и I закон имеет вид
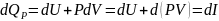
Т.е. тепловой эффект равен изменению ЭНТАЛЬПИИ системы в результате протекания химической реакции:
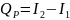
Закон Гесса 1840г. Тепловой эффект химической реакции равен теплоте образования исходных веществ минус теплота образования продуктов реакции.
Теоретически закон Гесса позволяет определить тепловые эффекты химических реакций, которые экспериментально определить очень сложно.
3 следствия:
Тепловой эффект образования химического соединения из исходных веществ не зависит от способа, которым это соединение было получено.
Тепловой эффект образования хим.соединения из исходных веществ равен тепловому эффекту с обратным знаком разложения этого соединения до исходных продуктов.
Разность между тепловыми эффектами превращения одного вещества в 2 различных продукта равна тепловому эффекту превращения одного продукта в другой.
УПРУГИЕ, ЭЛЕКТРИЧЕСКИЕ И МАГНИТНЫЕ СВОЙСТВА ГОРНЫХ ПОРОД. ПАРАМЕТРЫ, ХАРАКТЕРИЗУЮЩИЕ ЭТИ СВОЙСТВА. КЛАССИФИКАЦИЯ ГОРНЫХ ПОРОД В ЗАВИСИМОСТИ ОТ ЭНЕРГИИ АКТИВАЦИИ И УДЕЛЬНОГО ЭЛЕКТРИЧЕСКОГО СОПРОТИВЛЕНИЯ.
Упругие свойства.
Различают
изотермическое и адиабатическое
деформирование горных пород, следовательно
модуль Упругости (Е, н/м2),
модуль сдвига (G,
н/м2)
и коэффициент Пуассона (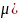 делятся на изотермические (не зависят
от температуры) и адиабатические (
зависят от температуры).
делятся на изотермические (не зависят
от температуры) и адиабатические (
зависят от температуры).
Для чистых минералов (кроме кварца) с повышением температуры Е снижается по линейному закону вплоть до температуры плавления породы.
Упругие свойства скальных пород с ростом температуры также уменьшаются, причем, чем порода более однородная по минеральному составу, тем функция Е=Е(Т) ближе к линейной.
Зависимость адиабатического модуля Юнга от температуры можно представить в виде:
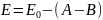
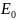 -
Модуль Юнга при нуле градусов Кельвина,
н/м2.
-
Модуль Юнга при нуле градусов Кельвина,
н/м2.
А – характеризует влияние внутренней энергии пород, н/м2.
В – характеризует изменение модуля упругости в связи с тепловым расширением минералов и пород при изменении их температуры, н/м2.
Для минералов модуль упругости изменяется линейно.
Для мономинеральных пород почти линейно.
Для полиминеральных пород не линейно.

При нагреве или охлаждении горных пород с последующим доведением температуры до естественной наблюдается гистерезис модуля упругости.
Электрические и магнитные свойства горных пород.
Электрические свойства горных пород:
Удельное электрическое сопротивление
Диэлектрическая проницаемость
Тангенс угла диэлектрических потерь
Породы обладают электронной и ионной проводимостью, ионная проявляется при повышенных температурах.
В зависимости от энергии активации, породы делятся на:
Проводники (все самородки, металлы и графит)

Полупроводники
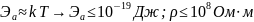
Диэлектрики
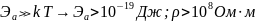
По магнитным свойствам породы относят к:
парамагнетикам и диамагнетикам у которых магнитная проницаемость равна 1. У них малая проницаемость независящая от температуры.
Ферромагнетикам, магнитная проницаемость которых больше (магнетит).
Антиферромагнетики, магнитная проницаемость которых равна 1, но при определенной температуре будет аномальный скачек магнитной восприимчивости.
