
- •Раздел1.
- •1.1 Характеристика углеводов организма.
- •1. 2 Значение и биологическая роль углеводов организма
- •1. 3 Углеводы пищи, нормы и принципы нормирования их суточной пищевой
- •1.4. Переваривание углеводов
- •1.5 Всасывание углеводов
- •1.5 Нарушение переваривания и всасывания углеводов
- •1). Наследственные и приобретенные дефекты ферментов, участвующих в переваривании.
- •1. 6 Углеводы пищи и полость рта
- •1. 6 Усвоение моносахаридов тканями
- •1.7 Взаимные превращения моносахаридов в клетке.
- •Наследственное заболевание галактоземия
- •Раздел 2 Энергетический путь обмена глюкозы
- •2.1 Гликолитический путь окисления глюкозы
- •10.Восстановление пирувата в лактат катализирует лактатдегидрогеназа (лдг).
- •2.2. Регуляция гликолитического пути
- •2.3 Взаимосвязь гликолиза и цикла Кребса.
- •2.3.1 Превращение пвк – АцКоА
- •2.3.2 Эффект Пастера.
- •Глицерофосфатный челночный механизм
- •2.3.4 Малат – аспартатный шунт (челнок)
- •2.3.5 Энергетический баланс окисления Гл-6-ф в аэробном гликолизе
- •2.3.6 Анаплеротическая (обходная, возмещающающая) реакция превращения пвк в щук
- •2.3.7 Механизмы взаимосвязи аэробного гликолиза и окислительного фосфорилирования
- •III. Пластические пути обмена гл-6-ф
- •3.1 Пентозофосфатный цикл (шунт) (пфц)
- •3.2. Синтез аминосахаров
- •3.3. Синтез удф-глюкуроновой кислоты
- •3.4 Обмен моносахаридов в тканях полости рта (биохимия полости рта)
- •IV Регуляция углеводного обмена
- •4.1 Гипогликемия.
- •4.2 Гипергликемия
- •Инсулин
- •4.3 Гомеостаз глюкозы
- •4.4 Синтез и распад гликогена (гликогенолиз)
- •4.5. Инсулин
- •4.5.1 Строение инсулина
- •Биосинтез инсулина
- •Регуляция синтеза и секреции инсулина
- •Биологические функции инсулина
- •4.5.5 Действие инсулина на метаболизм.
- •4.6. Контринсулярные гормоны глюкагон, катехоламины, кортизол
- •4.6.1. Глюкагон
- •Глюкагон секреция инсулина
- •4.6.2. Адреналин
- •4.6.3 Глюкокортикоиды (кортизол)
- •V. Патология углеводного обмена
- •5.1 Диабет
- •5.1.2 Инсулинонезависимый сахарный диабет (инзсд):
- •5.2. Фруктозурия
- •5.3 Галактоземия
- •5.4 Гликогеновые болезни
- •VI. Лабораторная диагностика показателей углеводного обмена.
- •VII. Вопросы для самоконтроля по теме: ”обмен УглеводОв в организме человека”
Раздел 2 Энергетический путь обмена глюкозы
В клетках организма человека присутствуют два пути обмена глюкозы, связанные с энергетическим обменом:
- анаэробный (бескислородный) – более древний
- аэробный (с участием кислорода).
Для большинства тканей основным путем катаболизма глюкозы является ее аэробный распад
(цикл Кребса, тканевое дыхание) до углекислого газа и воды. При окислении 1 моль глюкозы (180 г) в аэробных условиях выделяется 686 ккал свободной энергии.
-
Анаэробный и эробный пути имеют общие реакции.
Процесс аэробного распада глюкозы можно разделить на 3 этапа:
1. Превращение глюкозы до пирувата – анаэробный гликолиз.
2. Окислительное декарбоксилирование пирувата до ацетил-КоА.
3. Окисление АцКоА в цикле Кребса (ЦТК), процесс сопряжен с работой редокс - цепи окислительного фосфорилирования.
 Гл-6-Ф —> ПВК —> ( АцКоА + СО2
) —> ( НАДН
+ ФАДН2
+ ГТФ ) —> АТФ
+ Н2О
Гл-6-Ф —> ПВК —> ( АцКоА + СО2
) —> ( НАДН
+ ФАДН2
+ ГТФ ) —> АТФ
+ Н2О
анаэробный окислительное окисление в цикле окислительное
гликолиз декарбоксилирование Кребса фосфорилирование
2.1 Гликолитический путь окисления глюкозы
Гликолиз (от греч. glycys – сладкий и lysis – растворение, распад) - сложный ферментативный процесс последовательных превращений глюкозы, протекающий в цитозоле клеток тканей человека, в результате которого глюкоза распадается на две молекулы пирувата и далее образуются две молекулы лактата (анаэробный гликолиз).
Реакции окисления Гл-6-ф до пирувата характерны для клеток всех тканей и органов |
Анаэробное превращение Гл-6-ф в лактат характерно для типичных анаэробных клеток: эритроцитов, белых быстрых мышц, водителя сердца. |
В гликолизе можно выделить два основных этапа:
первый этап подготовительный - от глюкозы до 3 - глицеральдегидфосфата (3 -ФГА)
второй этап оксидоредукции – от 3-глицеральдегидфосфата до пирувата (аэробный гликолиз) или до лактата (анаэробный гликолиз).
В реакциях первого этапа происходит затрата АТФ, фосфорилирование гексоз и превращение их в триозы (реакции 1-5). Второй этап начинается с окисления 3-ФГА и включает в себя реакции, сопровождающиеся синтезом АТФ путем субстратного фосфорилирования.
Особенности реакций гликолиза:
все метаболиты реагируют в виде фосфорных эфиров,
большинство реакций обратимо, за исключением трех реакций (1, 3, 10),
источником фосфатной группы в реакциях фосфорилирования субстратов является макроэргическое соединение АТФ (реакции 1, 3) и неорганический фосфат (реакция 6),
регенерация НАД+, являющаяся необходимым условием протекания анаэробного гликолиза, происходит путем восстановления пирувата в лактат.
Пируват – единственный окислитель НАДН в анаэробных условиях гликолиза.
В случае аэробного пути НАДН окисляется в электронтранспортной цепи на внутренней мембране митохондрий (редокс-цепи окислительного фосфорилирования). Водород транспортируется в митохондрии с помощью челночных механизмов при участии переносчиков, потому что наружная мембрана митохондрий непроницаема для протонов.
Образование АТФ в реакциях гликолиза может идти двумя путями:
в анаэробных условиях посредством субстратного фосфорилирования, когда для синтеза АТФ используется энергия макроэргической связи субстратов (реакции 7, 9),
- в аэробных условиях путем окислительного фосфорилирования АДФ, при окислении НАДН в дыхательной цепи при сопряжении дыхания и фосфорилирования.
NB! Студенты часто путают название и смысл двух различных процессов: фосфорилирование субстрата и субстратное фосфорилирование.
Последовательность превращения субстратов в реакциях гликолиза представлена схемой, на которой указаны обратимые и необратимые реакции:
Гл—(1)−> Гл-6ф <− (2)—> фруктозо-6-ф −(3)—> фруктозо-1,6-диф <− (4 )—>
2[3-Фосфоглицеральдегид <− (5) —> 1,3-дифосфоглицерат<— (6) −> 3-фосфоглицерат
<− (7) —> 2-фосфоглицерат <− (8) —> ФЕП (фосфоенолпируват) — (9) −>
ПВК (пируват) <− (10) —> лактат] (молочная кислота) (в анаэробных условиях)
↓
2 АцКоА (в аэробных условиях)
Биохимические реакции гликолиза по стадиям (1- 11).
Номенклатура, характеристика ферментов.
1. Фосфорилирование глюкозы - необратимая реакция.
Гексокиназа (Мg +2)
Г л + АТФ ———> Гл-6-Ф + АДФ.
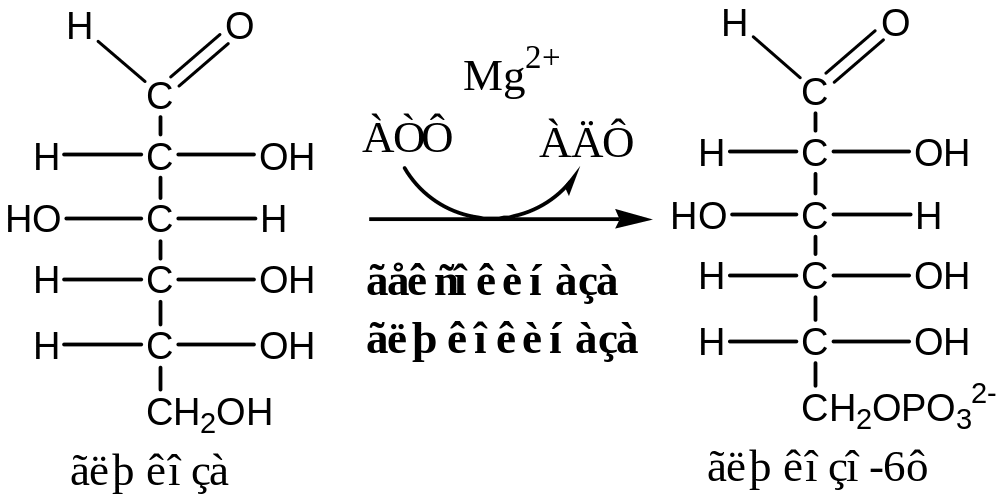
Гексокиназа (АТФ: гексозо-6-фосфотрансфераза) в мышцах фосфорилирует, в основном, глюкозу, меньше – фруктозу и галактозу. Гексокиназа мышц и адипоцитов активируется инсулином, гексокиназа эритроцитов, нейронов и тканей глаза инсулиннезависимая.
Мышечная ГК (Кm < 0,1 ммоль/л) содержит катион магния, имеет свои особенности: ингибируется высокой концентрацией глюкозо-6-ф и АТФ в клетке, чтобы избежать избытка
гл-6-ф в клетке.
В печени глюкозу фосфорилирует другой изофермент глюкокиназа (АТФ: глюкозо-6-фосфотрансфераза), которая имеет значительно меньшее сродство к глюкозе. (Кm - 10 ммоль/л), и активна при высоких концентрациях глюкозы в крови, она не ингибируется при повышении концентрации глюкозо-6-ф в гепатоцитах, и это позволяет превращать избыток Гл-6-ф в гликоген
2. Фосфогексозоизомераза (глюкозо - 6ф – фруктозо - 6ф - изомераза) осуществляет изомеризацию гексоз.

3. Фосфофруктокиназа (АТФ: фруктозо - 6ф - 1- фосфотрансфераза) осуществляет фосфорилирование фруктозы – 6 - ф. Это важная реакция: самая медленная и необратимая, определяет скорость всего гликолиза, кофактором является ион магния. Инсулин способствует увеличению скорости этой реакции.
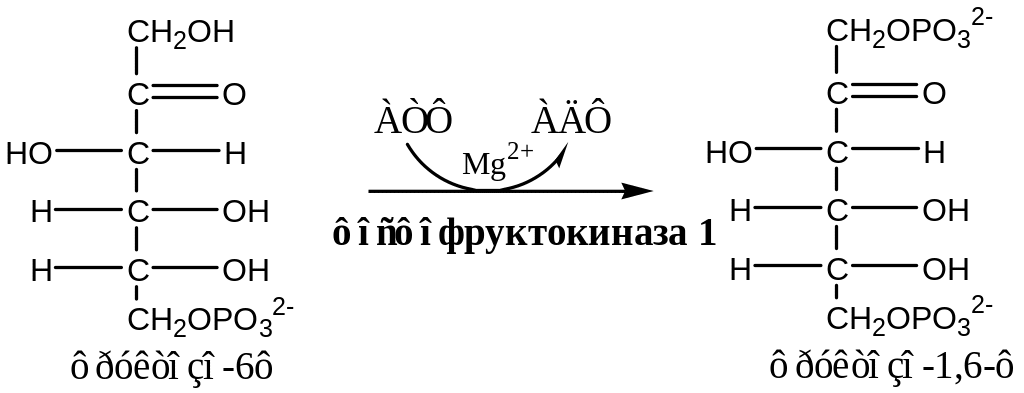
Активируется субстратами: АМФ, фруктозо-2,6-диф (мощный активатор, образуется с участием фосфофруктокиназы- 2 из фр - 6ф). Ингибируется: АТФ, НАДН, лимонной кислотой, жирными кислотами и кетоновыми телами, которые тоже участвуют в энергетическом обмене, но в аэробных условиях.Ингибирование АТф снижает скорость гликолиза, т.к. клетка обеспечена запасом макроэргических соединений. Остальные субстраты принадлежат циклу Кребса, и они снижают скорость гликолиза, поскольку реакции цикла Креса способствуют увеличении энергопродукции.
4. Альдолаза (фруктозо - 1,6 - дифосфатлиаза). Альдолазы состоят из 4 субъединиц, кофермент витамин В1 в активной форме (тиаминпирофосфат), образуют несколько изоформ,. В большинстве тканей содержится альдолаза А, в печени и почках – альдолаза В. Есть сведения, что альдолаза активируется тестостероном, и у мужчин поэтому активнее по сравнению с женщинами.
Из фр - 1,6 - диф образуются две триозы: 3-фосфоглицериновый альдегид (3 - ФГА) и диоксиацетонфосфат (ДАФ).
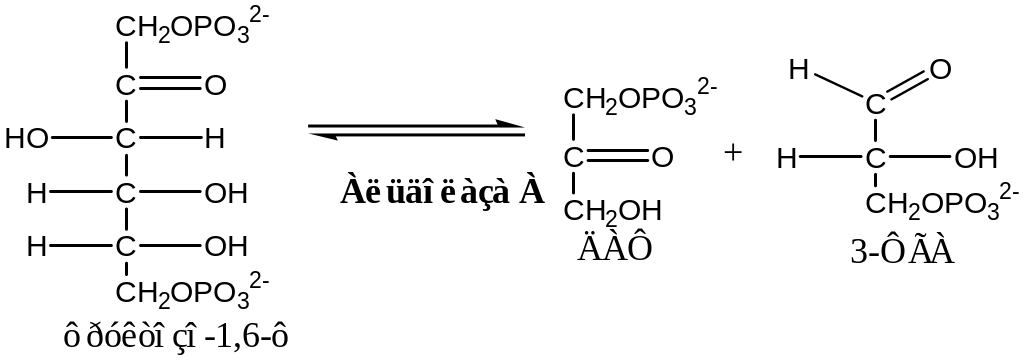
ДАФ превращается в 3 - ФГА фосфатриозоизомеразой (ДАФ – ФГА - изомераза)

Поскольку на каждую молекулу глюкозы, участвующую в гликолизе, образуются две молекулы триоз, то далее в каждом уравнении реакции поставлен коэффициент 2.
5. 3 - фосфоглицеральдегиддегидрогеназа (3 - ФГА: НАД+ оксидоредуктаза (фосфорилирующая)) состоит из 4 субъединиц. Катализирует окисление 3 - ФГА, образование макроэргической связи в 1,3-дифосфоглицериновой кислоте (1,3 - диФГК) и восстановление НАД+ в НАДН, который используется в аэробных условиях для синтеза АТФ, а в анаэробных условиях – осуществляет восстановление пирувата в лактат с участием лактатдегидрогеназы (ЛДГ). В активном центре фермента находятся HS-группы, образуется промежуточный тиополуацеталь, который способен к окислению. Далее с участием фосфорной кислоты образуется макроэргическая связь

Содержит макроэргическую
связь в 1-положении
6. 1,3 - Дифосфоглицераткиназа (АТФ: 3ФГК - 1- фосфотрансфераза).
Осуществляет в обратимой реакции субстратное фосфорилирование АДФ с образованием АТФ.

На 5, 6 этапах гликолиза реакции ингибируются мышьяковым ангидридом. Поэтому его длительное время применяли в стоматологии при депульпировании. Соединения мышьяка высокотоксичны, препятствуют образованию макроэргических субстратов, синтезу АТФ и использованию его в метаболических процессах. |
7. Фосфоглицератмутаза (3 – ФГК - 2-ФГК - изомераза) осуществляет перенос фосфатного остатка в 1,3 - диФГК из положения 3 положение 2.

8. Енолаза (2 - ФГК: гидролиаза) - элиминирует (отщепляет) от 2 - ФГК молекулу воды и образует высокоэнергетическую связь у второго атома углерода в фосфоенолпирувате (ФЕП) Ингибируется ионами фторида F-.
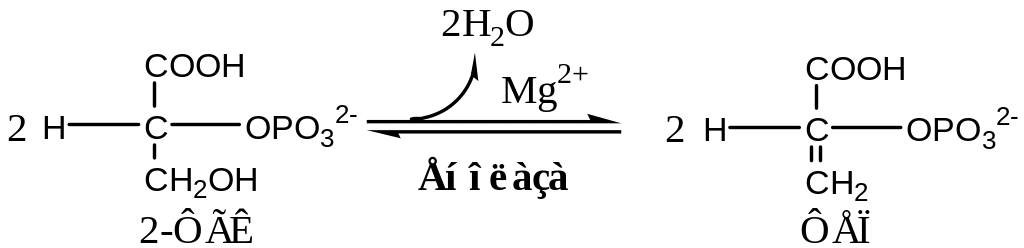
Избыток иона фторида в слюне, привнесенный с водой или профилактическими и лечебными лекарственными препаратам (фторлак, зубные пасты) ингибирует процессы энергообмена у микроорганизмов, но может быть нежелательным для протекания энергообмена в мягких тканях полости рта, тканях зуба.
|
9. Пируваткиназа (АТФ: ПВК – 2 - фосфотрансфераза)
Осуществляет субстратное фосфорилирование АДФ с образованием АТФ. Реакция необратима из-за большой разницы в энергиях макроэргических связей ФЕП и АТФ (название ферменту дано по обратной реакции, хотя она невозможна). Величины энергии макроэргических связей приведены в разделе «Биологическое окисление в организме человека».
Индукторы реакции: инсулин, фруктоза. Фермент активируется фруктозо-1,6-диф.
Ингибируется АТФ, НАДН, Ацетил-КоА, аланином, жирными кислотами, гормонами глюкагоном, адреналином (вновь, все субстраты свидетельствуют о протекании цикла Кребса).

Пируваткиназа (М 240 000) состоит из четырех идентичных субъединиц. Для действия этого фермента абсолютно необходим Mg2+; активность фермента подавляется Са2+ и функционирует только в присутствии довольно высоких концентраций К+.
Пируваткиназа является следующим после фосфофруктокиназы ферментом гликолиза, действие которого подчинено строгому регуляторному контролю. |
Образующаяся в реакции енольная форма ПВК затем неферментативно переходит в более термодинамически стабильную кетоформу. Данная реакция является последней для анаэробного гликолиза.
Дальнейший катаболизм 2 молекул ПВК и использование 2 восстановленных НАДН2 зависит от наличия кислорода.
В анаэробных условиях происходит восстановление пирувата в лактат цитозольным НАДН+ Н+.
В аэробных условиях ПВК и атомы водороды с НАДН+ Н+ транспортируются в матрикс митохондрий.
