
Завдання 3.
«Розрахунок константи хімічної рівноваги і рівноважного складу газової фази»
Для
заданого варіанту розрахувати
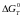 (наближеним ентропійним методом),
константу рівноваги і рівноважний склад
газової фази (в % об.) Зробити висновок
про відновлюваність заданого оксиду
газовою сумішшю СО-СО2
(Н2
– Н2О).
Обрати склад відновної газової суміші.
(наближеним ентропійним методом),
константу рівноваги і рівноважний склад
газової фази (в % об.) Зробити висновок
про відновлюваність заданого оксиду
газовою сумішшю СО-СО2
(Н2
– Н2О).
Обрати склад відновної газової суміші.
Рішення
Для визначення часто використовують ентропійний метод, заснований на вирішенні рівняння Гибса-Гельмгольца:
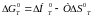 (1)
(1)
Для
цього потрібно окремо знайти значення
 і
і
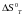 .
Сутність
наближеного методу
полягає
в
тому,
що
приймають
незалежність
величин
.
Сутність
наближеного методу
полягає
в
тому,
що
приймають
незалежність
величин
 і
і
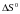 від
температури,
і
для будь-яких
високих
температур вважають
їх
значення
такими,
що дорівнюють значенням
від
температури,
і
для будь-яких
високих
температур вважають
їх
значення
такими,
що дорівнюють значенням
 і
і
 .
Таким
чином, рівняння набуває вигляду:
.
Таким
чином, рівняння набуває вигляду:
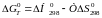 (2)
(2)
Використовуючи
стандартні табличні
значення
 і
і
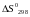 індивідуальних
речовин,
що
приймають участь в реакції, знаходять
індивідуальних
речовин,
що
приймають участь в реакції, знаходять
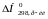 і
і
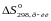 .
.
Для розрахунку константи рівноваги реакції скористаємось рівнянням ізотерми хімічної реакції:
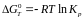 звідки:
звідки:
 ,
де R=8,3192
(Дж/моль.К)
,
де R=8,3192
(Дж/моль.К)
ПРИКЛАД. Розглянемо метод вирішення завдання на прикладі реакції:
NiO + CO = Ni + CO2 Т=1200 К
Термодинамічні властивості речовин наведено в таблиці 1.
Розрахуємо стандартний тепловий ефект реакції:
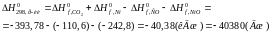
Таблиця 1 – Термодинамічні властивості речовин
-
Вещество
Фаза


Ni
тв.
-
29,88
CO2
газ
393,78
213,78
CO
газ
110,60
198,04
NiO
тв
242,8
38,6
Розрахуємо :
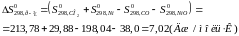
Отримані дані підставимо в рівняння (2):
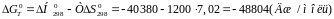
Розрахуємо константу рівноваги реакції:
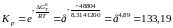
Знайдемо рівноважний склад газової фази:
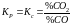
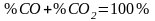
звідки:
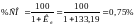 ;
;
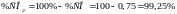 .
.
Результати розрахунку показують, що рівновагу реакції зміщено праворуч – концентрацця вихідних речовин в системі мінімальна, а продуктів реакції – досить висока.
Для вибору складу відновлювальної газової суміші керуємося простим правилом: відновлювальна суміш для відповідного оксиду повинна вміщувати більш високу долю газа-відновника (в нашому випадку - СО), ніж та, що відповідає рівноважному складу при заданій температурі. Тому обираємо газову суміш зі вмістом СО = 25 % і СО2 = 75 %.
Завдання 4. «Термодинаміка процесів утворення –дисоціації оксидів»
Визначити нормальну
хімічну спорідненість металу до кисню
при утворенні відповідного оксиду для
298, 1000, 1500 та
1900 К. Розрахунок
провести за
емпірічним рівнянням
 .
Побудувати графік залежності
.
Побудувати графік залежності
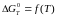 .
Визначити температуру початку дисоціації
оксиду в атмосфері повітря і зробити
висновок про термодинамічну міцність
оксиду.
.
Визначити температуру початку дисоціації
оксиду в атмосфері повітря і зробити
висновок про термодинамічну міцність
оксиду.
Рішення
Розглянемо методику вирішення задачі на прикладі реакції
Si + O2 = SiO2(кристобаліт) Т = 298, 1000, 1250, 1500 К.
Хімічну спорідненість
металу до кисню і міцність утвореного
оксиду оцінюють по величині змінювання
енергії Гибса
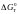 реакції утворення відповідного оксиду.
реакції утворення відповідного оксиду.
Залежність від температури для реакції з достатньою точністю можна виразити формулою:
Коефіцієнти M
і N
для різних реакцій наведені в довідниках.
Ці коефіцієнти визначаються на основі
узагальнення експерментальних данних
про рівноваги різноманітних реакцій.
Величини М і N
близьки до середніх значень теплових
ефектів (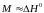 )
і змінення ентропії (
)
і змінення ентропії ( )
для відповідних реакцій.
)
для відповідних реакцій.
З довідкових таблиць емпірічне рівняння для кристобаліту має вигляд:
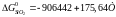
Це рівняння дійсне в температурному інтервалі 298-1685 К.
Підставимо до рівняння значення температури та обчислимо значення хімічної спорідненості для різних температур:
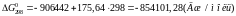
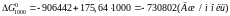
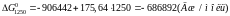
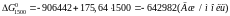
Розрахунки показують, що зі збільшенням температури хімічна спорідненість кремнію до кисню зменшується. За результатами розрахунків побудуємо графік залежності .
Для визначення температури початку дисоціації оксиду в атмосфері повітря необхідно використати емпірічне рівняння такого виду:
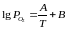 ,
,
де А, В – коефіцієнти, що залежать від природи речовин-учасників реакції.
Ці коефіцієнти можна вирахувати зі співвідношень:
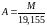
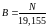
Процес
дисиоціації хімічних сполук (в т.ч.
оксидів) стає можливим за умов, що
значення пружності дисоціації оксиду
(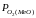 )
буде
більшим ніж парціальний тиск кисню в
навколишньому середовищі (
)
буде
більшим ніж парціальний тиск кисню в
навколишньому середовищі (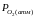 ):
):
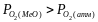
Тому
для вирішення питання про температуру
початку дисоціації оксиду в атмосфері
повітря слід підставити в рівняння
значення
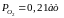 ,
що відповідає парциальному тиску кисню
в атмосфері, і вирахувати температу,
при якій досягається вказаний тиск.
,
що відповідає парциальному тиску кисню
в атмосфері, і вирахувати температу,
при якій досягається вказаний тиск.
Таким чином, остаточне вирішення буде таким:

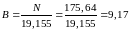
Рівняння
для SiO2
набуває
вигляду:
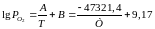
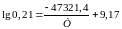 Звідки
Т= 4804 К.
Звідки
Т= 4804 К.
Як показують результати розрахунку, оксид кремнію SiO2 є міцним оксидом, про що свідчать негативні значення (висока спорідненість до кисню) в усьому інтервалі температур і висока температура початку дисоціації оксиду.
Завдання 5. «Розрахунок константи рівноваги реакцій відновлення окисдів металів газами»
Розрахувати (наближеним ентропійним методом) і константу рівноваги реакції непрямого відновлення заданого оксиду для 298, 600, 1000 та 1500 К. Построїти графік залежності КР=f(T) або lgКР=f(T). Зробити висновок про вплив температури на рівновагу реакції і можливість відновлення заданого оксиду газовою сумішшю СО-СО2 (Н2 – Н2О).
