
- •261001.65 - Технология художественной обработки материалов.
- •Информация о тесте
- •Структура теста
- •1. Строение атома и периодическая система
- •2. Химическая связь и строение вещества
- •3. Классы неорганических соединений
- •4. Способы выражения состава растворов
- •6. Окислительно-восстановительные реакции
- •7. Теоретические основы аналитической химии
- •8. Качественный анализ
- •9. Количественный химический анализ
- •10. Физико-химические и физические методы анализа
- •11. Органические и неорганические полимеры
- •12. Методы получения полимеров
- •13. Строение и свойства полимеров
- •14. Биополимеры
- •15. Основы химической термодинамики
- •16. Химическая кинетика и катализ
- •17. Химическое равновесие
- •18. Общие свойства растворов
- •19. Электрохимические процессы. Гальванический элемент. Коррозия металлов
- •20. Электрохимические процессы. Электролиз
- •21. Поверхностные явления и адсорбция
- •22. Дисперсные и коллоидные системы, их классификация, строение и свойства
- •Дe n2. Общая и неорганическая химия
- •5. Способы выражения состава
- •6. Строение атома и периодическая система
- •7. Химическая связь и строение вещества
- •8. Равновесия в растворах электролитов
- •9. Классы неорганических соединений
- •10. Окислительно-восстановительные реакции
- •Дe n3. Коллоидная химия
- •11. Свойства и применение коллоидных растворов
- •12. Коллоидные растворы
- •13. Дисперсные системы
- •14. Поверхностные явления и адсорбция
- •Дe n5. Физическая химия
- •19. Электрохимические процессы. Гальванический элемент.
- •20. Основы химической термодинамики
- •21. Химическая кинетика и катализ
- •22. Химическое равновесие
- •23. Электрохимические процессы. Электролиз
- •24. Общие свойства растворов
- •Органическая химия
- •15. Теория строения органических соединений
- •16. Углеводороды
- •17. Карбоновые кислоты и их производные
- •17. Карбоновые кислоты и их производные
- •18. Спирты, фенолы и карбонильные соединения
- •Биополимеры
- •Строение и свойства полимеров
- •Органические и неорганические полимеры
- •Методы получения полимеров
Дe n5. Физическая химия
19. Электрохимические процессы. Гальванический элемент.
Коррозия металлов
19.1. При
нарушении серебряного покрытия на
никелевом изделии в кислой среде на
катоде будет протекать реакция, уравнение
которой имеет вид …
Ag0
- e
= Ag+;
Ni0
- 2e
= Ni2+;
Ni2+
+ 2e
= Ni0;
2H+
+ 2e
=
![]()
19.2. При нарушении никелевого покрытия на медном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид … Ni2+ + 2e = Ni0; Ni0 - 2e = Ni2+; Cu0 - 2e = Cu2+; 2H+ + 2e = .
19.2. Для защиты медных изделий от коррозии в качестве катодного покрытия можно использовать … Zn; Sn; Au; Ni.
19.3. При работе гальванического элемента, состоящего из кадмиевого и нике-левого электродов, погруженных в 0.02 М растворы их сульфатов, на катоде протекает реакция, уравнение которой имеет вид … Cd0 - 2e = Cd2+; Ni0 - 2e = Ni2+; Cd2+ + 2e = Cd0; Ni2+ + 2e = Ni0.
19.4. При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид … 2H+ + 2e = ; Fe0 - 2e = Fe2+; Sn0 - 2e = Sn2+; Fe2+ + 2e = Fe0.
19.5. При добавлении щелочи в раствор, содержащий ионы серебра
Zn0|Zn2+ ||Ag+|Ag0, значение ЭДС гальванического элемента … Увеличится; Не изменится; уменьшится; станет равным нулю.
19.6. При добавлении щелочи в раствор, содержащий ионы железа (II), значение ЭДС гальванического элемента Fe0|Fe2+ || Ni2+|Ni0 … Станет равным нулю; увеличится; не изменится; уменьшится.
19.7. Значение ЭДС гальванического элемента, состоящего из медного и марганцевого электродов при стандартных условиях, равно ___ В
![]() .
.
0.84; 1.52; -0.84; -1.52
19.8. Значение ЭДС гальванического элемента, состоящего из ртутного и кадми-евого электродов, погруженных в 0.2 М растворы их нитратов, равно ___ В
![]() .
.
-0.39; -1.19; 1.19; 0.39.
19.9. Значение
ЭДС гальванического элемента, состоящего
из цинкового и ни-келевого электродов,
погруженных в 0.1 М растворы их нитратов,
равно ___ В
![]() .
0.51;
-0.51; 1.01; -1.01.
.
0.51;
-0.51; 1.01; -1.01.
19.10. Значение ЭДС гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в 0.2 М растворы их нитратов, можно увеличить, если … Увеличить концентрацию нитрата цинка; увеличить концентрацию нитрата серебра; уменьшить концентрацию нитрата серебра; увеличить давление в системе.
20. Основы химической термодинамики
20.1. Согласно второму началу термодинамики, состояние равновесия реализу- ется в изолированных системах, для которых справедливо выражение … S = 0; S < 0; S > 0; H = 0.
20.2. Если
для реакции 2SO2(г)
+ O2(г)
= 2SO3(г)
![]() = -198 кДж и
= -198 кДж и
![]() = -188 Дж/K, то
температура, при которой возможно ее
протекание в пря-мом и обратном
направлении, равна ____0С
(зависимостью термодинами-ческих функций
от температуры пренебречь).
780; 1326; 1053; 1560.
= -188 Дж/K, то
температура, при которой возможно ее
протекание в пря-мом и обратном
направлении, равна ____0С
(зависимостью термодинами-ческих функций
от температуры пренебречь).
780; 1326; 1053; 1560.
20.3. Если для реакции CO(г) + 2H2(г) = CH3OH(г); = -128.2 кДж и = -332.1 Дж/K, то температура, при которой возможно ее протека-ние в прямом и обратном направлениях, равна ____ 0C (зависимостью термодинамических функций от температуры пренебречь). 772; 386; 226; 113.
20.4. Формула для расчета теплового эффекта химической реакции
Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(г)
имеет вид …
![]()
![]()
![]()
![]()
Исходя из уравнения реакции 2NH3(г) = N2(g) + 3H2(g),
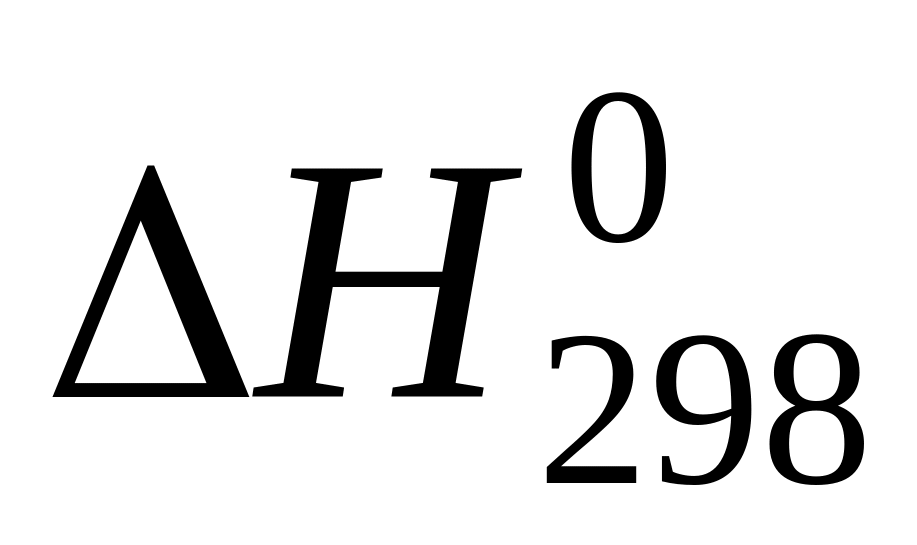 = 92.4 кДж, Стандартная энтальпия
образования аммиака равна _______ кДж/моль
= 92.4 кДж, Стандартная энтальпия
образования аммиака равна _______ кДж/моль
92.4; 46.2; -46.2; -23.1
Согласно термохимическому уравнению
CH4(g)
+ 2O2(g)
= CO2(g)
+ 2H2O(g);
![]() = -802.3 кДж,
= -802.3 кДж,
объем метана (н.у.), который необходим для получения 5000 кДж теплоты, составляет ____ л. 209.4; 279.2; 69.8; 139.6.
20.6. Согласно термохимическому уравнению
C3H8(г) + 5O2(г) = 3CO2(г) + 4H2O(г); rH0 = -2043.9 кДж, объем пропана (н.у.), который необходим для получения 10000 кДж теплоты, составляет ____ л. 54.8; 219.2; 164.4; 109.6.
20.7. Согласно второму началу термодинамики, в изобарно-изотермических системах самопроизвольно протекают процессы, для которых справедливо выражение … S > 0; H < 0; G < 0; G > 0.
20.8. Из первого начала термодинамики следует, что в любой изолированной системе запас внутренней энергии ______ .
Увеличивается; совершает колебательные изменения;
уменьшается; остается постоянным.
20.9. Согласно основным положениям термодинамики, для состояния равнове-сия в изобарно-изотермических системах справедливо выражение … S = 0; G < 0; H < 0; G = 0.
20.10. Энтальпия образования CaCO3 соответствует тепловому эффекту реакции …
Ca + CO2 + 1/2O2 = CaCO3; Ca + C + 3/2O2 = CaCO3;
CaO + CO2 = CaCO3; CaO + C + O2 = CaCO3.
Энтальпия образования BaSO4 соответствует тепловому эффекту реакции …
BaO + SO3 = BaSO4; Ba + S + 2O2 = BaSO4;
Ba + SO2 + 1/2O2 = BaSO4; BaO + S + 3/2O2 = BaSO4.
20.11. Процесс, протекающий при постоянном значении количества теплоты в системе, называется … Изотермическим; изохорическим; изобарическим; адиабатическим.
