
- •Общие представления о химическом превращении
- •Зависимость экстенсивных свойств системы от глубины химической реакции
- •3. Расчет стандартной мольной энергии Гиббса реакции, стандартной мольной энтальпии и стандартной мольной энтропии реакции при температуре 298 к
- •Расчет стандартных мольных изменений свойств системы в ходе химического превращения по справочным данным при любой температуре
- •4.1. Общие сведения
- •4.2. Расчет стандартных мольных изменений экстенсивных свойств системы в ходе химического превращения при любой температуре
- •4.2.3. Расчет температурной зависимости стандартной мольной
- •4.2.5.1. Расчёт состава равновесной системы при температуре 900 к и давлении 1 атм. При стехиометрическом начальном составе и отсутствии продуктов реакции в начальный момент в системе
- •Заключение
- •Используемая литература
4.2. Расчет стандартных мольных изменений экстенсивных свойств системы в ходе химического превращения при любой температуре
Рассмотрим, как можно рассчитать стандартное мольное изменение некоторых экстенсивных свойств в ходе химического превращения на примере приведенной выше газовой реакции.
4.2.1 Расчет величины стандартной мольной изобарной теплоемкости
реакции
Составляем таблицу необходимых для расчета данных.
Таблица 3
Вещество k |
Стехиометрический коэффициент νk |
|
|||
|
|
|
|
||
H2O(г) |
-2 |
30 |
10,71 |
- |
0,33 |
Cl2 |
-2 |
36,69 |
1,05 |
- |
-2,52 |
HCl(г) |
4 |
26,53 |
4,6 |
- |
1,09 |
O2 |
1 |
31,46 |
3,39 |
- |
-3,77 |
Проводим вычисления:
Температурную зависимость экстенсивных свойств в ходе реакции мы можем определять в диапазоне 298-1500 К
![]()
![]()
![]()
![]()
![]()
Мольная изобарная теплоемкость реакции при любой температуре может быть найдена по уравнению:
![]() (48)
(48)
![]() (49)
(49)
![]()
4.2.2. Расчет стандартной мольной энтальпии реакции
Привлекая числовые
значения коэффициентов степенного ряда
(49) и ранее рассчитанное значение
![]() =
114420 Дж/моль
в уравнение (37), получим:
=
114420 Дж/моль
в уравнение (37), получим:
![]() (50)
(50)
Проведя преобразования, получим температурную зависимость стандартной мольной энтальпии данной химической реакции:
![]() (51)
(51)
По уравнению (51) рассчитываем значения теплового эффекта реакции при разных температурах (данные в таблице 4) и зависимость теплового эффекта от температуры графически (рис.1).
Пример расчёта
![]() при температуре 900 К:
при температуре 900 К:
![]()
Анализ рис.1 показывает, что с увеличением температуры в интервале 700 -1200 К величина стандартной мольной энтальпии реакции увеличивается, кривая идет вверх в сторону увеличения теплового эффекта. Если к какой-либо точке кривой (например, при температуре 950 К) провести касательную, то можно графически определить величину стандартной мольной изобарной теплоемкости реакции при этой температуре. Действительно, угловой коэффициент касательной к данной кривой будет равен
![]() (52)
(52)
По определению такая частная производная соответствует мольной изобарной теплоемкости, то есть
![]() (53)
(53)
Для определения углового коэффициента касательной, надо воспользоваться формулой:
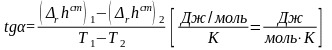 (54)
(54)![]()
![]() rCP(950)
= 3,11 Дж/(моль·К)
rCP(950)
= 3,11 Дж/(моль·К)
Как видно из расчётов, мольная изобарная теплоёмкость, полученная графическим методом и рассчитанная по формуле (35), почти численно не различаются.
Положительная величина стандартной мольной энтальпии реакции на всем исследованном диапазоне температур свидетельствует о том, что с повышением температуры константа равновесия данной реакции должна увеличиваться. Если вспомнить уравнение изобары реакции.
![]() (55)
(55)
то можно сделать вывод, что изобарическое повышение температуры при проведении данной реакции приведет к росту константы равновесия и к смещению равновесия в сторону продуктов реакции. Также можно сделать вывод, что данная реакция эндотермическая.
