
- •Классификация ферментов
- •Кинетика ферментативного катализа.
- •Влиянии концентрации субстрата на скорость реакций, катализируемых ферментами
- •Существует количественная связь между концентрацией субстрата и скоростью ферментативной реакции
- •Многие ферменты катализируют реакции с участием двух субстратов
Кинетика ферментативного катализа.
Ф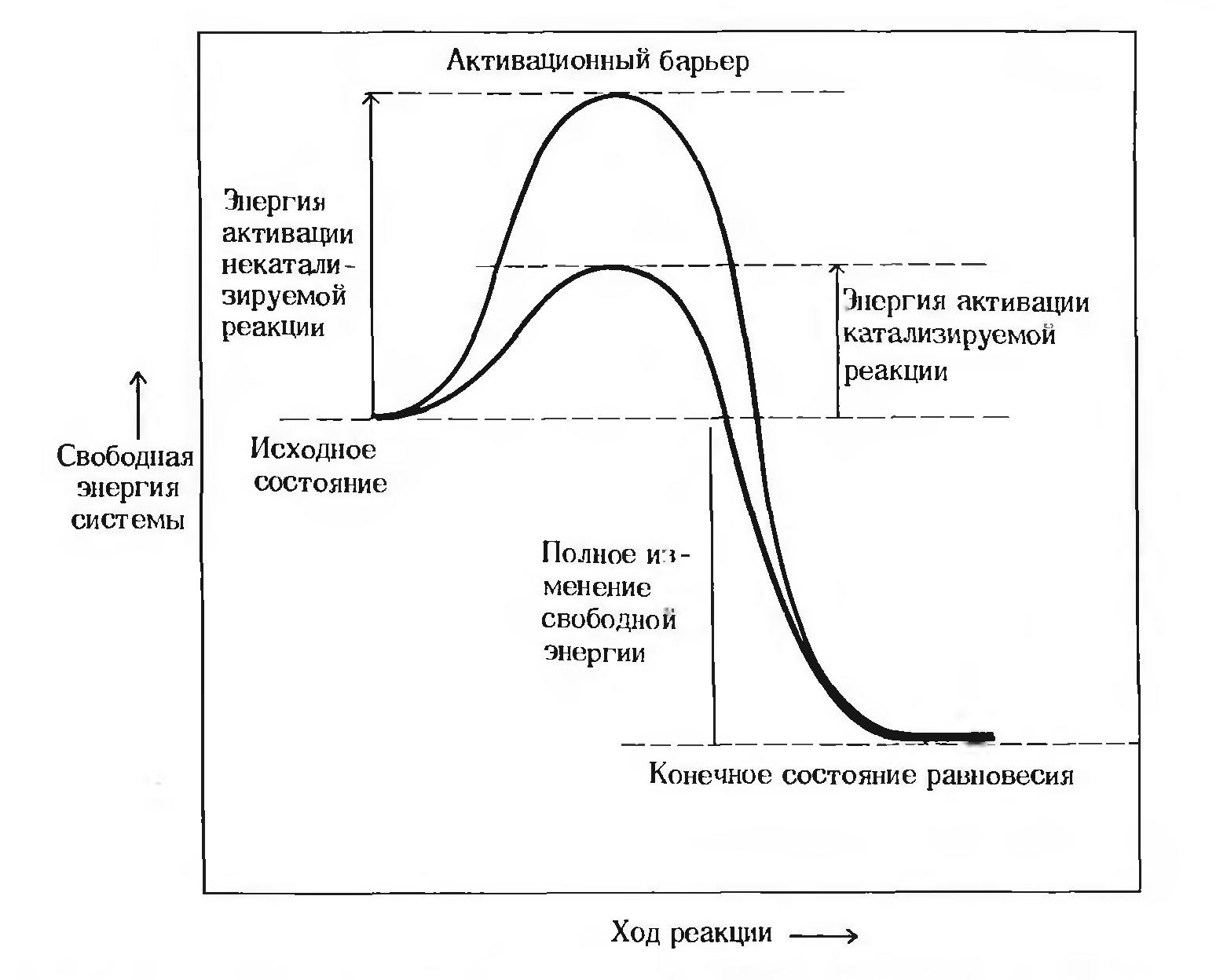
 ерменты-это
истинные катализаторы.
Они значительно повышают скорость
строго определенных химических реакций,
которые
в отсутствие фермента
протекают
очень медленно. Ферменты не могут влиять
на положение равновесия ускоряемых ими
реакций, при этом в ходе реакций они
не расходуются и не претерпевают
необратимых изменений.
ерменты-это
истинные катализаторы.
Они значительно повышают скорость
строго определенных химических реакций,
которые
в отсутствие фермента
протекают
очень медленно. Ферменты не могут влиять
на положение равновесия ускоряемых ими
реакций, при этом в ходе реакций они
не расходуются и не претерпевают
необратимых изменений.
Каким образом катализаторы, в частности ферменты, повышают скорость химических реакций? Прежде всего мы должны вспомнить о том, что в любой популяции молекул индивидуальные молекулы при постоянной температуре сильно различаются по количеству содержащейся в них энергии и что распределение общей энергии между молекулами описывается колоколообразной кривой. Одни молекулы обладают высокой энергией, а другие более низкой, но в большинстве из них содержится количество энергии, близкое к среднему значению. Химическая реакция типа А → Р протекает потому, что в любой момент времени некоторая доля молекул А обладает большей внутренней энергией по сравнению с другими молекулами данной популяции, и этой энергии оказывается достаточно для достижения ими вершины энергетического барьера (рис. 1.) и перехода в активную форму, называемую переходным состоянием. Энергией активации называется количество энергии в калориях, необходимое для того, чтобы все молекулы 1 моля вещества при определенной температуре достигли переходного состояния, соответствующего вершине энергетического (активационного) барьера. В этой точке существует равная вероятность того, что достигшие ее молекулы вступят в реакцию с образованием продукта Р или вернутся обратно на уровень непрореагировавших молекул А (рис. 9-3). Скорость любой химической реакции пропорциональна концентрации молекул, находящихся в переходном состоянии. Следовательно, скорость химической реакции будет очень высокой, если на вершине энергетического барьера находится значительная доля молекул А, и очень низкой, если доля таких молекул невелика.
Существуют два основных пути повышения скорости химической реакции. Первый путь повышение температуры, т.е. ускорение теплового движения молекул, которое приводит к увеличению доли молекул, обладающих достаточной внутренней энергией для достижения переходного состояния. Как правило, повышение температуры на 10°С вызывает ускорение химической реакции приблизительно в два раза.
Второй путь ускорения химической реакции - добавление катализатора. Катализаторы ускоряют химические реакции, находя «обходные пути», позволяющие молекулам преодолевать активационный барьер на более низком энергетическом уровне. Катализатор (обозначим его буквой С) на промежуточной стадии реакции взаимодействует с реагентом А с образованием нового комплекса или соединения СА, переходному состоянию которого соответствует значительно более низкая энергия активации по сравнению с переходным состоянием реагента А в некатализируемой реакции (рис. 9-3).
Затем комплекс реагент-катализатор (СА) распадается на продукт Р и свободный катализатор, который может опять соединиться с другой молекулой А и повторить весь цикл. Именно таким образом катализаторы снижают энергию активации химической реакции; в их присутствии гораздо более значительная доля молекул данной популяции вступает в реакцию в единицу времени. Ферменты, так же как и другие катализаторы, соединяются со своими субстратами в ходе каталитического цикла.
