
- •Классификация ферментов
- •Кинетика ферментативного катализа.
- •Влиянии концентрации субстрата на скорость реакций, катализируемых ферментами
- •Существует количественная связь между концентрацией субстрата и скоростью ферментативной реакции
- •Многие ферменты катализируют реакции с участием двух субстратов
ФЕРМЕНТЫ
Сегодня мы поговорим о самых замечательных и наиболее специализированных белках – ферментах, т.е. белках, обладающих каталитической активностью. Ферменты являются необычайно мощными катализаторами, намного превосходящими по своей эффективности синтетические катализаторы.
Ферменты - это функциональные единицы клеточного метаболизма. Действуя в строго определенной последовательности, они катализируют сотни многостадийных реакций, в ходе которых расщепляются молекулы питательных веществ, запасается и преобразуется химическая энергия и из простых молекул-предшественников строятся макромолекулы, входящие в состав клетки.
Особенности ферментов:
1) высокоспецифичны по отношению к своим субстратам и ускоряют строго определенные химические реакции;
2) химические реакции происходят без образования побочных продуктов;
3) ферменты функционируют в очень мягких условиях (низкая температура, нормальное давление, невысокие значения рН среды), по сравнению с синтетическими катализаторами.
Например, гидролитический распад белков до аминокислот в присутствии неорганических катализаторов (крепких кислот или оснований) осуществляется за несколько десятков часов. Этот же процесс в присутствии биокатализаторов требует всего десятков минут и идет при 30-40˚С.
Благодаря уникальной структуре каждого фермента процесс ферментативного катализа предстоит перед нами как серия элементарных превращений веществ, строжайшим образом организованная в пространстве и времени.
4) Кооперативность и жесткая запрограммированность этапов действия – вот, что отличает механизм биокатализа от действия катализаторов иной природы.
5) Практически все химические преобразования в живом веществе осуществляются с помощью ферментов. Именно поэтому ферменты характеризуют, в первую очередь, как биокатализаторы.
Благодаря контакту ферментов с лекарственными веществами и антибиотиками достигается изменение ферментативных процессов по способствованию излечить болезнь. И, наоборот, деятельности ферментов микробными токсинами и иными ядами ведет к гибели организма.
6) Будучи выделенными из организма ферменты не утратили способности осуществлять каталитическую функцию. На этом основано их практическое применение в химической, пищевой, легкой и фармацевтической промышленности. Они позволяют осуществлять ряд процессов, выполнение которых обычными методами органического синтеза остается все еще нерешенной проблемой. Молекулярные массы ферментов, как и всех остальных белков, лежат в пределах от 12 ООО до 1 ООО ООО, так что их размеры намного превышают размеры их субстратов или функциональных групп, на которые они действуют
Классификация ферментов
Таблица 1. Международная классификация ферментов, основанная на катализируемых ими реакциях. Большинство ферментов катализирует перенос электронов, атомов или функциональных групп. Поэтому при классификации им присваивают кодовые номера и названия, из которых можно определить тип катализируемой ими реакции переноса, а также группы, играющие роль донора и акцептора. Существуют шесть основных классов. |
|
№ Класс |
Тип катализируемой реакции |
1. Оксидоредуктазы 1.1 Действующие на СН2=ОН группу 1.2 Действующие на С=О группу 1.3 Действующие на СН=СН группу |
Перенос электронов
|
2. Трансферазы 2.1 Переносят одноуглеродные остатки 2.2 Переносят альдегидные и кетонные остатки 2.3 Переносят ацильные остатки |
Реакции с переносом групп
|
3. Гидролазы 3.1 Действуют на сложноэфирные связи 3.2 Действуют на гликозильные соединения 3.3 Действуют на пептидные связи |
Реакции гидролиза (перенос функциональных групп на молекулу воды)
|
4. Лиазы 4.1 Углерод-углерод-лиазы 4.2 Углерод-кислород-лиазы 4.3 Углерод-азот-лиазы |
Присоединение групп по двойным связям и обратные реакции
|
5. Изомеразы 5.1 Рацематы |
Перенос групп внутри молекулы с образованием изомерных форм |
6. Лигазы 6.1 Образуют С-О связи 6.2 Образуют С-S связи 6.3 Образуют С-N связи |
Образование С—С- , С—S-, С—О- и С—N-связей за счет реакций конденсации, сопряженных с распадом АТР |
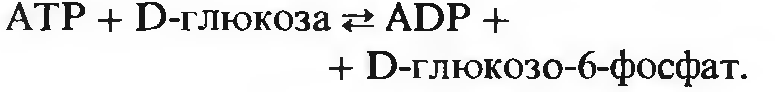
Формальное систематическое название этого фермента - АTP: гексоза 6-фосфо-трансфераза, из которого следует, что этот фермент катализирует перенос фосфатной группы с АТР на гексозу. Согласно табл. 9-3, этот фермент относится к классу 2; ему присвоен кодовый номер 2.7.1.1, где первая цифра (2) обозначает класс (трансферазы), вторая (7)-подкласс (фосфотрансферазы), третья (1)-подподкласс (фосфотрансферазы с гидроксильной группой в качестве акцептора) и четвертая цифра (1)-порядковый номер фермента в его подподклассе; она показывает, что акцептором фосфатной группы служит D-гексоза. В тех случаях, когда фермент имеет длинное или труднопроизносимое систематическое название, можно пользоваться его тривиальным названием. Например, тривиальное название обсуждаемого нами фермента - гексокиназа.
