
- •Генез флогогенного фактора
- •Зона первичной альтерации
- •Зона вторичной альтерации
- •Структурные изменения
- •Изменения обмена веществ
- •Углеводы
- •Ионы и вода
- •Гиперосмия
- •Медиаторы воспаления
- •Нейромедиаторы
- •Пептиды и белки
- •Эффекты
- •Циклооксигеназы
- •Нуклеотиды и нуклеозиды
- •Значение и последствия
- •Причины венозной гиперемии и предстаза
- •Состав и диагностическое значение экссудата
- •Значение экссудации
- •Эмиграция лейкоцитов
- •Направленная миграции лейкоцитов
- •Фагоциты
- •Поглощение объекта и образование фаголизосомы
- •Внутриклеточное «переваривание»
- •Незавершённый фагоцитоз
- •Фагоцитоз и иммунные реакции
- •Пролиферация
- •Регуляция процесса пролиферации
- •Причины хронического воспаления
- •Условия, способствующие хроническому течению воспаления
Структурные изменения
Причины изменения структуры клеток и других гистологических элементов:
• в течение первых минут — прямое действие флогогенного фактора;
• на более поздних этапах и дополнительно к прямому эффекту флогогенного фактора — влияние вторичных причин: метаболических, физикохимических, микроциркуляторных и регуляторных расстройств.
Основные механизмы морфологических изменений:
• нарушения процессов энергетического обеспечения клеток;
• повреждение мембранного аппарата и ферментных систем;
• дисбаланс ионов и воды;
• нарушения местных (клеточных и органнотканевых) механизмов регуляции.
Проявления
• Развивающиеся в тканях изменения весьма разнообразны: от минимальных структурных отклонений до деструкции и некроза.
• Структурные изменения наблюдаются как в паренхиматозных клетках, так и в строме тканей и органов.
• Существенную роль в потенцировании повреждения клеточных и неклеточных структур играют высвобождающиеся из лизосом и активирующиеся в очаге воспаления гидролазы: протеазы, липазы, фосфолипазы, эластазы, коллагеназы и другие ферменты. Источником их являются как клетки самой повреждённой ткани, так и находящиеся в ней лейкоциты, а при септическом воспалении — и микроорганизмы.
• Для клеток при воспалительной альтерации характерны изменения в цитозоле, а также повреждение плазмолеммы и мембран органелл — митохондрий, лизосом, эндоплазматической сети, комплекса Гольджи и других. В связи с этим меняется их форма, размеры, число, а также функции органелл и клетки в целом.
Изменения обмена веществ
В очаге воспаления наблюдаются закономерные фазные изменения метаболизма. Их причины: действие флогогенного фактора и вторичные расстройства в ткани, выражающиеся в перестройке местных механизмов нервной и гуморальной регуляции, микроциркуляции, в формировании физикохимических сдвигов.
На начальном этапе воспаления в ткани (не только зоны первичной, но и вторичной альтерации) преобладают реакции катаболизма, затем — при развитии артериальной гиперемии и активации процессов пролиферации, — как правило, начинают доминировать анаболические реакции.
Биологический «смысл» изменений метаболизма заключается в энергетическом и пластическом обеспечении местных адаптивных реакций в очаге воспаления, направленных на локализацию, уничтожение и элиминацию флогогенного агента, а также на ликвидацию патогенных последствий его воздействия.
Углеводы
В очаге воспаления метаболизм углеводов претерпевает характерные изменения, выражающиеся в преобладании гликолиза и развитии ацидоза.
Причины
• Повреждения мембранного аппарата и митохондриальных ферментов, возникающие под действием как флогогенного агента, так и других факторов, активирующихся или образующихся в ходе воспалительной реакции вторично. К этим последним относятся свободные радикалы и перекисные соединения, вещества с детергентным действием (ВЖК, гидроперекиси липидов), гидролазы лизосом, избыток Н+ и других агентов.
• Избыток Ca2+, оказывающий (наряду с жирными кислотами) существенное разобщающее действие на окислительное фосфорилирование.
• Увеличение в клетках уровня АДФ, АМФ и неорганического фосфата. Это активирует ключевые (лимитирующие) ферменты гликогенолиза и гликолиза. В связи с этим в очаге воспаления начинает возрастать удельный вес гликолитического ресинтеза АТФ.
Проявления
• увеличение поглощения тканью кислорода при одновременном снижении эффективности окисления глюкозы в процессе тканевого дыхания;
• активация гликогенолиза и гликолиза;
• уменьшение уровня АТФ в ткани;
• накопление избытка лактата и пирувата.
Последствия
• Образующаяся при гликолизе АТФ, хотя и в недостаточной мере, но тем не менее может обеспечить поддержание энергозависимых процессов в клетках, особенно транспорта ионов и сокращения мышц, сохранение жизнеспособности и жизнедеятельности гистологических элементов в очаге воспаления.
• Активация гликолиза сопровождается накоплением в клетках и во внеклеточной жидкости избытка промежуточных продуктов этого процесса, в том числе — пировиноградной, молочной и других кислот, что ведёт к формированию метаболического ацидоза.
• На начальном этапе воспаления (когда многие митохондрии сохраняют свою структуру, а их ферменты — кинетическую активность) возобновление нормальной или близкой к ней оксигенации тканей сопровождается быстрым восстановлением эффективности тканевого дыхания, снижением интенсивности гликолиза и нормализацией энергетического обеспечения клеточных процессов.
ЛИПИДЫ
Обмен липидов в очаге воспаления характеризуется доминированием липолиза над реакциями их синтеза.
Причины
• Прямое повреждающее влияние флогогенного агента может привести к ферментативной и неферментативной деструкции мембранных фосфолипидов, ЛП, гликолипидов и других липидсодержащих соединений с высвобождением из них ВЖК, свободных липидов и образованием кетокислот.
• Основной механизм липолиза в очаге воспаления — интенсификация гидролиза липидов и их комплексов с другими веществами в результате повышенного высвобождения липаз и фосфолипаз из повреждённых клеток, а также из лейкоцитов, в большом количестве накапливающихся в очаге воспаления.
Помимо увеличения содержания липаз и фосфолипаз, в очаге воспаления отмечается значительное повышение их активности. Последнее связано с тем, что оптимум каталитической активности большинства липаз и фосфолипаз наблюдается в кислой среде. А в очаге воспаления, как известно, быстро развивается метаболический ацидоз.
• Активация деструкции липидов за счёт интенсификации реакций свободнорадикального перекисного окисления липидов. В очаге воспаления усиление липопероксидных процессов связано со снижением активности антиоксидантных ферментов, увеличением содержания прооксидантных агентов (катехоламинов, гистамина, серотонина; ионов железа, высвобождающихся при разрушении миоглобина, Hb, кининов и других), а также повышением уровня субстратов перекисного окисления липидов, главным образом полиненасыщенных ВЖК: арахидоновой, линоленовой и других. Активация липопероксидации сопровождается образованием и накоплением избытка неметаболизируемых соединений (в частности гидроперекисей липидов), обладающих выраженным разрушающим эффектом в отношении органических соединений.
Проявления
• Активация процессов липолиза и накопление продуктов липолиза
• Торможение реакций синтеза липидов
• Активация перекисного окисления липидов и накопление перекисей и гидроперекисей липидов
Последствия
Последствия изменённого метаболизма липидов в очаге воспаления перечислены на рис. 5–4) и подробнее рассмотрены ниже.

Рис. 5–4. Изменения метаболизма липидов в очаге воспаления.
• Активация лизосомальных, а также мембраносвязанных липаз и фосфолипаз приводит к отщеплению от липидов ВЖК и их накоплению. Последние оказывают в очаге воспаления существенный разобщающий эффект и снижают эффективность тканевого дыхания в митохондриях.
• Детергентное (разрушающее) действие ВЖК на клеточные мембраны сопровождается образованием сквозных каналов в мембранах и нерегулируемым транспортом по ним ионов, молекул органических и неорганических соединений, как в клетку, так и из неё, что завершается, как правило, гибелью клетки.
• Накопление
избытка токсичных кетокислот
(ацетоуксусной, βоксимасляной,
βкетоглутаровой
и других) является результатом нарушения
окисления ВЖК в очаге воспаления. Эти
кетокислоты обусловливают дополнительную
альтерацию в очаге воспаления.
• Повреждение вышеуказанными факторами не только клеток организма, но и самого флогогенного агента, если в его состав входят липиды.
• Использование ВЖК для синтеза фосфолипидов мембран и ресинтеза цитоплазматических липидов. ВЖК при этом остаётся одним из основных энергоёмких субстратов биологического окисления.
• В ходе метаболизма арахидоновой кислоты образуются Пг и лейкотриены, обладающие многими регуляторными эффектами.
БЕЛКИ
Обмен белков характеризуется преобладанием протеолиза над процессами протеосинтеза.
Главные причины
• Прямое патогенное действие флогогенного агента, в том числе ферментативный протеолиз.
• Массированное выделение из повреждённых паренхиматозных и стромальных клеток, а также из лейкоцитов протеолитических ферментов. Их активность значительна, так как каталитический оптимум большинства протеаз находится в кислом диапазоне рН (в очаге воспаления — метаболический ацидоз).
• Активация свободнорадикальных и перекисных реакций, сопровождающихся деструкцией ЛП и высвобождением из них белковых соединений, которые разрушаются и/или денатурируются.
Проявления
• Активация процессов протеолиза и накопление продуктов протеолиза.
• Торможение реакций протеосинтеза.
• Денатурация молекул белка (образование аутоантигенов).
Последствия
В очаге воспаления вследствие интенсификации реакций протеолиза и денатурации белков развиваются следующие процессы (рис. 5–5).
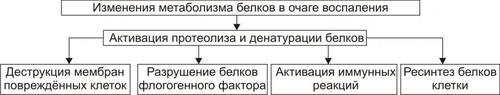
Рис. 5–5. Изменения метаболизма белков в очаге воспаления.
• Деструкция мембран клеток, повреждённых флогогенным фактором.
• Разрушение белковых структур и клеток флогогенного агента, когда им являются микроорганизмы, одно и многоклеточные паразиты, а также — белоксодержащие факторы (вирусы, АТ, комплексы АгАТ, токсины и другие соединения).
• Активация иммунных (в том числе — иммунопатологических) реакций в связи с денатурацией белков как собственных погибших клеток, так и флогогенного агента. Включение клеточных и гуморальных механизмов иммунитета обеспечивает обнаружение, деструкцию и элиминацию антигенно чужеродных структур.
• Продукты протеолиза служат субстратом синтеза новых клеточных компонентов взамен повреждённых.
