1.1.3. Получение
В природе спирты встречаются редко, чаще — в виде производных (сложные эфиры и др.), из которых они могут быть получены. Для получения спиртов важную роль играет органический синтез. Приведем некоторые способы синтеза спиртов.
1. Гидратация (присоединение воды к алкенам). Реакция проводится в присутствии катализаторов. При использовании в качестве катализатора серной кислоты (сернокислотная гидратация) реакция идет в две стадии:
H2C==CH2 + HO—SO2—OH ® H3C—CH2—OSO2—OH этилсерная кислота
H3C—CH2—OSO2—OH + H2O ® H3C—CH2—OH + H2SO4 этиловый спирт
Если реакцию гидратации проводить при высокой температуре (300 - 350 °С) и давлении в присутствии катализатора (смеси фосфорной к вольфрамовой кислот), то реакция идет в одну стадию. Это—метод прямой гидратации. При получении этилового спирта этот метод вытеснил сернокислотную гидратацию. Гидратация алкенов имеет важное промышленное значение. Этот способ позволяет получать спирты из доступного и дешевого сырья — газов крекинга. Так, из 1 т этилене можно получить 1,4 т спирта. Впервые в нашей стране этиловый спирт начали получать гидратацией этилена с 1952 г. (г. Сумгаит).
2. Гидролиз моногалогенопроизводных. Реакцию проводят, нагревая галогеналкилы с водой или водным раствором щелочей:
C2H6Cl + H2O ® C2H6OH + HC
3. Получение метанола из синтез-газа. Процесс идет при 220—300 °С и сравнительно невысоком давлении с использованием катализатора из оксидов меди и цинка:
кат. CO + 2H2 ® CH3OH
Из синтез-газа можно получать и другие спирты.
4. Восстановление альдегидов и кетонов. При восстановлении альдегидов образуются первичные, а при восстановлении кетонов — вторичные: O // 2H H3C—C ® H3C—CH2OH \ H уксусный этиловый альдегид спирт
2H H3C—CO—CH3 ® H3C—CH—CH3 | OH ацетон изопропиловый спирт
5. Спиртовое брожение (расщепление) моносахаридов C6H12O6 под влиянием ферментов: зимаза C6H12O6 —® C2H6OH + 2CO2
1.1.4. Физические и химические свойства
Физические свойства. Физические свойства некоторых одноатомных спиртов приведены в таблице.
Таблица 1. Физические свойства некоторых одноатомиых спиртов
Название спиртов |
Формула |
tкип,°C |
tпл,°C |
d204 |
Метиловый (метанол) |
СН3ОН |
64,7 |
-97,8 |
0,7930 |
Этиловый (этанол) |
C2H5OH |
78,3 |
-117,3 |
0,7900 |
Пропиловый (пропанол-1) |
н-С3Н7ОН |
97,2 |
-127 |
0,8040 |
Изопропиловый (пропанол-2) |
СH3СН(ОН)СН3 |
82,2 |
-88 |
0,7850 |
Бутиловый (бутанол-1) |
н-C4H9OH |
117,7 |
-79,9 |
0,8090 |
втop-Бутиловый (бутанол-2) |
СH3СН2СН(ОН)СН3 |
100 |
-89 |
0,8080 |
Изобутиловый (2-метилпропанол-1) |
СН3СН(СН3)СН2OН |
108,4 |
-108 |
0,8010 |
трет-Бутиловый (2-метилпропанол-2) |
(СН3)3СОН |
83 |
+25 |
0,7880 |
Амиловый (пентанол-1) |
C5H11OH |
138 |
-78,2 |
0,8140 |
Гексиловый (гексанол-1) |
C6H13OH |
157,2 |
-51,6 |
0,8190 |
Гептиловый (гептанол-1) |
C7H15OH |
176,3 |
-34,1 |
0,8220 |
Октиловый (октанол-1) |
C8H17OH |
195,0 |
-16,3 |
0,8240 |
Нониловый (нонанол-1) |
C9H19OH |
213,5 |
-5,0 |
0,8270 |
Дециловый (деканол-1) |
C10H21OH |
231,0 |
+6,0 |
0,8290 |
Предельные одноатомные спирты от C1 до C12 — жидкости. Высшие спирты — мазеобразные вещества, от C21 и выше — твердые вещества. Все спирты легче воды (плотность ниже единицы). Температура кипения спиртов нормального строения повышается с увеличением молекулярной массы. Спирты нормального строения кипят при более высокой температуре, чем спирты с изостроением. В воде хорошо растворяются метиловый, этиловый и пропиловый спирты. С увеличением молекулярной массы растворимость спиртов снижается. Низшие спирты легче воспламеняются и горят бесцветным пламенем. Спирты с большой молекулярной массой коптят при горении. Температура кипения спиртов выше, чем галогеналкилов и углеводородов с тем же числом углеродных атомов. Это объясняется тем, что молекулы спирта, как и воды, являются ассоциированными жидкостями за счет водородных связей, возникающих между молекулами: . . . : H—O : . . . H—O : . . . H—O : . . . | | | R R R Водородная связь оказывает большое влияние на физические свойства спиртов.
Химические свойства. Основные химические свойства спиртов определяются реакционноспособной гидроксильной группой. Химические реакции могут идти или только по водороду гидроксильной группы, или протекать с участием всей группы.
Реакции гидроксильного водорода. 1. Взаимодействие спиртов со щелочными металлами (образование алкоголятов). Спирты, как известно, обладают чрезвычайно слабыми кислотными. Однако атом водорода гидроксильной группы, обладая некоторой подвижностью, способен обмениваться в реакциях замещения на активные металлы:
2C2H6OH + 2Na ® 2C2H6ONa + H2 этилат натрия
Образующиеся продукты называют алкоголятами (от названия спиртов — алкоголи). Алкоголяты метилового спирта называются метилатами, а этилового — этилатами и т.д. Алкоголяты — твердые, неустойчивые вещества, легко подвергающиеся гидролизу:
C2H6ONa + H2O ® C2H6OH + NaOH
Алкоголяты щелочных металлов обладают более сильными основными свойствами, чем гидроксиды щелочных металлов.
2. Образование простых эфиров.
Взаимодействием алкоголятов с галогеналкилами можно получить простые эфиры:
C2H6—ONa + I—C2H6 ® C2H6—O—C2H6 + NaI диэтиловый эфир
3. Образование сложных эфиров (реакция этерификации).
При реакции спиртов с кислотами (органическими или неорганическими) получаются соединения, которые называют сложными эфирами. Такая реакция получила название реакции этерификации (от лат. aether — эфир). Если во взаимодействие со спиртом вводят органические (карбоновые) кислоты, то в качестве катализатора используют сильные минеральные кислоты: O O // H+ // H3C—С—OH + HO—C2H5 « H3C—C—O—C2H5 + H2O уксусная этиловый эфир кислота уксусной кислоты (этилацетат)
Реакции гидроксила. 1. Замещение гидроксильной группы на галоген (образование галогенопроизводного):
C2H6OH + HCl « C2H6Cl + H2O
Такая реакция обратима, но можно равновесие сдвинуть вправо, если ее проводить в присутствии водоотнимающих средств (например, H2SO4(конц.), ZnCl2 и др.). Замещение гидроксильной группы на галоген происходит также при взаимодействии спирта с PCl5.
2. Дегидратация спиртов (отщепление воды).
Реакция дегидратации может быть внутримолекулярной и межмолекулярной. При внутримолекулярной дегидратации образуются алкеновые углеводороды:
H+ CH2—CH2 ® H2C==CH2 + H2O | | t этилен H OH
Легче дегидратируются третичные, затем вторичные и, наконец, первичные спирты.
Межмолекулярная дегидратация приводит к образованию простых эфиров:
H+ C2H5—OH + HO—C2H5 ® C2H5—O—C2H5 + H2O t диэтиловый эфир
В этих реакциях в качестве водоотнимающих средств используют Н2SO4 (конц.). Окисление спиртов. Предельные спирты, в отличие от алканов, легко окисляются. Главный "виновник" этого — гидроксильная группа. При окислении первичных спиртов образуются альдегиды, а при окислении вторичных — кетоны:
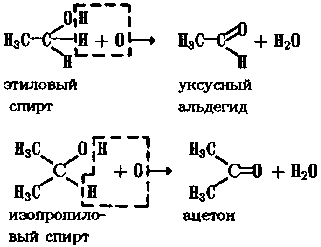
В качестве окислителей используют К2Сr2О7 + H2SO4 или KMnO4 + H2SO4. Третичные спирты более устойчивы к действию окислителей. Реакции окисления спиртов являются обратными реакциями восстановления альдегидов и кетонов. 1.1.5. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Метиловый, или древесный спирт (метанол-яд), СН3ОН — прозрачная жидкость со специфическим запахом, напоминающим этиловый спирт. В промышленности его получают из синтез-газа. Раньше получали сухой перегонкой древесины (отсюда его старое название — древесный спирт). Метиловый спирт широко используется в промышленности для синтеза формальдегида, полимерных материалов. Применяют его в качестве растворителей для лаков, политур, красителей. Из метилового спирта получают различные органические продукты, в том числе — высокооктановое топливо. Спирт используют в органическом синтезе как метилирующий агент (средство для введения в органические соединения группы СН3). Метиловый спирт — сильный яд. Несколько его граммов, попав в организм, приводят к слепоте, а большие количества — к смерти. Поэтому метиловый спирт для технических нужд идет под обязательным названием "Метанол — яд" и хранится в специальных опечатанных хранилищах (сейфах).
Этиловый спирт (этанол) С2Н5ОН — бесцветней жидкость, легко испаряющаяся. Спирт, содержащий 4—5 % воды, называют ректификатом, а содержащий только доли процента воды — абсолютным спиртом. Такой спирт получают химической обработкой в присутствии водоотнимающих средств (например, свежепрокаленного СаО). Этиловый спирт — многотоннажный продукт химической промышленности. Получают его различными способами. Один из них — спиртовое брожение веществ, содержащих сахаристые вещества, в присутствии ферментов (например, зимазы — фермента дрожжей): зимаза
C6H12O6 —зимаза® C2H6OH + 2CO2
Такой спирт называют пищевым или винным спиртом. Этиловый спирт можно получать из целлюлозы, которую предварительно гидролизуют. Образующуюся при этом глюкозу подвергают в дальнейшем спиртовому брожению. Полученный спирт называют гидролизным. Как известно, для получения этилового спирта существуют и синтетические способы, такие, как сернокислотная или прямая гидратация этилена:
H2C==CH2 + H2 —кат.® H3C—CH2OH
Себестоимость спирта, полученного таким способом, намного дешевле, чем приготовленного из пищевых продуктов. Этиловый спирт широко используют в различных областях промышленности и прежде всего в химической. Из него получают синтетический каучук, уксусную кислоту, красители, эссенции, фотопленку, порох, пластмассы. Спирт является хорошим растворителем и антисептиком. Поэтому он находит применение в медицине, парфюмерии. В больших количествах этиловый спирт идет для получения спиртоводочных изделий. Этиловый спирт — сильный наркотик. Попадая в организм, он быстро всасывается в кровь и приводит организм в возбужденное состояние, при котором человеку трудно контролировать свое поведение. Употребление спирта часто является основной причиной тяжелых дорожно-транспортных аварий, несчастных случаев на производстве и бытовых преступлений. Спирт вызывает тяжелые заболевания нервной и сердечно-сосудистой систем, а также желудочно-кишечного тракта. Спирт опасен в любой концентрации (водка, настойки, вино, пиво и т.д.). Этиловый спирт, применяемый для технических целей, специально загрязняют дурно пахнущими веществами. Такой спирт называют денатуратом (для этого спирт подкрашивают, чтобы отличить его от чистого спирта).
н-Пропиловый спирт (проданол-1) Н3С—СН4—СН4ОН - бесцветная жидкость. Используют для получения некоторых органических веществ.
Изопропиловый спирт (пропанол-2) Н3С—СНОН—СН3 — жидкость со специфическим запахом. Получается гидратацией пропилена. Применяют для производства ацетона, в качестве растворителя, в парфюмерии.
СПИРТЫ И ФЕНОЛЫ
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. Вещества, у которых гидроксил находится непосредственно у бензольного кольца, называются фенолами.
В зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трёхатомные.
В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты: первичные R–CH2–OH,
вторичные |
R I CH–OH, I R’ |
и третичные R’– |
R I C–OH. I R’’ |
Физические свойства
Низшие спирты (до С12) – жидкости, температуры кипения которых значительно выше, чем у соответствующих алканов из-за образования водородных связей за счёт полярной связи О–Н
…….. : |
O–H ….. : I R |
O–H …… I R |
Метанол и этанол смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость спиртов в воде уменьшается.
Таблица. Физические свойства спиртов и фенолов
Название |
Формула |
d420 |
tпл°C |
tкип°C |
Спирты |
|
|
|
|
метиловый |
СН3OH |
0, 792 |
-97 |
64 |
этиловый |
С2Н5OH |
0,79 |
-114 |
78 |
пропиловый |
СН3СН2СН2OH |
0,804 |
-120 |
92 |
изопропиловый |
СН3–СН(ОH)–СH3 |
0,786 |
-88 |
82 |
бутиловый |
CH3CH2CH2CH2OH |
0,81 |
-90 |
118 |
вторбутиловый |
CH3CH2CH(CH3)OH |
0,808 |
-115 |
99 |
третбутиловый |
(СН3)3С–OH |
0,79 |
+25 |
83 |
циклогексанол |
С6Н11OH |
0,962 |
-24 |
161 |
бензиловый |
C6H5CH2OH |
1,046 |
-15 |
205 |
этиленгликоль |
HOCH2CH2OH |
1,113 |
-15,5 |
198 |
глицерин |
НО–СН2–CH(ОН)–СН2OH |
1,261 |
-18,2 |
290 |
Фенолы |
|
|
|
|
фенол |
С6Н5OH |
1,05(43°) |
43 |
180 |
пирокатехин |
о - С6Н4(OH)2 |
– |
105 |
245 |
резорцин |
м - С6Н4(OH)2 |
– |
110 |
281 |
гидрохинон |
n - С6Н4(OH)2 |
– |
170 |
285 |
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов – CnH2n+1OH.
Изомерия
1. Изомерия углеродного радикала (начиная с C4H9OH).
2. Изомерия положения гидроксильной группы, (начиная с С3Н7ОН).
3. Межклассовая изомерия с простыми эфирами (СН3–СН2–ОН и СН3–О–СН3).
Название спиртов включает в себя наименование соответствующего углеводорода с добавлением суффикса -ол (положение гидроксильной группы указывают цифрой) или к названию углеводородного радикала добавляется слово "спирт"; также часто встречаются тривиальные (бытовые) названия:
СН3–ОН – метанол, метиловый спирт; СН3–СН2–ОН – этанол, этиловый спирт; СН3–СН–СН3 – пропанол-2, изопропиловый спирт. I OH
Получение
В промышленности.
1. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250°C и давлении 5-10 МПа:
СО + 2Н2 ® СН3ОН
Ранее метанол получали сухой перегонкой древесины без доступа воздуха.
2. Этанол получают:
a) гидратацией этилена (Н3РО4; 280°C; 8 МПа)
СН2=СН2 + Н2О ® СН3–СН2–ОН
b) брожением крахмала (или целлюлозы):
крахмал ® С6Н12О6(глюкоза) ––ферменты® 2С2Н5ОН + 2СО2 (источник крахмала – зерно, картофель)
В лаборатории.
1. Гидратация алкенов (согласно правилу Марковникова):
СH3–СH=CH2 + H2O ––H+® СH3– |
CH– СH3 I OH |
2. Гидролиз галогенопроизводных углеводородов:
СH3–СH2–Br + H2O « СH3–CH2–OH + HBr
Чтобы сдвинуть равновесие вправо, добавляют щёлочь, которая связывает образующийся HBr.
3. Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные.
СH3–СH2- |
O II -C I H |
––2[H]® СH3–CH2- |
-CH2OH |
СH3- |
-C- II O |
-CH3 ––2[H]® CH3- |
-CH- I OH |
-СH3 |
Химические свойства
Свойства спиртов ROH определяются наличием полярных связей Od-–Hd+ и Cd+–Od-, и неподеленных электронных пар на атоме кислорода.
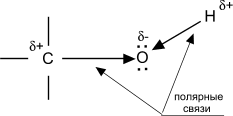
При реакции спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы) или O–H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.
I. Реакции с разрывом связи RO–H
1. Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты. Со щелочами спирты не взаимодействуют.
2СH3CH2CH2OH + 2Na ® 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa ® (СH3CH2O)2Ca + H2
В присутствии воды алкоголяты гидролизуются:
(СH3)3С–OK + H2O ® (СH3)3C–OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода.
2. Взаимодействие с органическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
|
O II |
|
|
O II |
|
CH3– |
C- |
-OH + H - |
-OC2H5 ¬H2SO4® CH3– |
C |
–O–C2H5(уксусноэтиловый эфир (этилацетат)) + H2O |
В общем виде:
|
O II |
|
|
H+ |
|
O II |
|
R– |
C- |
-OH + H- |
-OR’ |
¨ |
R– |
C |
–O–R’ + H2O |
II. Реакции с разрывом связи R–OH.
1. С галогеноводородами:
R–OH + HBr « R–Br + H2O
2. С концентрированной серной кислотой:
C2H5O- |
-H + H–O |
|
O |
|
C2H5O |
O |
|
|
\ // S / \\ |
|
® |
|
\ // S (этилсерная кислота) + H2O / \\ |
|
H–O |
|
O |
|
H–O |
O |
|
C2H5–O |
|
O |
|
C2H5O |
O |
|
|
\ // S / \\ |
|
® |
|
\ // S (диэтилсерная кислота(диэтилсульфат)) + H2O / \\ |
C2H5O- |
-H + H–O |
|
O |
|
C2H5O |
O |
III. Реакции окисления
1. Спирты горят:
2С3H7ОH + 9O2 ® 6СO2 + 8H2O
2. При действии окислителей:
a) первичные спирты превращаются в альдегиды (или в карбоновые кислоты)
|
|
|
|
O II |
|
|
O II |
|
R- |
-CH2–OH |
(первичный спирт) ––[O]® |
R- |
-C |
(альдегид) ––[O]® |
R- |
-C |
(карбоновая к-та) |
|
|
|
|
I H |
|
|
I OH |
|
|
K2Cr2O7 |
O II |
K2Cr2O7 |
O II |
CH3–CH2–OH |
––––® |
CH3–C |
––––® |
CH3–C |
|
H2SO4 |
I H |
H2SO4 |
I OH |
O II CH3OH + CuO ––t°® H–C I H |
+ Cu + H2O |
b) вторичные спирты окисляются до кетонов
R- |
-CH- |
-R’(вторичный спирт) ––[O]® |
R- |
-C- |
-R'(кетон) |
|
I OH |
|
|
II O |
|
CH3– |
CH–CH2–CH3 I OH |
––K2Cr2O7,H2SO4® |
CH3– |
C–CH2–CH3 II O |
c) третичные спирты устойчивы к действию окислителей.
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами.
1. Внутримолекулярная дегидратация приводит к образованию алкенов
CH3–CH2–OH ––t°>140°C,H2SO4® CH2=CH2 + H2O
CH3 \ |
|
|
|
CH3 I |
CH3–C– |
CH–CH3 |
––t°,H2SO4® |
CH3– |
C=CH–CH3 + H2O |
I HO |
I H |
|
|
|
При отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева).
2. Межмолекулярная дегидратация даёт простые эфиры
R- |
-OH + H- |
-O–R –– t°,H2SO4® R–O–R(простой эфир) + H2O |
CH3–CH2- |
-OH + H- |
-O–CH2–CH3 ––t°<140°C,H2SO4® CH3–CH2–O–CH2–CH3(диэтиловый эфир) + H2O |
Обе реакции конкурируют между собой. Увеличение температуры и разбавление инертным растворителем благоприятствуют внутримолекулярному процессу.
Многоатомные спирты
Получение
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:
3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров (см. "Жиры") или из пропилена по схемам:
Физические свойства
Этиленгликоль и глицерин – бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами, при этом происходит последовательное замещение атомов водорода в гидроксильных группах.
CH2–OH I CH2–OH |
Na –––® -1/2H2 |
CH2–ONa I CH2–OH |
Na –––® -1/2H2 |
CH2–ONa I CH2–ONa |
Увеличение числа гидроксильных групп в молекуле приводит к усилению кислотных свойств многоатомных спиртов по сравнению с одноатомными.
Так, они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений:
CH2–OH 2 I + Cu(OH)2(голубой осадок) ® CH2–OH
|
|
(одноатомные спирты с Cu(OH)2 не реагируют).
Глицерин легко нитруется, давая тринитроглицерин – сильное взрывчатое вещество (основа динамита):
CH2–O- |
-H |
|
HO- |
-NO2 |
|
CH2–O–NO2 |
|
I |
|
|
|
|
H2SO4 |
I |
|
CH –O- |
-H |
+ |
HO- |
-NO2 |
–––® |
CH–O–NO2 |
+ 3H2O |
I |
|
|
|
|
|
I |
|
CH2–O- |
-H |
|
HO- |
-NO2 |
|
CH2–O–NO2 |
|
При его взрыве выделяется большое количество газов и тепла:
CH2–O–NO2 I 4CH–O–NO2 ® 12CO2 + 6N2 + 10H2O + O2 + Q I CH2–O–NO2 |
Применение
Этиленгликоль применяют:
1) в качестве антифриза;
2) для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу);
2) в кожевенном производстве и в текстильной промышленности;
3) для производства нитроглицерина.
Фенолы
Фенолы содержат гидроксил непосредственно связанный с атомом углерода ароматического кольца. По числу гидроксильных групп, присоединенных к кольцу, фенолы подразделяются на одно-, двух- и многоатомные.
Изомерия фенолов обусловлена взаимным положением заместителей в бензольном кольце.
орто-крезол 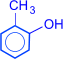 мета-крезол
мета-крезол  пара-крезол
пара-крезол ![]()
Получение
Фенол в промышленности получают:
1) окислением изопропилбензола (кумола) в гидроперекись с последующим разложением её серной кислотой.
CH3 I |
|
CH3 I |
|
|
|
|
|
H3C–CH |
|
H3C–C–O–OH |
|
OH |
|
O |
|
|
O2 |
|
H2SO4 |
|
|
II |
|
® |
–––® |
+ H3C– |
C |
–CH3 |
2) из бензола по способу Рашига:
|
HCl + O2 |
|
H2O(Cu2+) |
|
––––––® |
––––––® |
|||
-H2O |
-HCl |
Химические свойства
1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов. В результате сопряжения неподелённой пары электронов кислородного атома с p- электронной системой ароматического кольца, электронная плотность О-атома перемещается частично на связь С–О, увеличивая при этом электронную плотность в бензольном ядре (в особенности в орто- и пара-положениях). Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона.
Hd+ ® |
|
Фенолы, в отличие от спиртов, образуют феноляты не только при взаимодействии с активными металлами, но и с водными растворами щелочей.
2 |
|
OH + 2Na ® |
2 |
|
ONa(фенолят натрия) + H2 |
|
OH + NaOH « |
|
ONa + H2O |
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией, идентифицирующей фенолы:
|
|
|
|
|
|
|
3 |
|
OH + FeCl3 « |
|
O–Fe |
|
+ 3 HCl |
|
|
|
|
|
|
|
Фенолы – очень слабые кислоты, поэтому феноляты легко гидролизуются и разрушаются не только сильными, но и очень слабыми кислотами:
|
ONa + H2SO4 ® |
|
OH + NaHSO4 |
|
ONa + CO2 + H2O ® |
|
OH + NaHCO3 |
Фенолы образуют простые эфиры (синтез Вильямсона) и сложные эфиры
|
O |
Na + Br- |
-CH2–CH3 ® |
|
O–CH2–CH3(этилфениловый эфир) + NaBr |
и сложные эфиры
|
|
|
O II |
|
|
O II |
|
O |
H + Cl- |
-C–CH3(хлорангидрид укс.кислоты) ® |
|
O– |
C–CH3(фениловый эфир укс.кислоты) + HCl |
2. Реакции бензольного кольца. Гидроксильная группа у фенолов является очень сильным орто- и пара-ориентантом. Реакции замещения атомов водорода в бензольном кольце протекают в более мягких условиях, чем у бензола. При бромировании и нитровании могут быть получены 2,4,6-тризамещенные производные
OH |
|
|
OH |
|
OH |
|
|
+ 3H2O |
3HNO3 ¬––– H2SO4 |
|
3Br2 –––® |
|
+ 3HBr |
NO2 |
|
|
|
|
Br |
|
2,4,6 – тринитро- фенол (пикриновая кислота) |
|
|
|
|
2,4,6–трибром- фенол |
|
3. Гидрирование.
OH |
|
OH |
|
3H2 ––® Ni |
|
Применение
Фенол применяется при производстве фенолформальдегидных смол, в фармацевтической промышленности и как антисептик (карболовая кислота).
Гидрохинон (1,4-диоксибензол) – проявитель в фотографии.
Спирты и фенолы
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. Вещества, у которых гидроксил находится непосредственно у бензольного кольца, называются фенолами. В зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трёхатомные. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты: первичные R–CH2–OH, вторичные R I CH–OH, I R’ и третичные R’– R I C–OH. I R’’ Физические свойства Низшие спирты (до С12) – жидкости, температуры кипения которых значительно выше, чем у соответствующих алканов из-за образования водородных связей за счёт полярной связи О–Н …….. : O–H ….. : I R O–H …… I R Метанол и этанол смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость спиртов в воде уменьшается. Таблица. Физические свойства спиртов и фенолов
Название |
Формула |
d420 |
tпл°C |
tкип°C |
Спирты |
||||
метиловый |
СН3OH |
0, 792 |
-97 |
64 |
этиловый |
С2Н5OH |
0,79 |
-114 |
78 |
пропиловый |
СН3СН2СН2OH |
0,804 |
-120 |
92 |
изопропиловый |
СН3–СН(ОH)–СH3 |
0,786 |
-88 |
82 |
бутиловый |
CH3CH2CH2CH2OH |
0,81 |
-90 |
118 |
вторбутиловый |
CH3CH2CH(CH3)OH |
0,808 |
-115 |
99 |
третбутиловый |
(СН3)3С–OH |
0,79 |
+25 |
83 |
циклогексанол |
С6Н11OH |
0,962 |
-24 |
161 |
бензиловый |
C6H5CH2OH |
1,046 |
-15 |
205 |
этиленгликоль |
HOCH2CH2OH |
1,113 |
-15,5 |
198 |
глицерин |
НО–СН2–CH(ОН)–СН2OH |
1,261 |
-18,2 |
290 |
Фенолы |
||||
фенол |
С6Н5OH |
1,05(43°) |
43 |
180 |
пирокатехин |
о - С6Н4(OH)2 |
– |
105 |
245 |
резорцин |
м - С6Н4(OH)2 |
– |
110 |
281 |
гидрохинон |
n - С6Н4(OH)2 |
– |
170 |
285 |
Одноатомные спирты Общая формула гомологического ряда предельных одноатомных спиртов – CnH2n+1OH. Изомерия 1. Изомерия углеродного радикала (начиная с C4H9OH). 2. Изомерия положения гидроксильной группы, (начиная с С3Н7ОН). 3. Межклассовая изомерия с простыми эфирами (СН3–СН2–ОН и СН3–О–СН3). Название спиртов включает в себя наименование соответствующего углеводорода с добавлением суффикса -ол (положение гидроксильной группы указывают цифрой) или к названию углеводородного радикала добавляется слово "спирт"; также часто встречаются тривиальные (бытовые) названия: СН3–ОН – метанол, метиловый спирт; СН3–СН2–ОН – этанол, этиловый спирт; СН3–СН–СН3 – пропанол-2, изопропиловый спирт. I OH
Получение
В
промышленности.
1. Метанол синтезируют
из синтез-газа на катализаторе (ZnO, Сu)
при 250°C и давлении 5-10 МПа:
СО + 2Н2
® СН3ОН
Ранее метанол получали сухой перегонкой
древесины без доступа воздуха.
2. Этанол получают:
a) гидратацией этилена
(Н3РО4; 280°C; 8 МПа)
СН2=СН2 +
Н2О ® СН3–СН2–ОН
b) брожением крахмала (или
целлюлозы):
крахмал ®
С6Н12О6(глюкоза) ––ферменты® 2С2Н5ОН +
2СО2
(источник крахмала – зерно,
картофель)
В лаборатории.
1. Гидратация алкенов
(согласно правилу Марковникова):
СH3–СH=CH2
+ H2O ––H+® СH3–
CH–
СH3
I
OH
2. Гидролиз галогенопроизводных
углеводородов:
СH3–СH2–Br +
H2O « СH3–CH2–OH + HBr
Чтобы сдвинуть равновесие вправо,
добавляют щёлочь, которая связывает
образующийся HBr.
3. Восстановление
карбонильных соединений:
Альдегиды образуют первичные спирты,
а кетоны – вторичные.
СH3–СH2-
O
II
-C
I
H
––2[H]® СH3–CH2-
-CH2OH
СH3-
-C-
II
O
-CH3 ––2[H]®
CH3-
-CH-
I
OH
-СH3
Химические
свойства
Свойства спиртов ROH
определяются наличием полярных связей
Od-–Hd+ и Cd+–Od-, и неподеленных электронных
пар на атоме кислорода.
 При
реакции спиртов возможно разрушение
одной из двух связей: C–OH (с отщеплением
гидроксильной группы) или O–H (с отщеплением
водорода). Это могут быть реакции
замещения, в которых происходит замена
OH или H, или элиминирование (отщепление),
когда образуется двойная связь. На
реакционную способность спиртов большое
влияние оказывает строение радикалов,
связанных с гидроксильной группой.
I.
Реакции с разрывом связи RO–H
1. Спирты реагируют с
щелочными и щелочноземельными металлами,
образуя солеобразные соединения –
алкоголяты. Со щелочами спирты не
взаимодействуют.
2СH3CH2CH2OH
+ 2Na ® 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa ®
(СH3CH2O)2Ca + H2
В присутствии воды алкоголяты
гидролизуются:
(СH3)3С–OK +
H2O ® (СH3)3C–OH + KOH
Это означает, что спирты – более слабые
кислоты, чем вода.
2. Взаимодействие с
органическими кислотами (реакция
этерификации) приводит к образованию
сложных эфиров.
O
II
O
II
CH3–
C-
-OH + H -
-OC2H5 ¬H2SO4®
CH3–
C
–O–C2H5(уксусноэтиловый эфир
(этилацетат)) + H2O
В общем виде:
O
II
H+
O
II
R–
C-
-OH + H-
-OR’
¨
R–
C
–O–R’ + H2O
II. Реакции с
разрывом связи R–OH.
1. С галогеноводородами:
R–OH
+ HBr « R–Br + H2O
2. С концентрированной
серной кислотой:
C2H5O-
-H + H–O
O
C2H5O
O
\ //
S
/ \\
®
\ //
S (этилсерная кислота) + H2O
/
\\
H–O
O
H–O
O
C2H5–O
O
C2H5O
O
\ //
S
/ \\
®
\ //
S (диэтилсерная
кислота(диэтилсульфат)) + H2O
/
\\
C2H5O-
-H + H–O
O
C2H5O
O
III. Реакции
окисления
1. Спирты горят:
2С3H7ОH
+ 9O2 ® 6СO2 + 8H2O
2. При действии
окислителей:
a) первичные спирты
превращаются в альдегиды (или в карбоновые
кислоты)
O
II
O
II
R-
-CH2–OH
(первичный спирт)
––[O]®
R-
-C
(альдегид) ––[O]®
R-
-C
(карбоновая к-та)
I
H
I
OH
K2Cr2O7
O
II
K2Cr2O7
O
II
CH3–CH2–OH
––––®
CH3–C
––––®
CH3–C
H2SO4
I
H
H2SO4
I
OH
O
II
CH3OH + CuO ––t°® H–C
I
H
+ Cu + H2O
b) вторичные спирты окисляются
до кетонов
R-
-CH-
-R’(вторичный спирт)
––[O]®
R-
-C-
-R'(кетон)
I
OH
II
O
CH3–
CH–CH2–CH3
I
OH
––K2Cr2O7,H2SO4®
CH3–
C–CH2–CH3
II
O
c) третичные спирты
устойчивы к действию окислителей.
IV. Дегидратация
Протекает
при нагревании с водоотнимающими
реагентами.
1. Внутримолекулярная
дегидратация приводит к образованию
алкенов
CH3–CH2–OH
––t°>140°C,H2SO4® CH2=CH2 + H2O
CH3
\
CH3
I
CH3–C–
CH–CH3
––t°,H2SO4®
CH3–
C=CH–CH3 + H2O
I
HO
I
H
При отщеплении воды от молекул
вторичных и третичных спиртов атом
водорода отрывается от соседнего
наименее гидрогенизированного атома
углерода; образующийся алкен содержит
наибольшее число заместителей при
двойной связи (правило Зайцева).
2.
Межмолекулярная дегидратация даёт
простые эфиры
R-
-OH + H-
-O–R –– t°,H2SO4®
R–O–R(простой эфир) + H2O
CH3–CH2-
-OH + H-
-O–CH2–CH3
––t°<140°C,H2SO4® CH3–CH2–O–CH2–CH3(диэтиловый
эфир) + H2O
Обе реакции конкурируют между собой.
Увеличение температуры и разбавление
инертным растворителем благоприятствуют
внутримолекулярному процессу.
Многоатомные
спирты
Получение
1. Этиленгликоль
(этандиол-1,2) синтезируют из этилена
различными способами:
3CH2=CH2
+ 2KMnO4 + 4H2O ® 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
2. Глицерин (пропантриол
-1,2,3) получают гидролизом жиров (см.
"Жиры") или из пропилена по
схемам:
Физические
свойства
Этиленгликоль и
глицерин – бесцветные, вязкие жидкости,
хорошо растворимые в воде, имеют высокие
температуры кипения.
Химические
свойства
Для многоатомных
спиртов характерны основные реакции
одноатомных спиртов. В отличие от них,
они могут образовывать производные по
одной или по нескольким гидроксильным
группам, в зависимости от условий
проведения реакций.
Многоатомные
спирты, как и одноатомные, проявляют
свойства кислот при взаимодействии с
активными металлами, при этом происходит
последовательное замещение атомов
водорода в гидроксильных
группах.
CH2–OH
I
CH2–OH
Na
–––®
-1/2H2
CH2–ONa
I
CH2–OH
Na
–––®
-1/2H2
CH2–ONa
I
CH2–ONa
Увеличение
числа гидроксильных групп в молекуле
приводит к усилению кислотных свойств
многоатомных спиртов по сравнению с
одноатомными.
Так, они способны
растворять свежеосаждённый гидроксид
меди (II) с образованием внутрикомплексных
соединений:
CH2–OH
2
I + Cu(OH)2(голубой
осадок) ®
CH2–OH
(гликолят меди (ярко-синий
раствор))
(одноатомные
спирты с Cu(OH)2 не реагируют).
Глицерин
легко нитруется, давая тринитроглицерин
– сильное взрывчатое вещество (основа
динамита):
CH2–O-
-H
HO-
-NO2
CH2–O–NO2
I
H2SO4
I
CH
–O-
-H
+
HO-
-NO2
–––®
CH–O–NO2
+ 3H2O
I
I
CH2–O-
-H
HO-
-NO2
CH2–O–NO2
При
его взрыве выделяется большое количество
газов и тепла:
CH2–O–NO2
I
4CH–O–NO2 ® 12CO2 + 6N2 +
10H2O + O2 + Q
I
CH2–O–NO2
Применение
Этиленгликоль
применяют:
1)
в качестве антифриза;
2) для синтеза высокомолекулярных
соединений (например, лавсана).
Глицерин
применяют:
1)
в парфюмерии и в медицине (для изготовления
мазей, смягчающих кожу);
2) в кожевенном производстве
и в текстильной промышленности;
3) для производства
нитроглицерина.
Фенолы
Фенолы
содержат гидроксил непосредственно
связанный с атомом углерода ароматического
кольца. По числу гидроксильных групп,
присоединенных к кольцу, фенолы
подразделяются на одно-, двух- и
многоатомные.
Изомерия фенолов
обусловлена взаимным положением
заместителей в бензольном
кольце.
орто-крезол
мета-крезол
пара-крезол
Получение
Фенол
в промышленности получают:
1) окислением изопропилбензола
(кумола) в гидроперекись с последующим
разложением её серной кислотой.
CH3
I
CH3
I
H3C–CH
H3C–C–O–OH
OH
O
O2
H2SO4
II
®
–––®
+
H3C–
C
–CH3
2) из бензола по способу
Рашига:
HCl
+ O2
H2O(Cu2+)
––––––®
––––––®
-H2O
-HCl
Химические
свойства
1. Кислотные свойства
у фенолов выражены сильнее, чем у спиртов.
В результате сопряжения неподелённой
пары электронов кислородного атома с
p- электронной системой ароматического
кольца, электронная плотность О-атома
перемещается частично на связь С–О,
увеличивая при этом электронную плотность
в бензольном ядре (в особенности в орто-
и пара-положениях). Электронная пара
связи О–Н сильнее притягивается к атому
кислорода, способствуя тем самым созданию
большего положительного заряда на атоме
водорода гидроксильной группы и,
следовательно, отщеплению этого водорода
в виде протона.
Hd+ ®
Фенолы, в отличие
от спиртов, образуют феноляты не только
при взаимодействии с активными металлами,
но и с водными растворами щелочей.
2
OH + 2Na ® 2
ONa(фенолят натрия) + H2
OH + NaOH « ONa +
H2O
Образование фиолетового окрашивания
при добавлении раствора FeCl3 служит
качественной реакцией, идентифицирующей
фенолы:
3
OH + FeCl3 «
O–Fe + 3 HCl
Фенолы – очень слабые кислоты, поэтому
феноляты легко гидролизуются и разрушаются
не только сильными, но и очень слабыми
кислотами:
ONa + H2SO4 ® OH +
NaHSO4
ONa + CO2 +
H2O ® OH +
NaHCO3
Фенолы образуют простые эфиры (синтез
Вильямсона) и сложные эфиры
O Na + Br- -CH2–CH3 ®
O–CH2–CH3(этилфениловый
эфир) + NaBr
и сложные эфиры
O
II
O
II
O H +
Cl- -C–CH3(хлорангидрид укс.кислоты)
® O–
C–CH3(фениловый эфир укс.кислоты) +
HCl
2. Реакции бензольного
кольца. Гидроксильная группа у фенолов
является очень сильным орто- и
пара-ориентантом. Реакции замещения
атомов водорода в бензольном кольце
протекают в более мягких условиях, чем
у бензола. При бромировании и нитровании
могут быть получены 2,4,6-тризамещенные
производные
OH
OH
OH
+ 3H2O
3HNO3
¬–––
H2SO4
3Br2
–––®
+
3HBr
NO2
Br
2,4,6 –
тринитро-
фенол
(пикриновая
кислота)
2,4,6–трибром-
фенол
3. Гидрирование.
OH
OH
3H2
––®
Ni
(циклогексанол)
Применение
Фенол
применяется при производстве
фенолформальдегидных смол, в
фармацевтической промышленности и как
антисептик (карболовая кислота).
Гидрохинон
(1,4-диоксибензол) – проявитель в
фотографии.
При
реакции спиртов возможно разрушение
одной из двух связей: C–OH (с отщеплением
гидроксильной группы) или O–H (с отщеплением
водорода). Это могут быть реакции
замещения, в которых происходит замена
OH или H, или элиминирование (отщепление),
когда образуется двойная связь. На
реакционную способность спиртов большое
влияние оказывает строение радикалов,
связанных с гидроксильной группой.
I.
Реакции с разрывом связи RO–H
1. Спирты реагируют с
щелочными и щелочноземельными металлами,
образуя солеобразные соединения –
алкоголяты. Со щелочами спирты не
взаимодействуют.
2СH3CH2CH2OH
+ 2Na ® 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa ®
(СH3CH2O)2Ca + H2
В присутствии воды алкоголяты
гидролизуются:
(СH3)3С–OK +
H2O ® (СH3)3C–OH + KOH
Это означает, что спирты – более слабые
кислоты, чем вода.
2. Взаимодействие с
органическими кислотами (реакция
этерификации) приводит к образованию
сложных эфиров.
O
II
O
II
CH3–
C-
-OH + H -
-OC2H5 ¬H2SO4®
CH3–
C
–O–C2H5(уксусноэтиловый эфир
(этилацетат)) + H2O
В общем виде:
O
II
H+
O
II
R–
C-
-OH + H-
-OR’
¨
R–
C
–O–R’ + H2O
II. Реакции с
разрывом связи R–OH.
1. С галогеноводородами:
R–OH
+ HBr « R–Br + H2O
2. С концентрированной
серной кислотой:
C2H5O-
-H + H–O
O
C2H5O
O
\ //
S
/ \\
®
\ //
S (этилсерная кислота) + H2O
/
\\
H–O
O
H–O
O
C2H5–O
O
C2H5O
O
\ //
S
/ \\
®
\ //
S (диэтилсерная
кислота(диэтилсульфат)) + H2O
/
\\
C2H5O-
-H + H–O
O
C2H5O
O
III. Реакции
окисления
1. Спирты горят:
2С3H7ОH
+ 9O2 ® 6СO2 + 8H2O
2. При действии
окислителей:
a) первичные спирты
превращаются в альдегиды (или в карбоновые
кислоты)
O
II
O
II
R-
-CH2–OH
(первичный спирт)
––[O]®
R-
-C
(альдегид) ––[O]®
R-
-C
(карбоновая к-та)
I
H
I
OH
K2Cr2O7
O
II
K2Cr2O7
O
II
CH3–CH2–OH
––––®
CH3–C
––––®
CH3–C
H2SO4
I
H
H2SO4
I
OH
O
II
CH3OH + CuO ––t°® H–C
I
H
+ Cu + H2O
b) вторичные спирты окисляются
до кетонов
R-
-CH-
-R’(вторичный спирт)
––[O]®
R-
-C-
-R'(кетон)
I
OH
II
O
CH3–
CH–CH2–CH3
I
OH
––K2Cr2O7,H2SO4®
CH3–
C–CH2–CH3
II
O
c) третичные спирты
устойчивы к действию окислителей.
IV. Дегидратация
Протекает
при нагревании с водоотнимающими
реагентами.
1. Внутримолекулярная
дегидратация приводит к образованию
алкенов
CH3–CH2–OH
––t°>140°C,H2SO4® CH2=CH2 + H2O
CH3
\
CH3
I
CH3–C–
CH–CH3
––t°,H2SO4®
CH3–
C=CH–CH3 + H2O
I
HO
I
H
При отщеплении воды от молекул
вторичных и третичных спиртов атом
водорода отрывается от соседнего
наименее гидрогенизированного атома
углерода; образующийся алкен содержит
наибольшее число заместителей при
двойной связи (правило Зайцева).
2.
Межмолекулярная дегидратация даёт
простые эфиры
R-
-OH + H-
-O–R –– t°,H2SO4®
R–O–R(простой эфир) + H2O
CH3–CH2-
-OH + H-
-O–CH2–CH3
––t°<140°C,H2SO4® CH3–CH2–O–CH2–CH3(диэтиловый
эфир) + H2O
Обе реакции конкурируют между собой.
Увеличение температуры и разбавление
инертным растворителем благоприятствуют
внутримолекулярному процессу.
Многоатомные
спирты
Получение
1. Этиленгликоль
(этандиол-1,2) синтезируют из этилена
различными способами:
3CH2=CH2
+ 2KMnO4 + 4H2O ® 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
2. Глицерин (пропантриол
-1,2,3) получают гидролизом жиров (см.
"Жиры") или из пропилена по
схемам:
Физические
свойства
Этиленгликоль и
глицерин – бесцветные, вязкие жидкости,
хорошо растворимые в воде, имеют высокие
температуры кипения.
Химические
свойства
Для многоатомных
спиртов характерны основные реакции
одноатомных спиртов. В отличие от них,
они могут образовывать производные по
одной или по нескольким гидроксильным
группам, в зависимости от условий
проведения реакций.
Многоатомные
спирты, как и одноатомные, проявляют
свойства кислот при взаимодействии с
активными металлами, при этом происходит
последовательное замещение атомов
водорода в гидроксильных
группах.
CH2–OH
I
CH2–OH
Na
–––®
-1/2H2
CH2–ONa
I
CH2–OH
Na
–––®
-1/2H2
CH2–ONa
I
CH2–ONa
Увеличение
числа гидроксильных групп в молекуле
приводит к усилению кислотных свойств
многоатомных спиртов по сравнению с
одноатомными.
Так, они способны
растворять свежеосаждённый гидроксид
меди (II) с образованием внутрикомплексных
соединений:
CH2–OH
2
I + Cu(OH)2(голубой
осадок) ®
CH2–OH
(гликолят меди (ярко-синий
раствор))
(одноатомные
спирты с Cu(OH)2 не реагируют).
Глицерин
легко нитруется, давая тринитроглицерин
– сильное взрывчатое вещество (основа
динамита):
CH2–O-
-H
HO-
-NO2
CH2–O–NO2
I
H2SO4
I
CH
–O-
-H
+
HO-
-NO2
–––®
CH–O–NO2
+ 3H2O
I
I
CH2–O-
-H
HO-
-NO2
CH2–O–NO2
При
его взрыве выделяется большое количество
газов и тепла:
CH2–O–NO2
I
4CH–O–NO2 ® 12CO2 + 6N2 +
10H2O + O2 + Q
I
CH2–O–NO2
Применение
Этиленгликоль
применяют:
1)
в качестве антифриза;
2) для синтеза высокомолекулярных
соединений (например, лавсана).
Глицерин
применяют:
1)
в парфюмерии и в медицине (для изготовления
мазей, смягчающих кожу);
2) в кожевенном производстве
и в текстильной промышленности;
3) для производства
нитроглицерина.
Фенолы
Фенолы
содержат гидроксил непосредственно
связанный с атомом углерода ароматического
кольца. По числу гидроксильных групп,
присоединенных к кольцу, фенолы
подразделяются на одно-, двух- и
многоатомные.
Изомерия фенолов
обусловлена взаимным положением
заместителей в бензольном
кольце.
орто-крезол
мета-крезол
пара-крезол
Получение
Фенол
в промышленности получают:
1) окислением изопропилбензола
(кумола) в гидроперекись с последующим
разложением её серной кислотой.
CH3
I
CH3
I
H3C–CH
H3C–C–O–OH
OH
O
O2
H2SO4
II
®
–––®
+
H3C–
C
–CH3
2) из бензола по способу
Рашига:
HCl
+ O2
H2O(Cu2+)
––––––®
––––––®
-H2O
-HCl
Химические
свойства
1. Кислотные свойства
у фенолов выражены сильнее, чем у спиртов.
В результате сопряжения неподелённой
пары электронов кислородного атома с
p- электронной системой ароматического
кольца, электронная плотность О-атома
перемещается частично на связь С–О,
увеличивая при этом электронную плотность
в бензольном ядре (в особенности в орто-
и пара-положениях). Электронная пара
связи О–Н сильнее притягивается к атому
кислорода, способствуя тем самым созданию
большего положительного заряда на атоме
водорода гидроксильной группы и,
следовательно, отщеплению этого водорода
в виде протона.
Hd+ ®
Фенолы, в отличие
от спиртов, образуют феноляты не только
при взаимодействии с активными металлами,
но и с водными растворами щелочей.
2
OH + 2Na ® 2
ONa(фенолят натрия) + H2
OH + NaOH « ONa +
H2O
Образование фиолетового окрашивания
при добавлении раствора FeCl3 служит
качественной реакцией, идентифицирующей
фенолы:
3
OH + FeCl3 «
O–Fe + 3 HCl
Фенолы – очень слабые кислоты, поэтому
феноляты легко гидролизуются и разрушаются
не только сильными, но и очень слабыми
кислотами:
ONa + H2SO4 ® OH +
NaHSO4
ONa + CO2 +
H2O ® OH +
NaHCO3
Фенолы образуют простые эфиры (синтез
Вильямсона) и сложные эфиры
O Na + Br- -CH2–CH3 ®
O–CH2–CH3(этилфениловый
эфир) + NaBr
и сложные эфиры
O
II
O
II
O H +
Cl- -C–CH3(хлорангидрид укс.кислоты)
® O–
C–CH3(фениловый эфир укс.кислоты) +
HCl
2. Реакции бензольного
кольца. Гидроксильная группа у фенолов
является очень сильным орто- и
пара-ориентантом. Реакции замещения
атомов водорода в бензольном кольце
протекают в более мягких условиях, чем
у бензола. При бромировании и нитровании
могут быть получены 2,4,6-тризамещенные
производные
OH
OH
OH
+ 3H2O
3HNO3
¬–––
H2SO4
3Br2
–––®
+
3HBr
NO2
Br
2,4,6 –
тринитро-
фенол
(пикриновая
кислота)
2,4,6–трибром-
фенол
3. Гидрирование.
OH
OH
3H2
––®
Ni
(циклогексанол)
Применение
Фенол
применяется при производстве
фенолформальдегидных смол, в
фармацевтической промышленности и как
антисептик (карболовая кислота).
Гидрохинон
(1,4-диоксибензол) – проявитель в
фотографии.
ОДНОАТОМНЫЕ НЕПРЕДЕЛЬНЫЕ СПИРТЫ (АЛКЕНОЛЫ И АЛКИНОЛЫ)
Непредельные спирты (алкенолы и алкинолы) — производные непредельных углеводородов, в молекулах которых водородный атом замещен на гидроксильную группу.
Строение. Непредельные спирты имеют различное строение. В одном случае гидроксильная группа находится непосредственно при углеродном атоме с двойной связью (I), в другом — при углероде, не связанном двойной связью (II):
Н2С==СН—ОН Н2С==СН—СН2—ОН виниловый спирт аллиловый спирт (I) (II)
Электронная формула винилового спирта имеет вид:
<div style="height: 14px;overflow:hidden"><div style="margin-top: 14px;"><a href="http://chemistry.narod.ru/">Мир химии.</a></div></div>
H H .. .. .. C : : C : O : H .. .. H
Спирты типа (I) — этиленовые спирты — неустойчивы и в свободном состоянии не встречаются. В растворах они могут существовать непродолжительное время, изомеризуясь затем в более стабильную форму — альдегиды или кетоны (правило А. Л. Элътекова):
O H2C==CH==OH ® H3C—C//—H виниловый уксусный спирт альдегид (этенол)
H2C==C—CH3 ® H3C—C—CH3 | || | _HO O пропенол-2 ацетон (пропанон)
Номенклатура и изомерия. По систематической номенклатуре непредельные спирты называют как производные соответствующего непредельного углеводорода с добавлением суффикса -ол. Место гидроксильной группы и кратной связи указывают цифрой. При этом предпочтение отдают гидроксилу:
СН3 | H3C—CH==C—CH2—OH HCєєC—CH2—OH 2-метилбутен-2-ол-1 пропин-2-ол-1
За некоторыми спиртами сохраняются тривиальные названия, например виниловый спирт, аллиловый спирт, пропаргиловый спирт и др.
Структурная изомерия связана со строением углеродной цепи и положением в ней кратной связи и гидроксила:
Н2С==CН—СH2—ОН Н2С==С—СН3 | OH пропенол-1 пропенол-2
Получение. 1. Непредельные спирты можно получать, вводя гидроксильную группу в соединение, имеющее кратную связь:
t Н2С==СН—СН3 + Cl2 ® Н2С==СН—СН2Сl + НС1 пропилен хлористый аллил t Н2С==СН—СН2С1 + NaOH ® Н2С=СН—CН2OН + NaCI аллиловьш спирт
2. Конденсацией ацетилена с формальдегидом получают пропаргиловый спирт
O // НСєєСН + Н—С ® HСєєC—СН2—ОН \ H пропаргиловый спирт
Химические свойства. Виниловый спирт — очень нестойкие соединение, но его производные, например, простые и сложные эфиры — довольно устойчивы:
H2C==CH—O—C2H5 Н2С=СН—O—СОСН3 винилэтиловый винилацетат эфир (простой (сложный эфир) эфир)
Винилацетат легко полимеризуется с образованием полимера — поливинилацетата (ПВА):
nH2C=СН ® й —CH2—CH— щ | | | | OCOCH3 л OCOCH3 ы n поливинилацетат
Поливинилацетат при омылении превращается в поливиниловый спирт — устойчивый (в отличие от винилового спирта) полимерный продукт:
й —CH2—CH— щ HCl й —CH2—CH— щ | | | —————® | | | + nCH3COOH л OCOCH3 ы n (сп. р—р) л OH ы n поливинилацетат поливиниловый спирт
Поливинилацетат и поливиниловый спирт находят широкое применение. Например, на основе поливинилового спирта получают синтетическое волокно винол. Жидкие низкомолекулярные продукты полимеризации винилацетата или растворы поливинилацетата в органических растворителях, а также его водные дисперсии используют в качестве клеев (клей ПАВ), обладающих высокой адгезией.
Непредельные спирты типа (II), имея в молекуле кратную связь и гидроксильную группу, проявляют свойства спиртов и непредельных соединений. Например:
Br2 |——® H2CB—CHBr—CH2OH | H2 2,3-дибромпропанол-1 |——® H3C—CH2—CH2—OH | H2O+O пропанол-1 |——® H2COH—CHOH—CH2OH | HCl глицерин H2C==CH—CH2—OH —|——® H3C—CHCl—CH2OH | Na 2-хлорпропанол-1 |——® H2C==CH—CH2—ONa | C2H5OH алкоголят |——® H2C==CH—CH2—O—C2H5 | CH3COOH этилаллиловый эфир |——® CH3—COOCH2—CH==CH2 аллилацетат
Непредельные спирты, содержащие тройную связь, обладают свойствами ацетилена и спирта:
Ag2O |——® Ag—CєєC—CH2OH + H2O | ацетиленидкар- HCєєC—CH2OH —| бинол | PCl5 |——® HCєєC—CH2Cl + POCl3 + HCl 3-хлорпропин-1
Отдельные представители. Виниловый спирт (этенол) CH2==CH—OH в свободном состоянии не встречается. О его устойчивых производных сказано выше.
Аллиловый спирт (пропенол-1) Н2С=СН—СН2OH — бесцветная жидкость с неприятным запахом, т.кип. 97,5 oС. Растворим в воде. Является промежуточным продуктом при синтезе глицерина. Используют в парфюмерной промышленности.
Пропаргиловый спирт (пропин-2-ол-1) HСєєСН2ОН — бесцветная жидкость с неприятным запахом, кипящая при 114,7 °С. Является промежуточным продуктом при получении аллилового спирта и глицерина, а также в производстве дивинила.
ДВУХАТОМНЫЕ СПИРТЫ (АЛКАНДИОЛЫ, ИЛИ ГЛИКОЛИ)
Двухатомные спирты (гликоли) содержат в молекуле две гидроксильщ
группы при разных углеродных атомах.
<div style="height: 14px;overflow:hidden"><div style="margin-top: 14px;"><a href="http://chemistry.narod.ru/">Мир химии.</a></div></div>
Общая формула этих спиртов CnH2n(OH)2. Первым представителе двухатомных спиртов является этиленгликоль (этандиол) НОСН2—СН2ОН.
Номенклатура. Чтобы назвать эти спирты по систематической номенклатуре, к названию алкана добавляют суффикс -диол, а цифрам указывают место гидроксилов в углеродной цепи:
Н3С—СН2—СН—СН2ОН
|
ОН
бутандиол-1,2
По рациональной номенклатуре названия двухатомных спиртов можно составить из названий соответствующих алкеновых углеводородов с добавлением слова гликоль:
НОСН2—СН2ОН НОСН2—СНОН—СН3
этиленгликоль пропиленгликоль
(этандиол) (пропандиол-1,2)
Изомерия этих спиртов зависит от строения углеродной цепи и расположения в ней двух гидроксильных групп (a-, b-, g-гликоли и т.д.):
Н3С—СНОН—СН2ОН HOCH2—CH2—CH2OH
пропандиол-1,2 пропандиол-1,3
(a-гликоль) (b-гликоль)
Получение. В методах получения двухатомных и одноатомных спиртов много общего. Так, двухатомные спирты можно получать:
1. Гидролизом дигалогенопроизводных:
Н3С—СН—СН2Сl + 2Н2О ® Н3С—СН—СН2ОН + 2HСl
| |
Сl ОН
1,2-дихлорпропан пропандиол-1,2
2. Окислением этиленовых углеводородов:
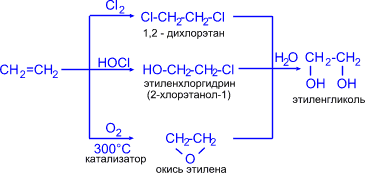
Н2С==СН2 + Н2О + O ® HOCH2—CH2OH
этилен этиленгликоль
3. Гидратацией оксида этилена:
Н2С—CH2 +Н2О ® НОСН2—СН2ОН
\ /
O
оксид
этилена
Физические свойства. Низшие гликоли (от греч. glykys — сладкий) — сиропообразные, сладкие на вкус, растворимые в воде вещества. Гликоли кипят при более высокой температуре и имеют большую плотность, чем соответствующие им (с тем же числом углеродных атомов) одноатомные спирты. Это объясняется присутствием второй гидроксильной группы, что ведет к образованию дополнительных водородных связей.
Химические свойства. Двухатомные спирты в химических реакциях могут реагировать одной или двумя гидроксильными группами.
1. Образование гликолятов. В отличие от одноатомных спиртов двухатомные легко вступают во взаимодействие не только со щелочными металлами, но и с оксидами и гидроксидами тяжелых металлов. Образующиеся вещества называют гликолятами:
H
|
CH2OH H2C—O\ еO—CH2
2 | + Cu(OH)2 ® | Cu | + 2H2O
CH2OH H2C—Oд \O—CH2
|
H
этилен- гликолят меди (комп-
-гликоль лексное соединение)
2. Реакции дегидратации. Эти реакции, как известно, могут быть внутримолекулярными и межмолекулярными:
а) внутримолекулярная дегидратация:
H2C—CH—OH ® [H2C==CH—OH] ® H3C—C==O
| | -H2O \
OH H H
этилен- виниловый уксусный
гликоль спирт альдегид
б) межмолекулярная дегидратация:
HOCH2—CH2OH + HOCH2—CH2OH ® HOCH2—CH2—O—CH2—CH2OH
-H2O диэтилентликоль
В случае (б) процесс может идти и дальше — с образованием полимера:
nHOCH2—CH2OH ® [—CH2—CH2—O—]n + nH2O
При межмолекулярной дегидратации образуются не только линейные но и циклические продукты:
/O\
H2C—OH HO—C H2C CH2
| + | ® | | + 2H2O
H2C—OH HO—CH2 H2C CH2
\O/
1,4-диоксан
Диоксан используют в качестве растворителя (осторожно: токсичен).
3. Образование простых и сложных эфиров. Взаимодействуя спиртами или кислотами (органическими или неорганическими), гликоли образуют простые и сложные эфиры:
H+
HOCH2—CH2OH + HO—C2H5 —® HOCH2—CH2—O—C2H5 + H2O
этилцеллозольв
(простой эфир)
H2C—OH H+ H2C—O—NO2
| + 2HNO3 —® | + 2H2O
H2C—OH H2C—O—NO2
динитроэти-
ленгликоль
(сложный эфир)
4. Замена гидроксильных групп на галоген:
H2C—OH H2C—Cl
| + HCl ® | + H2O
H2C—OH H2C—Cl
этилен-
хлоргидрин
5. Окисление. При окислении двухатомные спирты образуют ряд промежуточных продуктов. Например, при окислении этиленгликоля образуются: гликолевый альдегид (НОСН2—СНО), глиоксаль (ОНС—СНО), гликолевая кислота (НОСН2—СООН), глиоксалевая кислота (ОНС—СООН) и щавелевая кислота (HOOС—COOH). Щавелевая кислота обычно является предпоследним продуктом окисления многих органических соединений.
Отдельные представители.
Этиленгликоль (этандиол) HOCH2—CH2OH — вязкая бесцветная жидкость, сладкая на вкус, т. кип. 198 °С. Ядовит. Гигроскопичен. Сильно понижает температуру замерзания воды, поэтому этиленгликоль используют для приготовления антифриза (водный раствор, содержащий 25 % этиленгликоля, замерзает при -12 °С, а содержащий 60 % — при -49 °С).
Этиленгликоль широко используют в химической промышленности. Так, из этиленгликоля и терефталевой кислоты получают полимер, который идет на изготовление синтетического волокна лавсан.
Этиленгликольдинитрат — сильное взрывчатое вещество, заменяющее тринитрат глицерина (нитроглицерин).
1,2-Пропиленгликоль (пропандиол-1,2) H2C—CHOH—CH2OH — жидкость с т. кип. 187,4 °С, смешивается с водой и многими органическими растворителями. Гигроскопичен. Используют для получения некоторых полимеров, входит в состав антифризов, гидравлических тормозных жидкостей. Хладоагент.
ТРЕХАТОМНЫЕ СПИРТЫ (АЛКАНТРИОЛЫ, ИЛИ ГЛИЦЕРИНЫ)
Трехатомиые спирты содержат три гидроксильные группы при разных углеродных атомах.
<div style="height: 14px;overflow:hidden"><div style="margin-top: 14px;"><a href="http://chemistry.narod.ru/">Мир химии.</a></div></div>
Общая формула СnН2n - 1(ОН)3.
Первый и основной представитель трехатомных спиртов — глицерин (пропантриол-1,2,3) HОСН2—СHOH—СН2ОН.
Номенклатура. Для названия трехатомных спиртов по систематической номенклатуре необходимо добавить к названию соответствующего алкана суффикс -триол.
Изомерия трехатомных спиртов, как и двухатомных, определяется строением углеродной цепи и положением в ней трех гидроксильных групп.
Получение. 1. Глицерин можно получать гидролизом (омылением) растительных или животных жиров (в присутствии щелочей или кислот):
O H2C—O—C//—C17H35 H2C—OH | O | HC—O—C//—C17H35 + 3H2O ® HC—OH + 3C17H35COOH | О | H2C—O—C//—C17H35 H2C—OH триглицерид (жир) глицерин стеариновая кислота
Гидролиз в присутствии щелочей приводит к образованию натриевой или калиевой солей высших кислот — мыла (поэтому этот процесс называется омылением).
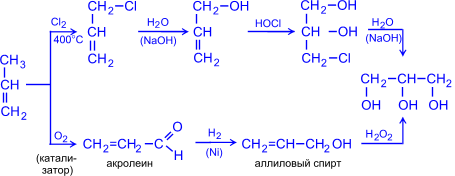
2. Синтез из пропилена (промышленный способ):
CH3 CH2Cl | Cl2, 450-500 oC | H2O (гидролиз) CH ————® CH ————® || —HCl || —HCl CH2 CH2 пропилен хлористый аллил
CH2OH HOCl (гипо- CH2OH CH2OH | хлорирование) | H2O (гидролиз) | ®CH ————® CHOH ————® CHOH || —HCl | —HCl | CH2 CH2CL CH2OH аллиловый монохлор- глицерин спирт гидрин глицерина
Химические свойства. По химическим свойствам глицерин во многом напоминает этиленгликоль. Он может реагировать одной, двумя или тремя гидроксильными группами.
1. Образование глицератпов. Глицерин, вступая в реакции со щелочными металлами, а также с гидроксидами тяжелых металлов, образует глицераты:
H | H2С—OH H2C—Oж /O— CH2 | | Cu | 2 HC—OH + Cu(OH)2 ® HC—O/ гO— CH + 2H2O | | H/ | H2C—OH H2C—OH HO—CH2 глицерат меди
2. Образование сложных эфиров. С органическими и минеральными кислотами глицерин образует сложные эфиры:
H2C—OH HO—NO2 H2C—O—NO2 | H+ | HC—OH + HO—NO2 —® HC—O—NO2 + 3H2O | | H2C—OH HO—NO2 H2C—O—NO2 глицерин азотная тринитрат кислота глицерина (нитроглицерин)
H2C—OH HO—OC—CH3 H2C—O—COCH3 | H+ | HC—OH + HO—OC—CH3 —® HC—O—COCH3 + 3H2O | | H2C—OH HO—OC—CH3 H2C—O—COCH3 глицерин уксусная триацетат кислота глицерина
3. Замена гидроксильных групп на галогены. При взаимодействии глицерина с галогеноводородами (НС1, НВr) образуются моно- и дихлор- или бромгидрины:
H2C—Cl H2C—Cl | | H2C—OH ® HC—OH ® HC—Cl щ CH2\ | HCl | | HCl | | | KOH | O HC—OH ——| H2C—OH —— | H2C—OH|———® CH/ | -H2O | -H2O | | -KCl, -H2O | H2C—OH ® H2C—OH ® H2C—Cl ы CH2Cl | | HC—Cl HC—OH | | H2C—OH H2C—Cl монохлор- дихлор- эпихлор- гидрины гидрины гидрин
4. Окисление. При окислении глицерина образуются различные продукты, состав которых зависит от природы окислителя. Начальными продуктами окисления являются: глицериновый альдегид HOCH2—CHOH—CHO, дигидроксиацетон НОСН2—СО—CН2ОН и конечный продукт (без разрыва углеродной цепи) — щавелевая кислота НООС—СООН.
Отдельные представители. Глицерин (пропантриол-1,2,3) НОСН2—СНОН—СН2OН - вязкая гигроскопическая нетоксичная жидкость (т. кип. 290 °С с разл.), сладкая на вкус. Смешивается с водой во всех соотношениях. Используют для производства взрывчатых веществ, антифризов и полиэфирных полимеров. Находит применение в пищевой (для изготовления кондитерских изделий, ликеров и т.д.), текстильной, кожевенной и химической промышленности, в парфюмерии.
ВЫСШИЕ СПИРТЫ
К высшим спиртам (техническое название высшие жирные спирты - ВЖС) относят такие алифатические спирты, которые в радикале содержат свыше 10 углеродных атомов.
Получение. В свободном состояние эти спирты практически не встречаются. В природе они распространены в основном в виде сложных эфиров органических кислот (воски, кашалотовый жир и др.), из которых могут быть легко выделены. Однако наибольшее значение имеют синтетические способы получения. Основные из них:
1. Восстановление высших карбоновых кислот. Эту реакцию проводят в присутствии катализатора при нагревании и давлении:
кат. R—COOH + 2H2 —® R—CH2OH + H2O
<div style="height: 14px;overflow:hidden"><div style="margin-top: 14px;"><a href="http://chemistry.narod.ru/">Мир химии.</a></div></div>
2. Получение из алкенов (оксо-синтез). Этот способ нашел широкое применение. Вначале из алкенов (содержащих свыше 10 углеродных атомов) получают альдегиды, а затем гидрированием их переводят в спирты:
O // H2 R—CH==CH2 + CO + H2 —® R—CH2—CH2—C—H —® R—CH2—CH2—CH2OH алкен альдегид высший спирт
3. Прямое окисление высших алканов (парафинов). Этот метод в является наиболее экономически выгодным и широко используется в настоящее время.
При окислении алканов образуется сложная смесь промежуточных и конечных продуктов, прежде всего высших кислот и спиртов (C8-C25 )
Алкан Ї [0] ——Гидропероксиды—— Ї [0] Ї [0] Спирты ———————® Кетоны ——® Карбоновые кислоты
Высокая реакционная способность высших спиртов намного снижает возможность получения их в качестве основного продукта. Поэтому по мере образования спиртов их переводят в сложные эфиры (действием борной кислоты), которые являются более устойчивыми к окислению. Эти эфиры затем разлагают водой; борную кислоту возвращают в производство, а спирты (смесь) перегонкой разделяют на фракции. Для уменьшения скорости окисления спиртов химический процесс проводят в азотно-кислородной' смеси, содержащей 3—4 % кислорода. ВЖС, полученные прямым окислением алканов, во много раз дешевле спиртов, полученных из кашалотового жира или из природных соединений (эфирных масел и т.д.).
Физические свойства. Спирты C6—С11 — жидкости, а с большим числом атомов углерода — твердые вещества. ВЖС растворяются в этаноле, эфире. Растворимость в воде уменьшается с увеличением молекулярной массы. Огнеопасны. С воздухом образуют взрывоопасные смеси. Однако взрывоопасность уменьшается с увеличением молекулярной массы.
Химические свойства. ВЖС в принципе не отличаются от низкомолекулярных спиртов. Однако длинный углеводородный радикал оказывает существенное влияние на их свойства. Так, эти спирты медленнее реагируют с металлическим натрием, чем обычные спирты, а полученные алкоголяты могут быть в виде раствора, взвеси и даже сухого порошка.
ВЖС легче окисляются, чем низкомолекулярные. Они начинают окисляться уже при стоянии на воздухе, особенно на свету.
Отдельные представители. Важнейшими из природных ВЖС являются гераниол С10Н17ОН, лауриловый спирт C12H15OH, цетиловый спирт С16H33ОН, олеиловый спирт С18Н35ОН, стеариловый спирт С18Н37ОН, цериловый спирт С26Н53ОН, мирициловый спирт С31Н63OH. Последние два спирта (особенно мирициловый) входят в состав пчелиного воска.
ВЖС применяют во многих отраслях промышленности — горнорудной, текстильной, кожевенной, парфюмерной и др. Эти спирты служат сырьем для производства многочисленных химических продуктов. Особенно большие количества ВЖС идут на производство поверхностно-активных веществ (ПАВ) — алкилсульфатов, которые являются главной составной частью синтетических моющих средств.
СПИРТЫ ВЫСШЕЙ АТОМНОСТИ (ПОЛИОЛЫ, ИЛИ САХАРНЫЕ СПИРТЫ)
Спирты, содержащие в молекуле свыше трех гидроксильных групп, называют спиртами высшей атомности.
К таким спиртам относят четырехатомные — тетриты С4H6(ОН)и, пятиатомные — пентиты С5Н7(ОН)5 и шестиатомные — гекситы С6Н8(ОН)6.
<div style="height: 14px;overflow:hidden"><div style="margin-top: 14px;"><a href="http://chemistry.narod.ru/">Мир химии.</a></div></div>
Известным представителем четырехатомных спиртов является эритрит, пятиатомных — арабит и ксилит, а наиболее распространенными шестиатомными спиртами являются сорбит, дульцит и маннит. Эти спирты генетически связаны с простыми углеводами — моносахаридами (тетрозами, пентозами и гексозами) и могут быть получены при их восстановлении.
Спирты высшей атомности (сахарные спирты) — бесцветные, сладкие вещества. Большинство из них легко растворяются в воде. Называют эти спирты по тривиальной номенклатуре: в названиях соответствующих углеводов заменяют суффикс -оза на -ит.
Отдельные представители.
Эритрит НОСН2—(СНОН)2—СН2OН. Растворим в воде. Содержится в некоторых водорослях и лишайниках. Получают восстановлением эритрозы (тетрозы). Применяют для получения взрывчатых веществ, быстровысыхающих масел, эмульгаторов.
D-Aрабит НОСН2—(СНОH)3—CН2ОН. Хорошо растворим в воде, спирте. Встречается в свободном виде в лишайниках и в некоторых грибах. Получают восстановлением D-арабинозы.
Ксилит НОСН2—(СНОH)3—CН2ОН. Растворяется в воде, спирте, уксусной кислоте. Получают восстановлением ксилозы. Сладкий на вкус. Используют вместо сахара (сахарозы) в производстве кондитерских изделий для больных диабетом и ожирением. Применяют при получении олиф, ПАВ.
D-Сорбит (D-глюцит) НОСН2— (СНОН)4—СНииOН. Хорошо растворяется в воде и горячем спирте. Имеет сладкий вкус. Сорбитом богаты ягоды рябины, сок вишен, слив, яблок. Получают гидрированием D-глюкозы. Заменяет сахар (сахарозу) для больных диабетом.
Дульцит (галактит) HOСН2— (СНОH)4—СН2OН. Плохо растворяется в воде и спирте. В природе находится в различных растениях (жасмине, морских водорослях) и в дрожжах. Особенно много в высохшем соке некоторых тропических растений. Получают восстановлением D-галактозы.
D-Mаннит НОСН2— (СНОН)4—СН2OН. Имеет сладкий вкус, растворим в воде, плохо — в спирте. D-Маннит — основной компонент манны — застывших соков ясеня и платана. D-Маннит получают восстановлением D-фруктозы. Используют в медицине и в парфюмерии.
Спирты
или алкоголи. — Этим именем называют большую группу органических соединений, которые имеют сходство в химическом отношении с винным спиртом и заключают в своем составе углерод, водород и кислород. Все они суть гидроксильные производные углеводородов или, другими словами, углеводороды, в которых один или несколько атомов водорода замещены гидроксильной группой OH. В зависимости от количества гидроксильных групп в частице, Спирты разделяются на одноатомные, двухатомные и т. д. Девятиатомные Спирты представляют Спирты высшей атомности из известных в настоящее время. Углеводороды разделяются на гомологические ряды предельных, этиленовых, ацетиленовых, ароматических и т. д. Спирты в свою очередь разделяются на те же ряды, смотря по углеводороду, от которого можно произвести данный Спирты заменой атома водорода гидроксильной группой. Названием Спирты обозначали сперва только винный Спирты Дюма и Пелиго распространили это название на древесный Спирты, стоящий по свойствам в близком отношении к винному Спирты, и оно теперь распространено на весьма большую группу соединений. В этом смысле имело большое значение распространение понятия Спирты на глицерины и гликоли, причем была введена идея о многоатомных Спирты Ближайший большой шаг в истории развития Спирты сделал Кольбе, который из теоретического рассмотрения окисления их установил первичность, вторичность и третичность Спирты Огромное значение для этого взгляда имели затем открытия Фриделя и Бутлерова. Фридель приготовил первый вторичный Спирты Бутлеров характеризовал открытый им триметилкарбинол, как третичный Спирты Первичными Спирты называют Спирты общей формулы R.CH 2 OH, вторичными — R.CH(OH)R' и третичными — R.C(OH)R'R", где R, R' и R" — любые углеводородные радикалы. Следовательно, в первичных Спирты при атоме углерода, связанном с гидроксильной группой, находятся два атома водорода, во вторичных Спирты — один атом водорода, в третичных — атом углерода, соединенный с гидроксильной группой, непосредственно связан только с углеводородными радикалами. Название Спирты обуславливается названием радикалов, с которыми соединена гидроксильная группа; так, например, CH 3.CH2.OH — этиловый Спирты (первичный), CH 3.CH2.CH2.OH — пропиловый Спирты (первичный), (CH3)2 CH.OH — изопропиловый Спирты (вторичный) и т. д. По другой, более рациональной, номенклатуре Спирты, древесный Спирты СН 3 OН называют карбинолом, а все остальные названия слагаются из названий углеводородных радикалов, которые замещают водороды метиловой группы карбинола, с приставкой к названиям этих радикалов слова "карбинол", например: CH 3.CH2 OH — метилкарбинол; CH 3.CHOH.C2H5 — метилэтилкарбинол; CH 3.CHO(CH3)2 — триметилкарбинол и т. д. Женевским конгрессом постановлено называть Спирты по наименованию углеводорода, из которого замещением атома водорода гидроксильной группой происходит данный Спирты, и прибавлять к имени углеводорода окончание "ол" в случае замещения одного атома водорода, "диол", "триол" и т. д. в случае замещения двух, трех и т. д. атомов водорода гидроксильными группами, например: CH 3 OH назовется метанол; C 2H5 OH — этанол; C 2H4(OH)2 — этандиол и т. д. При последней системе названий Спирты положение гидроксильной группы обозначают цифрами, считая атомы углерода главной цепи по порядку, например: CH 3.CHOH.CH2 СН 2.СН 2.СН 3 будет называться гексанол 2. Эти номенклатуры Спирты применяются главным образом к одноатомным Спирты Многоатомные Спирты носят свои специальные названия: двухатомные Спирты — гликоли и пинаконы (см.); трехатомные Спирты — глицерины (см.) и т. п. (см. Пентэритрит, Эритрит, Кверцит, Рамнит, Дульцит, Маннит, Сорбит, Талит, также см. Глюкозы). Кроме того, как одноатомные, так и многоатомные гидроксильные производные углеводородов ряда бензола, заключающие гидроксильные группы в бензольном кольце, называются фенолами (см.). Здесь будут рассмотрены только одноатомные собственно Спирты
Некоторые физические свойства более известных предельных нормальных Спирты сопоставлены в следующей таблице:
Название Спирты |
Состав |
Температура плавления |
Температура кипения |
Удельный вес |
|
Метиловый, карбинол, метанол, древесный Спирты |
CH3OH |
— |
66° |
0,812 |
при 0° по отношению к воде при 0° |
Этиловый, метилкарбинол, этанол, винный Спирты |
C2H5OH |
—130° |
78° |
0,806 |
|
Пропиловый, этилкарбинол, пропанол |
C3H7OH |
— |
97° |
0,817 |
|
Бутиловый, пропилкабинол, бутанол |
C4H9OH |
— |
117° |
0,823 |
|
Амиловый, бутилкарбинол, пентанол |
C5H11OH |
— |
138° |
0,829 |
|
Гексиловый, амилкабинол, гексанол |
C6H13OH |
— |
157° |
0,833 |
|
Гептиловый, гексилкарбинол, гептанол |
C7H15OH |
— |
176° |
0,836 |
|
Октиловый, гептилкарбинол, октанол |
C8H17OH |
— |
195° |
0,839 |
|
Нониловый, октилкарбинол, нонанол |
C9H19OH |
—5° |
213° |
0,842 |
|
Дециловый, нонилкарбинол, деканол |
C10H21OH |
+7° |
231° |
0,839 |
при темп. плавления по отношению к воде при 4° |
Додециловый, ундецилкарбинол, додеканол |
C12H25OH |
24° |
143° (при 15 мм) |
0,831 |
|
Тетрадециловый, тридецилкарбинол, тетрадеканол |
C14H29OH |
38° |
167° (при 15 мм) |
0,824 |
|
Гексадециловый, пентадецилкарбинол, гексадеканол, эталь, цетиловый Спирты |
C16H33OH |
50° |
190° (при 15 мм) |
0,818 |
|
Октодециловый, гептадецилкарбинол, октадеканол |
C18H37OH |
59° |
211° (при 15 мм) |
0,813 |
|
Предельные Спирты — нейтральные и бесцветные вещества. Низшие члены предельных Спирты — легкоподвижные жидкости с характерным запахом и жгучим вкусом, смешивающиеся с водой во всех пропорциях. Из водных растворов могут быть выделены посредством легкорастворимых в воде солей, например поташом. Растворимость их в воде быстро уменьшается с увеличением частичного веса; тогда как первичный пропиловый Спирты смешивается с водой во всех пропорциях, — для растворения нормального бутилового Спирты нужно уже 12 частей воды. Предельные Спирты, заключающие от 4 до 11 атомов углерода в частице — маслянистые жидкости, не смешивающиеся с водой. Предельные Спирты с большим числом атомов углерода в частице — твердые вещества, при обыкновенной температуре кристаллизующиеся из винного Спирты или эфира. Высшие члены ряда предельных Спирты — без запаха и вкуса. Предельные Спирты с еще большим числом атомов углерода в частице, цериловый C 27H55 OH и мирициловый C 30H61 OH, находятся в различных сортах воска. Первый плавится при 76—79° и второй при 86°. Из приведенной таблицы видно, что разница температур кипения у рядом стоящих Спирты до C 10 колеблется от 18° до 22°, т. е. приблизительно одна и та же. В следующей таблице сопоставлено различие физических свойств для изомерных Спирты пропиловых, бутиловых и амиловых.
Название Спирты |
Формула строения |
Температура кипения |
Удельный вес d 20°/4° |
Коэффициент преломления μα |
Пропиловые Спирты C 3H8O: |
|
|
|
|
Первичный |
CH3.CH2.CH2OH |
97° |
0,804 |
1,3835 |
Вторичный |
CH3CHOH.CH3 |
81° |
0,789 |
1,3757 |
Бутиловые Спирты C 4H10O: |
|
|
|
|
Нормальный первичный |
C2H5.CH2.CH2OH |
117° |
0,810 |
1,3971 |
Нормальный вторичный |
C2H5.CHOH.CH3 |
100° |
— |
— |
Изобутиловый первичный |
(CH3)2CH.CH2OH |
107° |
0,806 |
1,3940 |
Третичный |
(CH3)2COH.CH3 |
83° |
0,789 |
1,3857 |
Амиловые Спирты C 5H12O: |
|
|
|
|
Нормальный первичный |
C2H5.CH2.CH2.CH2OH |
138° |
0,815 |
— |
Изобутилкарбинол |
(CH3)2CH.CH2.CH2OH |
131° |
0,810 |
1,4051 |
Вторичный бутилкарбинол |
CH3.CH(C2H5).CH2OH |
128° |
— |
— |
Метилпропилкарбинол |
C2H5.CH2.CHOH.CH3 |
119° |
— |
— |
Метилизопропилкарбинол |
(CH3)2CH.CHOH.CH3 |
112,5° |
— |
— |
Диэтилкарбинол |
C2H5.CHOH.C2H5 |
117° |
— |
— |
Диметилэтилкарбинол |
(CH3)2COH.C2H5 |
102° |
— |
— |
Третичные Спирты обладают низшей температурой кипения, чем их изомеры, и, наоборот, высшей температурой плавления. Из четырех бутиловых Спирты только третичный получен твердым с температурой плавления 25°. Из семи амиловых Спирты третичный затвердевает легче других при —12°, тогда как изобутиловый застывает только при —134°. Кроме структурных изомеров, обусловленных изомерией радикалов и положением гидроксильной группы, в Спирты имеются случаи геометрической или оптической изомерии (см. Амильные спирты, Стереохимия).
Химическая натура Спирты обуславливается, главным образом, способностью гидроксильной группы к реакциям. Водород гидроксильной группы способен к разнообразным замещениям. Так, щелочные металлы, действуя на Спирты, выделяют водород, образуя алкоголяты, которые при действии воды дают обратно Спирты, например:
C2H5OH + Na = C2H5ONa + H;
C2H5ONa + H2O = C2H5OH + NaHO.
По отношению к кислотам Спирты напоминают основания в неорганической химии. При действии кислородных кислот на Спирты образуются сложные эфиры и выделяется вода за счет водорода гидроксильной группы, например:
C2H5OH + OHNO2 = C2H5ONO2 + H2O.
Реакция эта протекает не нацело, вследствие наступления обратной реакции. При действии хлорангидридов кислот на Спирты выделяется хлористый водород за счет водорода гидроксильной группы и образуется сложный эфир:
C2H5OH + ClC2H2O = HCl + C2H5.O.C2H3O.
Галоидные соединения фосфора при действии на Спирты замещают гидроксильную группу галоидом, например:
C2H5OH + PCl5 = C2H5Cl + HCl + POCl3.
Те же галоидопроизводные Спирты получаются при действии концентрированного раствора галоидоводородной кислоты на Спирты при нагревании, например: C 2H5OH+HI=C2H5I+H2 O. Гидроксильная группа может быть заменена аммиачным остатком при продолжительном нагревании Спирты с хлористым цинк-аммонием при 250—260°, например:
C4H9OH + NH3 = H2O + C4H9NH2;
2C4H9OH + NH3 = 2H2O + (C4H9)2NH;
3C4H9OH + NH3 = 3H2O + (C4H9)3N.
Под влиянием отнимающих воду веществ, как серная кислота, хлористый цинк и др., при нагревании, гидроксильная группа Спирты с соседним к ней атомом водорода отщепляется и образуется углеводород этиленного ряда, например: СН 3 СН 2 OН—Н 2 O=CН 2.СН 2. Реакция эта легче идет для третичных и вторичных Спирты, чем для первичных. Присутствие гидроксильной группы в Спирты является причиной сходства большинства реакций Спирты с реакциями воды. Сходство это с водой распространяется и на реакции соединения Спирты Подобно кристаллизационной воде, Спирты соединяются с некоторыми солями и щелочами; так, например, хлористый кальций образует соединение с метиловым Спирты СаСl 2 4СH 3 ОН, с этиловым Спирты CaCl 24C2H5 OH. Поэтому при работах со Спирты нельзя их сушить хлористым кальцием, как другие органические соединения; для этой цели употребляют плавленый поташ. Обезвоживание Спирты окисью кальция или окисью бария более совершенно, но иногда связано с некоторой потерей спирта. Реакция окисления Спирты является весьма важной для установления строения их. Окислители легко действуют на Спирты Для первичных Спирты в первой стадии окисления получаются альдегиды, например: СH 3 СH 2 ОН+О=СН 3.СНО+H 2 O. При дальнейшем окислении образуются кислоты, содержащие в частице столько же атомов углерода, сколько их было в Спирты, например:
СН 3.CH2 OН + О 2 = СН 3.СOОН + H 2O.
Вторичные Спирты при окислении дают кетоны, например:
СН 3.СНОН.СН 3 + О = СН 3.СО.СН 3 + H2O.
При дальнейшем окислении происходит распадение частицы кетона по карбонильной группе и образуются две кислоты, заключающие каждая меньшее число атомов углерода, чем было в Спирты, например:
СН 3.СНОН.СH 3 + 2О 2 = СН 3.СООН + CH 2O2 + H2O.
При третичных Спирты вовсе не образуется продукта окисления с тем же числом атомов углерода, какое имел сам Спирты, а получаются кетоны и кислоты, заключающие меньше атомов углерода в частице, чем было в Спирты Продукты, получаемые при окислении Спирты дают возможность также определять строение радикалов, входящих в состав Спирты Кроме реакции окисления, различие между упомянутыми тремя классами Спирты выражается в способности первичных и вторичных Спирты давать алкоголяты при нагревании с окисью бария и отсутствие этой реакции у третичных Спирты (Н. Меншуткин). Первичные Спирты быстрее, чем вторичные, а вторичные быстрее третичных, образуют сложные эфиры при действии кислот. Предельное количество образующегося сложного эфира для первичных Спирты больше, чем для вторичных, а для вторичных больше, чем для третичных Спирты (Н. Меншуткин; см. Эфиры сложные). Следующими реакциями можно с малой затратой материала устанавливать строение Спирты (В. Мейер). Действием йодисто-водородной кислоты Спирты переводятся в йодюр (см. выше). При перегонке йодюра Спирты с азотистокислым серебром образуется нитросоединение, например:
CH3CH2I + AgNO2 = CH3.CH2NO2 + AgI.
Продукты этих реакций отгоняют и к отогнанной жидкости прибавляют азотистокислого калия и едкого кали. Если прибавка к этой смеси слабой серной кислоты вызовет красное окрашивание, то йодюр, а следовательно, и исходный Спирты был первичный. Синяя окраска показывает, что Спирты был вторичный. Отсутствие окраски указываете на третичный Спирты Эта реакция получается для первичных Спирты до октилового; для вторичных Спирты она прекращается с членом C 5H12 O. Вторичный йодистый гексил не дает уже никакого окрашивания. При действии хлора на первичные Спирты на холоде образуются хлорзамещенные Спирты; при нагревании — охлоренные альдегиды и ацетали. Действием хлора на вторичные Спирты образуются охлоренные кетоны. Третичные Спирты при действии брома дают бромюры типа С nH2nBr2. Предельные Спирты встречаются в природе в виде сложных эфиров. Многие эфирные масла, получаемые перегонкой с водяным паром различных частей растений, заключают такие эфиры, обмыливанием которых получаются Спирты Большее значение имеет для получения Спирты образование их при процессах брожения (см. это слово, также Винокурение, Виноделие, Пиво).
Общие способы получения предельных Спирты 1) Из галоидопроизводных предельных углеводородов при нагревании их с большим количеством воды, например: C 2H5Cl+H2O=C2H5 OH+HCl. Реакция эта лучше идет для третичных галоидопроизводных, чем для первичных. Чтобы не было обратной реакции, прибавляют окиси свинца. В присутствии окиси серебра реакция эта идет в некоторых случаях при обыкновенной температуре. В особенности удобно для этой реакции брать йодюры. В некоторых случаях предпочитают замещать галоид гидроксильной группой, переводя предварительно йодюр в уксусный эфир, например:
C4H9I + AgOC2H3O = AgI + C4H9O.C2H3O.
При кипячении со щелочью эфир распадается на уксусную соль и Спирты, например:
C4H9O.C2H3O + NaHO = C4H9OH + C2H3O.ONa.
2) Из углеводородов этиленового ряда (Бертело, Бутлеров) под влиянием крепкой серной кислоты образуется эфир серной кислоты, например:
CH2:CH2 + H2SO4 = CH3.CH2.O.SO2.OH.
Серно-винный эфир распадается при кипячении с водой на спирт и серную кислоту, например:
СН 3.СН 2 О.SО 2.ОН + Н 2 O = СН 3.СН 2 OН + Н 2 SО 4.
Только для этилена образуется первичный Спирты; из всех других этиленовых углеводородов образуются вторичные и третичные Спирты, так как остаток серной кислоты, а следовательно, и гидроксильная группа, присоединяются к наименее гидрогенизированному атому углерода. На этом способе основывается возможность переводить первичные Спирты во вторичные или третичные и вторичные в третичные. Серная кислота при нагревании отнимает от Спирты воду с образованием этиленового углеводорода, который, в свою очередь, присоединяет воду под влиянием серной кислоты уже в другом направлении, например:
СН 3.СН 2 СН 2 OН — H 2 O = СН 3.СН:СН 2;
СН 3.СН:СН 2 + Н 2 O = СН 3.СНОН.СН 3.
Некоторые органические кислоты действуют на этиленовые углеводороды аналогично серной кислоте; так, например, уксусная кислота соединяется с этиленовыми углеводородами при 300° и образует эфиры, обмыливанием которых получаются Спирты (Д. Коновалов). Эфиры третичных Спирты легко получаются даже и на холоде при действии органических кислот на этиленовые углеводороды в присутствии хлористого цинка. 3) Из аминов при кипячении водного раствора их азотистокислых солей, например:
CH3(NH2)NO.ОН = N 2 + Н 2 О + СН 3 OН.
Кроме этих трех общих способов получения предельных Спирты, первичные Спирты получаются восстановлением альдегидов амальгамой натрия, например: C 6H13COH+H2=C6H13CH2 OH. Вторичные Спирты получаются восстановлением кетонов, например:
CH3.CO.CH3 + H2 = CH3.CHOH.CH3.
Вторичные Спирты можно получать из многоатомных Спирты, переводя последние в монойодюры действием йодисто-водородной кислоты и затем переведением йодюра в Спирты по первому способу. Все перечисленные способы получения Спирты дают возможность получать Спирты с тем же количеством атомов углерода, которое имеет исходное вещество. Следующие способы получения Спирты будут синтетические, т. е. Спирты будет получаться из веществ, заключающих меньшее количество атомов углерода, чем содержит получаемый Спирты Из альдегидов действием цинкметила или цинкэтила и затем разложением продукта реакции водой получаются вторичные Спирты (Е. Вагнер), например:
CH3.COH + Zn(C2H5)2= CH3.CH(OZnC2H5)(C2H5);
CH3.CH(OZnC2H5)(C2H5) + Н 2O = ZnO + C2H6 + CH3.CH(OH).C2H5.
Из муравьиного альдегида в этих условиях получается первичный Спирты (В. Тищенко). Точно так же вторичные Спирты можно получать из муравьиного эфира действием цинкорганических соединений или смесью галоидалкила и цинка в присутствии сплава натрия с цинком (Е. Вагнер и А. Зайцев). Третичные Спирты получаются синтезом (Бутлеров) из одной частицы хлорангидридов кислот и двух частиц цинкорганических соединений и разложением продукта реакции водой, например:
CH3COCl + 2Zn(CH3)2 = CH3.C(OZnCH3)(CH3)2 + CH3ZnCl;
CH3.C.(OZnCH3)(CH3)2+ H2O = CH3.C(OH)(CH3)2 + ZnO + CH4.
Третичные Спирты могут также получаться действием цинкметила или цинкэтила на кетоны, в которых к карбонильной группе не примыкает непосредственно метильная группа (А. Зайцев, Соколов). Любой предельный Спирты можно перевести в первичный Спирты, заключающий на один атом углерода более исходного Спирты Для этой цели замещают гидроксильную группу галоидом, затем галоид циановой группой, которую обмыливают и получают кислоту, заключающую одним атомом углерода больше исходного Спирты Кислоту восстановляют в первичный Спирты Этот род превращений можно представить следующей схемой:
спирт C nH2n+1 OH → йодюр C nH2n+1I → цианид C nH2n+1CN → кислота С nH2n+1 СООН → альдегид С nH2n+1 CОН → спирт С nH2n+1CH2OH.
Посредством этого синтеза получены все первичные нормальные Спирты, кончая гексиловым (Либен, Росси, Янечек). Имеется возможность также обратного перехода первичных Спирты в Спирты, заключающие одним атомом углерода меньше исходного: спирт С nH2n+1 СН 2 OН окисляется в кислоту С nH2n+1 СООН. Кислота переводится в амид C nH2n+1CONH2. Из амида кислоты получают амин C nH2n+1NH2. Амин переводится в Спирты С nH2n+1 ОН. Отдельные представители предельных Спирты см. Метиловый спирт, Древесно-уксусная кислота и древесный спирт, Алкоголь, Этиловый спирт, Винокурение, Виноделие, Виноградное вино, Профильные алкоголи, Бутильные алкоголи, Амильные алкоголи.
Непредельные Спирты Этим именем называют гидроксильные производные этиленовых и ацетиленовых углеводородов. Их известно сравнительно немного. До сих пор еще не получены непредельные Спирты, в которых гидроксильная группа была бы соединена с атомом углерода, связанным двойной или тройной связью. Попытки получить такие Спирты приводили к получению альдегида или кетона, изомерного с ожидаемым Спирты (Эльтеков, Эрленмейер). Впрочем, эфиры таких Спирты известны — см. Виниловые соединения. Легкость превращения в альдегиды и кетоны проявляется при различных условиях и для других непредельных Спирты; так, например, изопропенилкарбинол СН 2:С(CН 3)СН 2 OH при нагревании со слабой серной кислотой превращается в изомасляный альдегид (СН 3)2 СН.СНО (Шешуков). Другая особенность непредельных Спирты состоит в способности их присоединять галоиды, галоидоводородные и хлорноватистую кислоту. При окислении марганцовокислым калием непредельные Спирты в первой стадии присоединяют гидроксильные группы по месту двойных связей и для Спирты с одной двойной связью образуют трехатомные Спирты В остальном непредельные Спирты по химической натуре сходны с предельными. Способы получения непредельных Спирты вполне аналогичны получению предельных. Первичные непредельные Спирты получаются главным образом восстановлением непредельных альдегидов и действием воды или водного раствора поташа на первичные хлорюры С nH2n—1 Cl, бромюры или йодюры. Вторичные непредельные Спирты получаются восстановлением непредельных кетонов или действием цинкорганических соединений на непредельные альдегиды. Третичные непредельные Спирты получают действием йодистого аллила и цинка на кетоны. Как вторичные, так и третичные непредельные Спирты можно получать из непредельных вторичных или третичных хлорюров заменой хлора гидроксильной группой. Подробности о некоторых представителях непредельных Спирты — см. Аллиловый спирт, Кротиловый спирт, Ликареол, Пропаргиловый спирт.
Ароматические Спирты Ароматическими Спирты называют гидроксильные производные ароматических углеводородов, в которых гидроксильная группа находится в открытой боковой цепи. В противоположность ароматическим Спирты, гидроксильные производные ароматических углеводородов с гидроксильной группой в бензольном кольце называются фенолами (см.). Следовательно, ароматические Спирты можно рассматривать как Спирты жирного ряда, в которых атом или несколько атомов водорода замещены остатками ароматических углеводородов; например, простейший ароматический Спирты бензиловый C 6H5CH2 OH можно рассматривать как метиловый Спирты, в котором один атом водорода заменен фенильной группой C 6H5. Некоторые ароматические Спирты находятся в природе в растениях. Получаются они теми же методами, как Спирты жирного ряда. В особенности применима реакция получения их из соответственных галоидных соединений заменой галоида гидроксильной группой. Характерна реакция получения первичных ароматических Спирты из альдегидов действием едкого кали. Альдегид частью окисляется в кислоту и частью восстанавливается в Спирты, например:
2C6H5 CHO + KHO = С 6H5 COOK + С 6 Н 5 СН 2 OН.
Реакция эта применима для получения Спирты в том случае, когда альдегид легко доступен. Первичные ароматические Спирты, в которых группа СН 2 OН непосредственно примыкает к бензольному кольцу, могут получаться из амидов кислот восстановлением амальгамой натрия в кислых растворах, например:
C6H5CONH2 + 4H = C6H5CH2OH + NH3.
В общем, химические свойства ароматических Спирты вполне сходны со свойствами жирных. Только при действии серной кислоты на первичные Спирты здесь не получаются эфиросерные кислоты, но образуются смолоподобные углеводороды. Изомеры ароматических Спирты могут быть как по типу жирных, так и по типу ароматических соединений. Первичный ароматический Спирты — см. Бензиловый Спирты Вторичный ароматический Спирты — см. Бензгидрол. Примером третичного может быть трифенилкарбинол (С 6H5)3 COH, открытый Гемилианом при окислении трифенилметана хромовой смесью. Кристаллы трифенилкарбинола плавятся при 159°, температура кипения его выше 370°. Непредельный ароматический Спирты — см. Коричный спирт.
Нафтенолы или полиметиленовые Спирты Гидроксильные производные нафтенов или полиметиленовых углеводородов — см. Циклоспирты.
Терпенные Спирты Гидроксильные производные терпенилов — см. Терпены.

 (гликолят
меди (ярко-синий раствор))
(гликолят
меди (ярко-синий раствор))