
- •4. Растворы электролитов. Реакции обмена в растворах электролитов
- •4.1. Константа диссоциации (Кд)
- •4.2. Произведение растворимости (пр)
- •4.3. Ионное произведение воды (Кв). Водородный показатель (рН)
- •4.4. Реакции обмена в растворах электролитов
- •4.5. Гидролиз солей
- •Дополнения
- •1. Активность. Коэффициент активности. Ионная сила раствора. Термодинамическая константа диссоциации
- •2. Протонная теория кислот и оснований
4. Растворы электролитов. Реакции обмена в растворах электролитов
В водных растворах электролиты – основания, кислоты, соли – диссоциируют на ионы. Способность электролита диссоциировать на ионы определяет его силу. По силе электролиты делятся на слабые и сильные. В водных растворах сильные электролиты полностью диссоциируют на ионы. К сильным электролитам относятся почти все соли, в том числе малорастворимые; кислоты: НС1, НС1О4, H2SО4, НNO3 и др.; гидроксиды щелочных и щелочноземельных металлов. В отличие от сильных электролитов у слабых только часть растворенных молекул распадается на ионы, а большая часть представляет собой недиссоциированные молекулы. Слабые электролиты: H2SO3, Н2СО3, Н2S, HCN, HNO2, H3PО4, СН3СООН и др., вода, NH4ОH, гидроксиды металлов, за исключением щелочных и щелочноземельных. Количественной характеристикой силы электролита является константа диссоциации.
4.1. Константа диссоциации (Кд)
Диссоциация – процесс обратимый. Применяя ЗДМ к обратимому процессу диссоциации электролита, можно найти константу равновесия, называемую в данном случае константой диссоциации Кд. Константа диссоциации не зависит от концентрации электролита, но зависит от природы его и температуры. Константа диссоциации связана с изменением энергии Гиббса соотношением
G0 = –2,303 R T lgKд или (10)
для T = 298 K и R = 8,31410–3 кДж/мoльK
G0 = –5,706 lgKд. (11)
Зная G0 диссоциации, можно найти Кд. Для слабых электролитов, как правило, G0 > 0 и Кд < 1, для сильных электролитов G0 < 0 и Кд > 1. Значения констант диссоциации некоторых электролитов приведены в табл. 1 Приложения.
Для электролитов, диссоциирующих ступенчато, равновесное состояние каждой ступени характеризуется константой диссоциации. Например, Sn(OH)2 диссоциирует ступенчато:
1 ступень Sn(OH)2
Sn(ОН)+ + OН–;
![]() =
3,210–10,
=
3,210–10,
2 ступень Sn(OH)+
Sn2+
+ OH–;
![]() =
1,210–12.
=
1,210–12.
Суммарной диссоциации: Sn(OH)2 Sn2+ + 2OH– отвечает суммарная константа диссоциации:
![]() =
3,210–101,210–12
= 3,841022.
=
3,210–101,210–12
= 3,841022.
Константа диссоциации не зависит от концентрации, а зависит от природы электролита и температуры.
Для слабых электролитов константа диссоциации Кд связана со степенью диссоциации и концентрацией электролита С соотношением
![]() ,
(12)
,
(12)
где С – молярная концентрация электролита, моль/л. При 1 уравнение (12) примет вид:
![]() .
(13)
.
(13)
Отсюда
![]() .
(14)
.
(14)
Соотношение (14) показывает, что при разбавлении раствора, т.е. при уменьшении концентрации электролита С, степень диссоциации электролита возрастает (закон разбавления Оствальда).
Из закона разбавления можно найти концентрацию иона. Так, электролита АВ диссоциирующего по уравнению АВ А+ + В–
![]() .
.
Обозначим [А+], [В–] и [АВ]
соответственно через
![]() ,
,
![]() и С. По уравнению диссоциации
=
= С
иона. Тогда выражение для Кд
можно записать в виде
и С. По уравнению диссоциации
=
= С
иона. Тогда выражение для Кд
можно записать в виде
![]() .
.
Отсюда
![]() ,
(14)
,
(14)
или
![]() .
(16)
.
(16)
Чем меньше константа диссоциации, тем слабее электролит, т.е. тем меньше его ионов имеется в растворе. Сравнивая константы диссоциации первой и второй
ступеней для угольной кислоты, приходим к выводу, что по первой ступени кислота диссоциирует в большей степени, чем по второй.
Так как диссоциация – процесс обратимый, то при изменении условий согласно принципу Ле Шателье, можно смещать равновесие диссоциации либо в сторону распада молекул электролита на ионы, либо в сторону образования молекул.
Пример 6. Определите, как изменится равновесие диссоциации азотистой кислоты при введении в раствор её соли – нитрита натрия.
В растворе азотистая кислота диссоциирует по уравнению
HNO2
Н+ +
![]() .
.
Константа диссоциации её
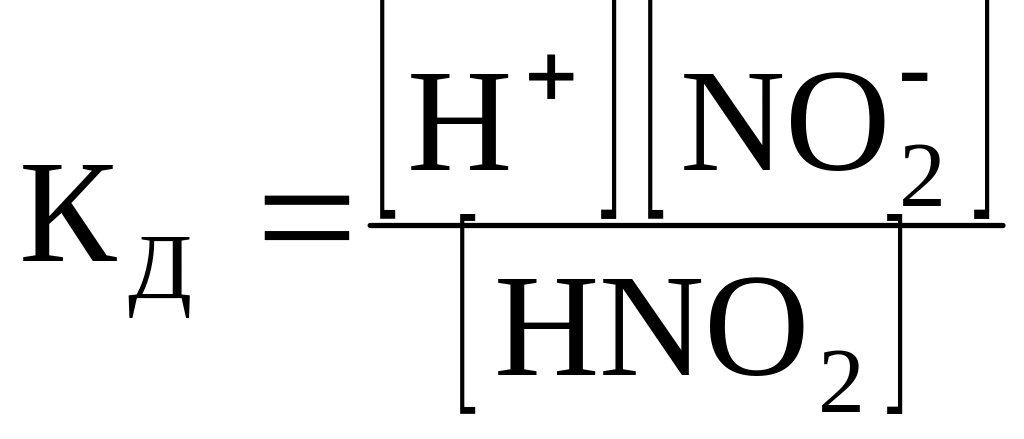 .
При добавлении к раствору кислоты её
соли NaNО2, диссоциирующей
по уравнению: NaNО2
Na+
+
,
увеличивается концентрация нитрит-ионов.
Константа диссоциации не зависит от
концентрации и при данной температуре
есть величина постоянная. Поэтому
увеличение концентрации нитрит-ионов,
согласно принципу Ле Шателье, приводит
к увеличению такого количества
недиссоциированных молекул азотистой
кислоты, чтобы константа диссоциации
оставалась постоянной величиной. Таким
образом, введение в раствор кислоты
нитрит-ионов смещает равновесие
диссоциация в сторону образования
молекул азотистой кислоты и понижает
кислотность среды.
.
При добавлении к раствору кислоты её
соли NaNО2, диссоциирующей
по уравнению: NaNО2
Na+
+
,
увеличивается концентрация нитрит-ионов.
Константа диссоциации не зависит от
концентрации и при данной температуре
есть величина постоянная. Поэтому
увеличение концентрации нитрит-ионов,
согласно принципу Ле Шателье, приводит
к увеличению такого количества
недиссоциированных молекул азотистой
кислоты, чтобы константа диссоциации
оставалась постоянной величиной. Таким
образом, введение в раствор кислоты
нитрит-ионов смещает равновесие
диссоциация в сторону образования
молекул азотистой кислоты и понижает
кислотность среды.
