- •1. Общие принципы организации тканей
- •2. Эпителиальные ткани
- •Признаки эпителиев
- •Функции эпителиев:
- •Строение эпителиальной клетки
- •Органоиды специального назначения эпителиальных клеток
- •Строение и функции базальной мембраны.
- •Функции базальной мембраны:
- •Классификация эпителиев
- •Строение различных типов эпителия Однослойный эпителий
- •Строение эндокринных желез.
- •Секреция.
- •Различные типы секреции:
- •Типы секреции
- •Морфологическая классификация экзокринных желез
- •3. Производные мезенхимы. Рыхлая соединительная ткань
- •Соединительные ткани
- •Функции фибробластов
- •Функции макрофагов:
- •Функции тучных клеток:
- •Функции эндотелия:
- •Неорганические компоненты
- •Плотная волокнистая соединительная ткань.
- •4. Ткани внутренней среды.
- •Функции крови:
- •С остав крови:
- •Состав плазмы крови:
- •Эритроциты
- •Эозинофилы
- •Функции т-лимфоцитов:
- •5. Кроветворение (гемопоэз)
- •5. Кроветворение в постнатальном периоде
- •Общие закономерности развития форменных элементов крови
- •Стволовые клетки крови
- •Основные свойства полипотентных стволовых клеток крови:
- •Коммитирование, детерминация и дифференцировка кроветворных клеток
- •Классификация кроветворных клеток
- •Эритропоэз
- •Развитие nk-клеток
- •6. Скелетные соединительные ткани
- •Хрящевые ткани
- •Для хрящевых тканей характерны:
- •Клетки хрящевой ткани:
- •Межклеточное вещество (матрикс) хрящевой ткани состоит из волокон и основного аморфного вещества
- •Классификация хрящевых тканей
- •Эластическая хрящевая ткань
- •Волокнистая фиброзная хрящевая ткань
- •Гиалиновая хрящевая ткань
- •Хрящ как орган
- •Возрастные изменения и регенерация
- •Костные ткани
- •Минерализация органического матрикса остеобластами осуществляется двумя основными механизмами:
- •Классификация костных тканей
- •Кость как орган
- •Системы костных пластинок компактного вещества кости:
- •Функции надкостницы:
- •И регенерация костной ткани и костей
- •7. Мышечные ткани
- •Классификация мышечных тканей
- •Скелетная мышечная ткань
- •Функциональная морфология скелетной мышечной ткани
- •Типы мышечных волокон
- •Скелетная мышца как орган
- •Иннервация скелетной мышечной ткани
- •Сердечная мышечная ткань
- •Функциональная морфология сердечной мышечной ткани
- •Типы кардиомиоцитов
- •Гладкая мышечная ткань
- •Функциональная морфология гладкой мышечной ткани
- •Гладкие миоциты
- •Регуляция сократительной деятельности гладкой мышечной ткани
- •8. Нервная ткань
- •Нейроны
- •Функциональная морфология нейрона
- •Классификация нейронов
- •Нейроглия
- •Классификация и функциональная морфология нейроглии
- •Функции астроцитов:
- •Функции эпендимной глии:
- •Неpbhыe волокна
- •Классификация нервных волокон
- •Регенерация нервных волокон в пнс
- •Нервные окончания
- •Межнейронные контакты (синапсы)
- •Эфферентные (эффекторные) нервные окончания
- •Список литературы основная литература
- •Дополнительная литература
Функции эндотелия:
Транспортная – через него осуществляется избирательный двусторонний транспорт веществ между кровью и другими тканями. Механизмы: диффузия, везикулярный транспорт (с возможным метаболическим превращением транспортируемых молекул).
Гемостатическая – играет ключевую роль в свертывании крови. В норме образует атромбогенную поверхность; вырабатывает прокоагулянты (тканевый фактор, ингибитор плазминогена) и антикоагулянты (активатор плазминогена, простациклин).
Вазомоторная – участвует в регуляции сосудистого тонуса: выделяет сосудосуживающие (эндотелин) и сосудорасширяющее (простациклин, эндотелиальный релаксирующий фактор – окись азота) вещества; участвует в обмене вазоактивных веществ – ангаотензина, норадреналина, брадикинина.
Рецепторная – экспрессирует на плазмолемме ряд соединений, обеспечивающих адгезию и, и последующую трансэндотелиальную миграцию лимфоцитов, моноцитов и гранулоцитов.
Секреторная – вырабатывает митогены, ингибиторы и факторы роста, цитокины, регулирующие кроветворение, пролиферацию и дифференцировку Т- и В-лимфоцитов, привлекающие лейкоциты в очаг воспаления.
Сосудообразовательная – обеспечивает новообразование капилляров (ангиогенез) – как в эмбриональном развитии, так и при регенерации.
Перициты – клетки звездчатой формы, примыкающие снаружи к артериолам, венулам и капиллярам. Наиболее многочисленны в посткапиллярных венулах. Имеют собственную базальную мембрану, сливающуюся с базальной мембраной эндотелия, так что создается впечатление, что перицит заключен в расслоившуюся базальную мембрану эндотелия. Перицит охватывает стенку сосуда, что позволяет предположить их участие в регуляции просвета сосудов.
Перициты имеют дисковидное ядро с небольшими углублениями, содержат обычный набор органелл, мультивезикулярные тельца, микротрубочки и гликоген. В области, обращенной к стенке сосуда, содержат пузырьки. Около ядра и в отростках присутствуют сократительные белки, в т.ч. актин и миозин. Перициты покрыты базальной мембраной, но тесно связаны с эндотелиальной клеткой, т.к. базальная мембрана между ними может и отсутствовать. В этих местах выявлены щелевые и адгезионные контакты.
Функции перицитов четко не установлены. О конкретных функциях можно говорить с разной степенью вероятности.
Контрактильные свойства. Вероятно участие перицитов в регуляции просвета микрососуда.
Источник гладкомышечных клеток (ГМК). При заживлении ран и восстановлении сосудов перициты в течение 3-5 дней дифференцируются в ГМК.
3.Влияние на эндотелиальные клетки. Перициты контролируют пролиферацию эндотелиальных клеток, как при нормальном росте сосудов, так и при их регенерации; модулируют функцию эндотелиальных клеток, регулируя транспорт макромолекул из капилляров в ткани.
Секреторная функция. Синтез компонентов базальной мембраны капилляра.
Участие в фагоцитозе.
Межклеточное вещество рыхлой волокнистой соединительной ткани состоит из волокон и основного аморфного вещества. Оно является продуктом деятельности клеток этой ткани, в первую очередь, фибробластов.
Функции межклеточного вещества рыхлой волокнистой соединительной ткани:
обеспечение архитектоники, физико-химических и механических свойств ткани;
участие в создании оптимального микроокружения для деятельности клеток;
объединение в единую систему всех клеток соединительной ткани и обеспечение передачи информации между ними;
воздействие на многочисленные функции различных клеток (пролиферацию, дифференцировку, подвижность, экспрессию рецепторов, синтетическую и секреторную активность, чувствительность к действию различных стимулирующих, ингибирующих и повреждающих факторов и т.п.). Этот эффект может осуществляться путем контактного воздействия компонентов межклеточного вещества на клетки, а также благодаря его способности накапливать и выделять факторы роста.
Коллагеновые волокна в составе разных видов соединительной ткани определяют их прочность. В рыхлой неоформленной волокнистой соединительной ткани они располагаются в различных направлениях в виде волнообразно изогнутых, спиралевидно скрученных, округлых или уплощенных в сечении тяжей толщиной 1-3 мкм и более. Длина их различна. Внутренняя структура коллагенового волокна определяется фибриллярным белком — коллагеном, который синтезируется на рибосомах гранулярной эндоплазматической сети фибробластов.
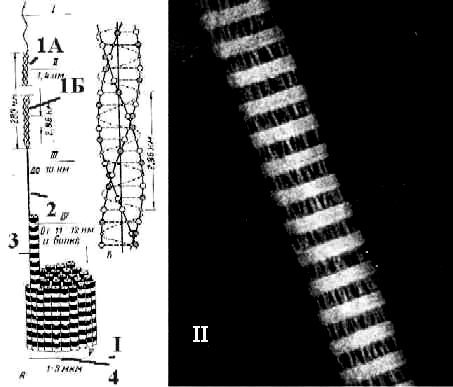
Рис. 3.11. I. Схема – уровни структурной организации коллагеновых волокон. II. Электронная микрофотография - коллагеновая фибрилла. Различают четыре уровня организации коллагеновых волокон: молекулы тропоколлагена (1), протофибриллы (2), фибриллы (3) и волокна (4).\
Коллагеновые волокна распространены не только в собственно соединительной ткани, но также в кости и хряще, где они соответственно называются оссеиновыми и хондриновыми. Эти волокна определяют прочность тканей на разрыв. В рыхлой неоформленной соединительной ткани они располагаются в различных направлениях в виде волнообразно изогнутых тяжей толщиной 1-3 мкм. Коллагеновые волокна состоят из пучков параллельно расположенных микрофибрилл толщиной в среднем 50-100 нм, связанных между собой гликозаминогликанами и протеогликанами. Их толщина зависит от числа фибрилл, которые имеют поперечную исчерченность (черные и светлые участки) с периодом повторяемости 64-70 нм. В пределах одного периода находятся вторичные полосы шириной 3-4 нм.
Коллагеновые структуры, входящие в состав соединительных тканей организма человека и животных, являются наиболее распространенными ее компонентами. Основным их компонентом является волокнистый белок - коллаген.
Коллаген - главный белок соединительной ткани, которая составляет свыше 50% веса организма человека и животных. Одновременно, по расчетам швейцарского ученого Ф. Верцара, на долю коллагена приходится около 30% общего количества белка в организме. Следовательно, коллаген в количественном отношении стоит среди белков на первом месте.
Расшифровка первичной структуры коллагена - важнейший этап развития этих знаний. Значение раскрытия структуры коллагена следует расценивать с учетом того большого интереса, который проявляют к коллагену в различных областях знаний. Он лежит в основе целых областей технологии. Все кожевенное производство - это по существу переработка коллагена. Денатурированный коллаген–желатин незаменимый компонент фото-киноматериалов. Из переработанного коллагена изготовляется множество материалов, применяющихся в ветеринарной и медицинской практике.
Экстрагированные из волокон молекулы коллагена имеют длину 200 нм и ширину 1,4нм. Они получили название тропоколлагена. Молекулы построены из трипластов - трех полипептидных цепочек, которые сливаются в единую спираль. Каждая цепочка содержит набор из трех аминокислот, закономерно повторяющихся на протяжении ее длины. Первая кислота в таком наборе может быть любой, вторая - пролин или лизин, третья – глицин.
Расположение аминокислот может варьировать, вследствие чего образуется четыре типа коллагена.
1 тип - в собственно соединительной ткани, кости, роговице глаза, склере, зубной связке и др.
2 тип - в гиалиновом и фиброзном хряще, стекловидном теле.
3 тип - в дерме кожи плода, кровеносных сосудах, в ретикулярных волокнах.
4 тип - в базальных мембранах, в капсуле хрусталика.
В 1973 году была расшифрована одна из полипептидных цепей коллагена, что представляется выдающимся событием. Коллаген значительно крупнее по молекулярному весу, чем другие изученные белки. Трудности работы по установлению структуры коллагена были обусловлены величиной молекулы и особой монотонностью его строения - частотой повторения аминокислотных остатков и их сочетаний, что сильно осложняло задачу исследований.
Молекулы коллагена имеют длину около 280 нм и ширину 1,4 нм. Они построены из триплетов — трех полипептидных цепочек, предшественника коллагена – проколлагена, свивающихся еще в клетке в единую спираль. Это первый, молекулярный, уровень организации коллагенового волокна. Проколлаген секретируется в межклеточное вещество.
Второй, надмолекулярный, уровень — внеклеточной организации коллагенового волокна — представляет агрегированные в длину и поперечно связанные с помощью водородных связей молекулы тропоколлагена, образующиеся путем отщепления концевых пептидов проколлагена. Сначала образуются протофибриллы, а 5-6 протофибрилл, скрепленных между собой боковыми связями, составляют микрофибриллы толщиной около 5 нм.
При участии гликозаминогликанов, также секретируемых фибробластами, формируется третий, фибриллярный и, уровень организации коллагенового волокна. Коллагеновые фибриллы представляют собой поперечно исчерченные структуры толщиной в среднем 20-100 нм. Период повторяемости темных и светлых участков 64-67 нм. Каждая молекула коллагена в параллельных рядах, как полагают, смещена относительно соседней цепи на четверть длины, что служит причиной чередования темных и светлых полос. В темных полосах под электронным микроскопом видны вторичные тонкие поперечные линии, обусловленные расположением полярных аминокислот в молекулах коллагена.
Четвертый, волоконный, уровень организации. Коллагеновое волокно, образующееся путем агрегации фибрилл, имеет толщину 1-10 мкм (в зависимости от топографии). В него входит различное количество фибрилл – от единичных до нескольких десятков. Волокна могут складываться в пучки толщиной до 150 мкм.
Коллагеновые волокна отличаются малой растяжимостью и большой прочностью на разрыв. В воде толщина сухожилия в результате набухания увеличивается на 50%, а в разбавленных кислотах и щелочах – в 10 раз, но при этом волокно укорачивается на 30%. Способность к набуханию больше выражена у молодых волокон. При термической обработке в воде коллагеновые волокна образуют клейкое вещество (греч. коllа — клей), что и дало название этим волокнам.
Ретикулярные (ретикулиновые, аргирофильные) волокна. Они встречаются в рыхлой и некоторых других видах соединительной ткани, в строме кроветворных органов, печени, внутренних оболочках сосудов. На препаратах импрегнированных серебром они располагаются в виде сети.
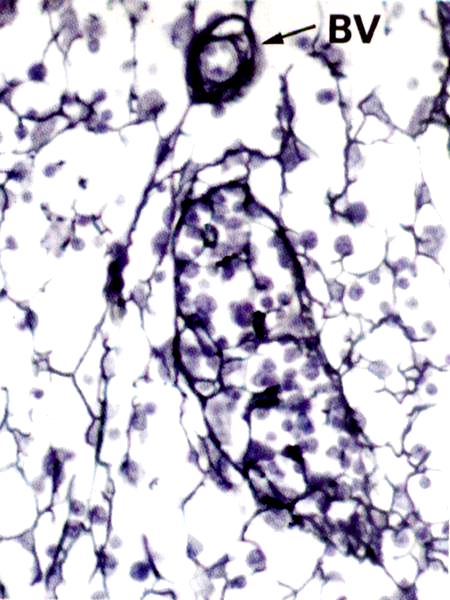
Рис. 3.12. Ретикулярные волокна в лимфатическом узле при импрегнации азотнокислым серебром. Волокна ветвятся, образуя тонкую сеть. ВV- кровеносный сосуд (х800).
Вопрос о природе ретикулярных волокон остается спорным. Большинство исследователей считают, что ретикулин - белок, составляющий основу этих волокон, представляет вещество близкое к коллагену, а импрегнационные и гистохимические отличия ретикулярных волокон от коллагеновых связаны со свойствами прошивающих волокна гликозаминогликанов. В отличие от коллагена и эластина ретикулин содержит больше серина, оксилизина и глютаминовой кислоты.
Эластические волокна. Эластические волокна придают ткани эластичность. Они менее прочны, чем коллагеновые на разрыв. В рыхлой соединительной ткани они образуют петлистую сеть, анастомозируя друг с другом. Толщина волокон от 0,2 до 1 мкм. В отличии от коллагеновых - они не имеют микроскопически видимых фибрилл и субмикроскопической поперечной исчерченности.
А |
Б |
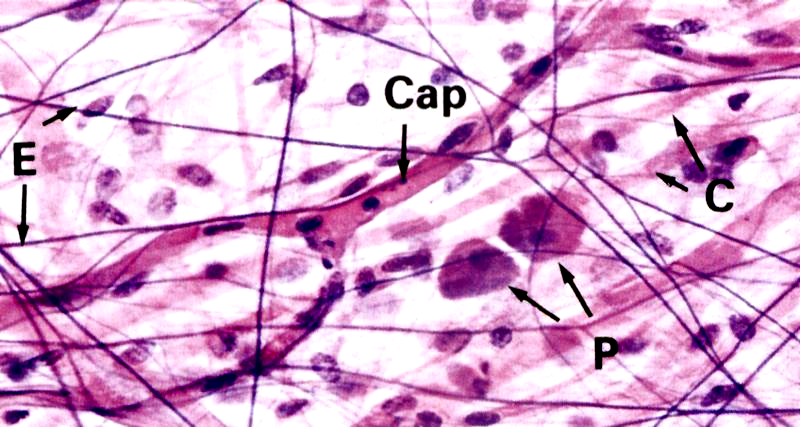
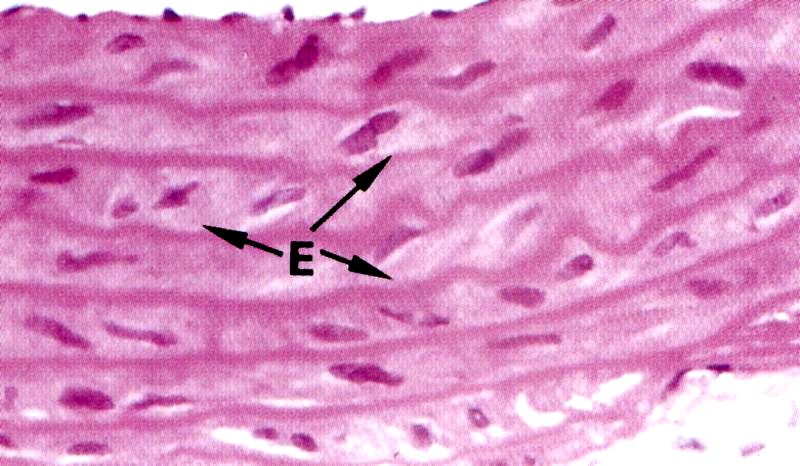
Рис. 3.13. А - Эластические волокна в соединительной ткани (х320). Б - эластические волокна в стенке крупной артерии (х400), Е – тонкие эластические волокна, Сар - разветвленный капилляр, Р –плазматические клетки, С- коллагеновые волокна.
Основой эластических волокон является глобулярный гликопротеин — эластин, синтезируемый фибробластами и гладкими мышечными клетками (первый, молекулярный, уровень организации). Для эластина характерны большое содержание пролина и глицина и наличие двух производных аминокислот – десмозина и изодесмозина, которые участвуют в стабилизации молекулярной структуры эластина и придании ему способности к растяжению, эластичности. Молекулы эластина, имеющие глобулы диаметром 2,8 им, вне клетки соединяются в цепочки — эластиновые протофибриллы толщиной 3-3,5 нм (второй, надмолекулярный, уровень организации). Эластиновые протофибриллы в сочетании с гликопротеином (фибриллином) образуют микрофибриллы толщиной 8-19 нм (третий, фибриллярный, уровень организации). Четвертый уровень организации – волоконный. Наиболее зрелые эластические волокна содержат около 90% аморфного компонента эластических белков (эластина) в центре, а по периферии – микрофибриллы. В эластических волокнах в отличие от коллагеновых нет структур с поперечной исчерченностью на их протяжении.