- •Галогенопроизводные углеводородов
- •Номенклатура, изомерия
- •Механизм sn1
- •Подвижность галогенов
- •Галогениды аллильного и винильного типа
- •Химические свойства арилгалогенидов
- •Препаративные методы получения спиртов
- •Физические свойства спиртов
- •Химические свойства спиртов
- •Кислотные свойства
- •Основные свойства
- •Реакции замещения он - группы спиртов
- •Способы получения фенолов
- •Химические свойства фенолов
- •Задача 5
- •Решение задачи 5
- •Тема «Спирты, фенолы» Задача 6
- •Решение задачи 6
- •Задача 7
- •Задача 8
- •Решение задачи 8
- •Задача 9
- •Задача 10
- •Вопросы к коллоквиуму №2 «галогенопроизводные, спирты, фенолы»
Препаративные методы получения спиртов
Спирты можно получать с применением реактива Гриньяра.

Физические свойства спиртов
Присутствие гидроксильной группы в спиртах придает молекуле ряд особенностей. Спирты могут образовывать водородные связи, что приводит к повышению температуры кипения и плавления. Гидроксильная группа придает молекуле спирта свойства воды.
Чем больше в молекуле гидроксильных групп, тем лучше растворимость в воде. Спирты с длинной углеродной цепью не смешиваются с водой.
При повышении температуры надо не только перевести молекулы в газообразное состояние, но и расщепить ассоциаты. Одноатомные спирты - нейтральные вещества, в их присутствии содержание ионов водорода в воде практически не изменяется.
Таблица 2
Физические свойства одноатомных спиртов
Название спирта |
Формула |
Температура кипения, ˚C |
Растворимость в воде |
Метиловый, метанол |
|
65 |
неограниченно |
Этиловый, этанол |
|
78,5 |
неограниченно |
Пропиловый, пропанол-1 |
|
97 |
неограниченно |
Изопропиловый, пропанол-2 |
|
82 |
неограниченно |
Бутиловый, бутанол-1 |
|
118 |
9 г/100 г |
Втор-бутиловый, бутанол-2 |
|
99,5 |
|
Трет-бутиловый, 2-метилбутанол-2 |
|
83 |
хорошо |
Химические свойства спиртов
Для спиртов характерно многообразие химических свойств, обусловленных наличием гидроксильной группы.

Кислотные свойства
Спирты являются более слабыми кислотами, чем фенолы, но более сильными, чем ацетилен. Мерой кислотности является положение равновесия в реакции диссоциации, которое определяется величиной Ка или рКа.
![]()

Спирт |
|
|
|
|
Вода |
рКа |
15,2 |
16,0 |
16,9 |
19,2 |
15,7 |
Спирты с сильными основаниями реагируют, как кислоты. Чем меньше рКа, тем выше кислотные свойства.
![]()
![]()
Основные свойства
Спирты, как основания и нуклеофильные реагенты, реагируют с различными кислотами и электрофильными субстратами.

В этой реакции образуется оксониевая соль, устойчивая только при низких температурах.
Реакции замещения он - группы спиртов
Наиболее важные химические превращения спиртов связаны с преобразованием гидроксильной группы.
Замещение гидроксила на галоген:
![]()
![]()
![]()
Получение эфиров
Спирты могут образовывать эфиры с неорганическими и органическими кислотами.
![]()
Образование эфиров карбоновых кислот (этерификация)

Дегидратация спиртов
Дегидратация спиртов приводит к образованию этиленовых углеводородов или простых эфиров.


Катализаторы в процессах дегидратации - серная кислота, фосфорная кислота, оксид алюминия и др.
Окисление
Первичные и вторичные спирты окисляются с образованием альдегидов и кетонов. Окисление осуществляется кислородом в присутствии катализаторов или неорганическими окислителями. Третичные спирты окисляются только в кислой среде в более жестких условиях.
![]()

Этанол
Этиловый спирт получают брожением углеводов. При фракционной перегонке (ректификации) бражки получают смесь этилового спирта с водой спирт - ректификат, содержащий 95,5 % этанола и 4,5 % воды с т. кип. 78,15 ˚C. Для получения безводного этанола воду связывают добавлением СаО или других веществ.

Синтезы на основе метанола
Многоатомные спирты
Многоатомными называются спирты, содержащие в молекуле две и более гидроксильных групп. Важнейшие представители:




Способы получения многоатомных спиртов
Гликоли получают в промышленности в больших масштабах из алкенов:
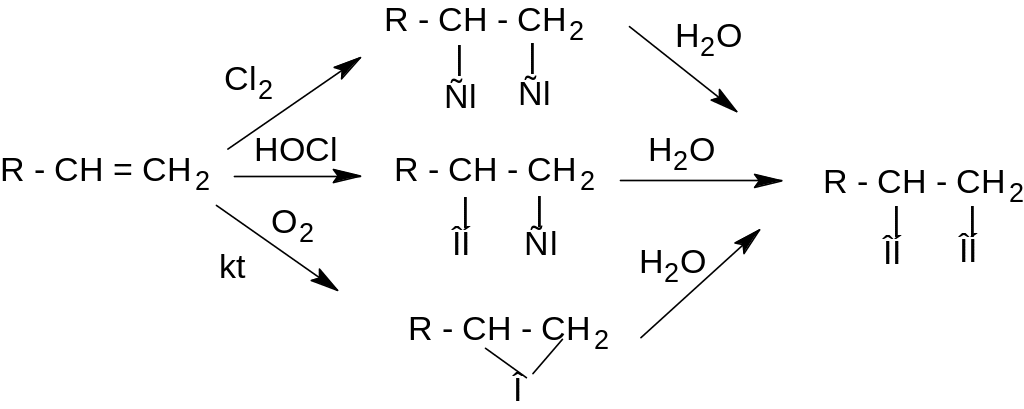
Получение глицерина
Получение из аллилхлорида

Получение из жиров

Химические свойства многоатомных спиртов
Реакции гликолей и других многоатомных спиртов аналогичны реакциям одноатомных спиртов. В реакциях может участвовать одна или несколько гидроксильных групп.
Кислотные свойства
Кислотные свойства многоатомных спиртов выше, чем у одноатомных. Для этиленгликоля рКа = 14,7.Многоатомные спирты могут реагировать с гидроксидами тяжелых металлов.

При окислении гликолей образуются целый ряд продуктов.

Получение сложных эфиров:

Фенолы
Оксисоединения, содержащие гидроксильную группу в бензольном ядре называют фенолами.


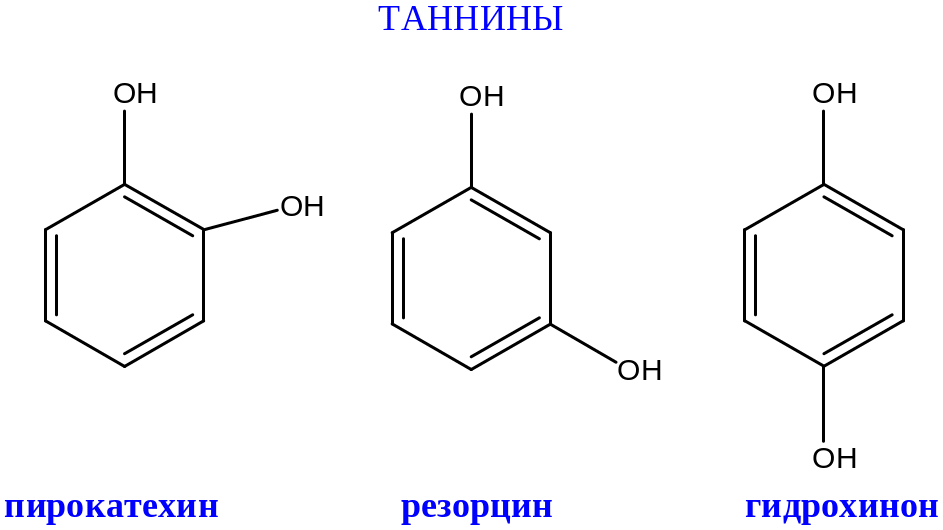
МНОГОАТОМНЫЕ ФЕНОЛЫ