
- •Облик кристаллов
- •. КЛАССЫ МИНЕРАЛОВ
- •ПОДКЛАССЫ МИНЕРАЛОВ
- •СЕМЕЙСТВА МИНЕРАЛОВ
- •НАДГРУППЫ МИНЕРАЛОВ
- •ГРУППЫ МИНЕРАЛОВ
- •ПОДГРУППЫ, РЯДЫ МИНЕРАЛОВ
- •хнологическая классификация
- •Тип 1, ювелирные камни
- •Тип 2, ювелирно-поделочные камни
- •Тип 3, поделочные камни
- •Кристаллохимическая классификация минералов
- •Классификация магматических горных пород[править | править исходный текст]
- •Благородные элементы[править | править исходный текст]
- •Другие металлы[править | править исходный текст]
- •Металлоиды[править | править исходный текст]
- •Свойства[править | править исходный текст]
- •Происхождение (генезис)[править | править исходный текст]
- •Сульфиды в природе[править | править исходный текст]
- •Состав[править | править исходный текст]
- •Строение[править | править исходный текст]
- •Свойства[править | править исходный текст]
- •Генезис[править | править исходный текст]
- •Использование[править | править исходный текст]
- •Классификация[править | править исходный текст]
- •Механизм и закономерности кристаллизации металлов.
- •Условия получения мелкозернистой структуры.
- •Формы залегания интрузивных пород[править | править исходный текст]
- •Формы залегания эффузивных пород[править | править исходный текст]
- •Месторождения[править | править исходный текст]
- •Практическое значение[править | править исходный текст]
- •Группа пироксенов Пироксены образует изоморфные ряды ромбических и моноклинных минеральных видов. В магматических породах наиболее распространены: энстатит, гиперстен, диопсид и авгит.
- •Давление Различают всестороннее давление (гидростатическое) и направленное давление (стресс).
- •Группа пироксенов здесь рассматриваются только специфические метаморфические минералы омфацит и жадеит.
- •Кристаллобластовые структуры возникают в результате полной перекристаллизации породы. По относительным размерам зерен кристаллобластовые структуры подразделяются на равномернозернистые (гомеобластовые) и неравномернозернистые (гетеробластовые).
- •38 Структуры обломочных горных пород. Минеральный состав

vk.com/club152685050 | vk.com/id446425943
1 вопрос:
орных породах, посвящённую детальному изучению их минерального состава, структуры, текстурных особенностей и химического состава. Основные методы исследования — оптическая микроскопия . По типам изучаемых горных пород различают П. магматических, П. метаморфических и П. осадочных горных пород, или литологию (См. Литология).
Кристаллогра́фия — наука о кристаллах, их структуре, возникновении и свойствах. Она тесно связана с минералогией, физикой твёрдых тел и химией. Исторически кристаллография возникла в
рамках минералогии, как наука, описывающая идеальные кристаллы.
Для описания симметрии многограниников и кристаллических решеток в кристаллографии установлена следующая иерархия терминов:
Три категории симметрии
Шесть сингоний
Семь кристаллических (кристаллографических) систем
14 решёток Браве
32 класса или вида симметрии
230 пространственных групп
Пирами́ды ро́ста — пирамиды, основаниями которых служат грани кристалла, а общей вершиной
— начальная точка роста.
Реальный кристалл во многих случаях целесообразно рассматривать как совокупность пирамид роста, поскольку очень часто физические свойства пирамид роста с основаниями, принадлежащим к различным простым формам, оказываются различными. Это подтверждается существованием у многих природных кристаллов структуры песочных часов, случаями закономерной оптической аномалии у кристаллов кубической системы и пр.
Симме́три́я кристаллов (др.-греч. συμμετρία «соразмерность», от μετρέω — «меряю»)- это
закономерная повторяемость в пространстве одинаковых граней, ребер и углов фигуры, которая может совмещаться сама с собой в результате одного или нескольких отражений. Для описания симметрии пользуется воображаемыми образами — точками, прямыми, плоскостями, называемыми элементами симметрии.
Плоскость симметрии (P) — это воображаемая плоскость, которая делит фигуру на две симметрично равные части, расположенные друг относительно друга как предмет и его зеркальное отражение. . МИНЕРАЛОГИЯ — наука о минералах; изучает состав, свойства, морфологию, особенности структуры, процессы образования и изменения минералов, закономерности их совместного нахождения в природе, а также условия и методы искусственного получения (синтеза) и практического использования. Главные задачи: разработка научной классификации минералов, выявление связей между вариациями их состава, строения, свойств и условиями образования и нахождения в природе;
Постепенная дифференциация минералогии в ходе развития наук привела к отделению от неё геологии и кристаллографии(18 век), петрографии (19 век),
Петрогра́фия (греч. πέτρος «камень» + γράφω «пишу») — наука, описывающая горные породы и
составляющие их минералы. Петрографию можно определить как описательную часть общей науки о г Ось симметрии (L) — прямая линия, при вращении вокруг которой повторяются равные части фигуры, то есть она самосовмещается. Число совмещений при повороте на 360° определяет порядок оси симметрии (n). Центр симметрии (С) — точка внутри кристалла, в которой пересекаются и делятся пополам все линии, соединяющие соответственные точки на его поверхности.
2 вопрос:
. Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных
симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов). Основные свойства кристаллов – анизотропность, однородность,

vk.com/club152685050 | vk.com/id446425943
способность к самоогоранению и наличие постоянной температуры плавления определяются их внутренним строением.
С точки зрения геометрической кристаллографии, кристалл представляет собой многогранник. Чтобы охарактеризовать форму кристаллов, воспользуемся понятием элементов ограничения. Внешняя форма кристаллов слагается из трех элементов ограничения: граней (плоскостей), ребер (линии пересечения граней) и гранных углов.
Известно более пяти тысяч видов кристаллов. Они имеют разную форму и разное число граней. Формой кристалла называют совокупность всех его граней. Простой формой в кристаллографии называют совокупность одинаковых граней, связанных между собой элементами симметрии. Среди простых форм различают закрытые формы, которые замыкают часть пространства полностью, например куб, октаэдр; открытые простые формы, например, различные призмы, пространство не замыкают и самостоятельно существовать не могут, а только в сочетаниях (комбинациях) с другими простыми формами. Комбинациями в кристаллографии называют закономерное сочетание нескольких простых форм в одном кристалле. Комбинироваться между собой могут только простые формы, относящиеся к одному виду симметрии, например куб или октаэдр, гексагональная призма и двойная гексагональная пирамида и т.д. Название комбинации составляется из названий входящих в нее простых форм.
Существует 47 простых форм. Каждая из них характеризуется количеством, формой и расположением граней.
Вкубической сингонии встречаются только закрытые формы.
1.Простые формы, получаемые из тетраэдра: тетраэдр (от греч. «тетра» — четыре, «эдра» — грань)
– четыре равносторонних треугольника, пересекающихся в ребрах и замыкающих пространство. Если каждую грань тетраэдра заменить тремя гранями (тритетраэдр), то по количеству сторон этих граней различают тригонтритетраэдр, тетрагонтритетраэдр; пентагонтритетраэдр; гексатетраэдр (каждая грань тетраэдра замещается шестью гранями).
2.Простые формы, получаемые из октаэдра; октаэдр – восемь равносторонних, попарно параллельных треугольников, пересекающихся в ребрах. Если каждую грань октаэдра заменить тремя гранями, то по аналогии с тетраэдром получим тригонтриоктаэдр, тетрагонтриоктаэдр, пентагонтриоктаэдр, при замещении грани октаэдра шестью гранями получаем гексаоктаэдр, он состоит из 48 граней.
3.Куб (гексаэдр) – шесть попарно параллельных квадратных граней, пересекающихся в ребрах. Если каждую грань куба заменить четырьмя треугольными гранями, то получится простая форма – тетрагексаэдр.
4.Ромбододекаэдр состоит из 12 граней в виде ромбов.
5.Пентагондодекаэдр состоит из 12 граней, имеющих форму неправильных пятиугольников.
6.Дидодекаэдр – удвоенный додекаэдр, каждая грань которого заменена двумя гранями, состоит из 24 граней.
К закрытым формам средних сингоний относятся дипирамиды, скаленоэдры, трапецоэдры, ромбоэдр и тетрагональный тетраэдр.
Дипирамиды представляют собой как бы две пирамиды, сложенные основаниями, и бывают тригональные и гексагональные или при удвоении числа граней дитригональные, дитетрагональные и дигексагональные.
Габитус кристаллов (лат. HABITUS — внешность) — наружный вид кристаллов, определяемый
преобладающим развитием граней тех или иных простых форм. Примеры габитусов: призматический, дипирамидальный, ромбоэдрический, кубический и др.
различают габитус и облик кристаллов. При этом облик относят исключительно к внешнему виду минерала — столбчатый, пластинчатый и др., а габитусом называют основные кристаллографические элементы, определяющие форму кристалла, дипирамидальный, ромбоэдрический и т. п. В этом случае минералы одного и того же облика, например столбчатого, могут иметь различный габитус, например дипирамидальный или призматический.
Облик кристаллов
морфология минералов:
- изометричные - равномерноразвитые во всех направлениях (куб, октаэдр)

vk.com/club152685050 | vk.com/id446425943
-удлиненные - вытянутые в одном направлении (волокнистые, игольчатые,
призматические, столбчатые)
-уплощеные - вытянутые в двух направлениях при сохранении третьего короткого,
то есть длина и ширина больше толщины (листоватые, чешуйчатые, пластинчатые, таблитчатые).
3 вопрос:
. Помимо единичных индивидов минералы часто образуют сростки из двух или более кристаллов.
Вподобных сростках кристаллы имеют закономерную или неправильную взаимную ориентировку.
Впервом случае сростки называются двойниками, во втором — кристаллическими агрегатами.
Двойниковыми кристаллами принято называть закономерное непараллельное срастание кристаллических индивидов одного минерала, связанных друг с другом осью или плоскостью симметрии, которых нет в одиночныхкристаллах. Благодаря этому двойники как правило имеют повышенную кристаллографическую симметрию.
Двойникование обычно происходит на ранних стадиях кристаллизации, при срастании двух или более кристаллических индивидов. их закономерная ориентировка относительно главных плоскостей решётки обычно сохраняется. Два индивида, составляющие двойник, могут быть мысленно получены один из другого путем отражения в плоскости (двойниковая плоскость) или при повороте на 180° вокруг оси (двойниковая ось). Для большинства двойников характерны входящие углы. Среди двойниковых срастаний можно выделить три типа двойников — двойники срастания, прорастания и полисинтетические двойники.
Двойники срастания бывают, например, — у кальцита, халькопирита, титанита, «японский двойник» у кварца, а Двойники прорастания - у ставролита, киновари,флюорита. В двойниковании
могут участвовать больше чем два индивида. Тогда говорят о тройниках, четверниках, множественных двойниковых сростках (см.хризоберилл).
Морфология - внешний вид, форма минерала или агрегата. Агрегат - совокупность
нескольких минералов.
б) морфология агрегатов: Агрегаты по абсолютной величине:
-гигантозернистые - размер зерен больше 10 мм
-крупнозернистые - размер зерен более 5 мм
-среднезернистые - размер зерен равен 1-5 мм
-мелкозернистые - размер зерен меньше 1 мм
-микрозернистые - зерна видны под микроскопом.
Агрегаты по относительной величине:
-равномернозернистые - состоят из одинаковых по размеру зерен
-неравномернозернистые - состоят из разных по размеру зерен
Двойник - закономерные сростки двух кристаллов, один из которых является как бы
зеркальным отражением другого.
Друза - незакономерные сростки кристаллов, которые имеют общее основание. Щетка - отличается от друзы более мелкими размерами кристаллов.
Конкреция - отложение минерального вещества в виде шаровидных стяжений или
желваков. Отложение происходит от центра к периферии. характерно радиально лучистое строение.
Секреция - полость или пустота, в которой отложение минерального вещества
происходит от периферии к центру. По размеру различают миндалины, жеоды. Миндалины - секреции размером менее 2 см. Жеоды - секреции более 2 см. Оолиты - агрегат мелких шариков размером от 0,02 до 2 см. В центре может быть
обломок раковины или песчинка.
Дендриты - отложения минерального вещества в мельчайших трещинах, похожи на
отпечатки растений.
Натечные агрегаты - образуются в результате отложения минерального вещества из
растворов. Среди них различают почковидные агрегаты (похожи на почки) сталактиты - похожи на сосульки, растущие сверху вниз; и сталагмиты - сосульки, растущие снизу
вверх.

vk.com/club152685050 | vk.com/id446425943
Псевдоморфоза - внешняя форма, которая сохраняется после замещения одного
вещества другим.
Мономинеральный агрегат - состоит из одного минерала (мрамор из кальцита). Полиминеральный агрегат - состоит из многих минералов.
Кроме того, могут быть волокнистые, игольчатые, столбчатые, чешуйчатые, листоватые, пластинчатые,корочки, налеты.
4 вопрос:
. Минера́л (MINERALE — руда[1]) — природное тело с определённым химическим составом и
упорядоченной атомной структурой (кристаллической структурой), образующееся в результате природных физико-химических процессов и обладающее определёнными физическими
свойствами.
Физические свойства минералов зависят от их химического состава и структуры.
Главное внимание мы обратим на свойства, которые используются для индетификации минералов.
Плотность минералов – это масса вещества содержащаяся в объеме 1 см3:
Ρ= m/v (г/см3)
По величинам плотности минералы подразделяются на 5 групп:
1.Очень низкая. (< 1) – лед Н2О (0.92).
2.Низкая (1-4). Сильвин – KCl (2.0); галит – NaCl (2.1); гипс –CaSO4
3.Средняя (4-7). Халькопирит – CuFeS2 (4.2); барит BaSO4 (4.5).
4.Высокая (7-10). Галенит – PbS (7.5);
5 вопрос:
. Очень высокая (>10). Золото – Au (15.6-18.3), платина – Pt (~ 19).
Спайность. Спайностью называется способность минералов раскалываться при ударе по определенным кристаллографическим направлениям с образованием разной совершенности плоскостей раскола. Плоскости спайности проходят перпендикулярно к направлению наиболее слабых сил связи в структуре минерала.
В зависимости от совершенства плоскостей раскола различают следующие степени совершенства спайности. Величины эти относительные и пока не имеют количественных характеристик.
Таблица 2. Шкала спайности минералов
Шкала спайности |
Характер поверхности раскола |
Минералогические примеры |
|
|
|
|
|
Весьма совершенная |
Зеркальная |
Тальк, гипс, слюды, графит |
|
|
|
|
|
Совершенная |
Ровная, гладкая |
Флюорит, кальцит, галенит, |
|
|
|
галит |
|
|
|
|
|
Средняя |
Ровная или неровная |
Полевые шпаты, пироксены, |
|
|
|
роговые обманки |
|
|
|
|
|
Несовершенная |
Неровная |
Кварц, пирит, арагонит |
|
|
|
|
Спайность может проявляться в нескольких направлениях.
В тех случаях, когда минералы характеризуются несовершенной спайностью, диагностическим признаком является поверхность излома, т.е. внешний вид поверхности, образующийся при раскалывании минерала.
Различают следующие виды излома:

vk.com/club152685050 | vk.com/id446425943
неровный – пирит, шеелит и др.; раковистый – кварц, пирит, арагонит и др.; занозистый – андалузит, жадеит; крючковатый – медь, серебро.
У ряда минералов в одном или нескольких направлениях проявляется спайность, а в других – излом различного типа.
Твердость
Под твердостью минералов понимается способность оказывать сопротивление при механическом воздействии (царапании, вдавливании и др.),
Твердость – важное диагностическое свойство минералов, отражающее прочность связей между атомами в структуре минералов.
Твердость определяется различными способами: царапанием, вдавливанием, шлифованием и др. Существуют две шкалы твердости – относительная (по Моосу) и абсолютная.
Таблица 3. Эталонные шкалы твердости минералов
Относительн. |
|
Минералы- эталоны твердости |
Абсолютная |
|
|
|
твердость н кг/мм |
2 |
( |
||
Твердость (по |
|
|
|
||
|
|
по М.М.Хрущеву) |
|
|
|
Моосу) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
Тальк Mg3 [Si4O10] (OH) |
2.4 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
2 |
Гипс Ca [SO4] ∙2H2O |
36 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
3 |
Кальцит Ca [СO3] |
109 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
4 |
Флюорит CaF2 |
189 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
5 |
Апатит Ca5 |
[PO4]3∙(F,Cl) |
536 |
|
|
|
|
|
|
||
|
|
|
|
|
|
6 |
Ортоклаз K [AlSi3O8] |
795 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
7 |
Кварц SiO2 |
|
1120 |
|
|
|
|
|
|
||
|
|
|
|
|
|
8 |
Топаз Al2 [SiO4]∙(F,OH)2 |
1427 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
9 |
Корунд Al2O3 |
2060 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
10 |
Алмаз С |
|
10060 |
|
|
Цвет. Это первое, что бросается в глаза при рассмотрении минералов. Для одних минералов окраска более или менее постоянная, она часто является диагностическим признаком. Такими, например, являются зеленая у малахита Cu2[CO3]∙(OH)2. Окраска минералов наряду с блеском и
люминисценцией относится к оптическим свойствам Цвет черты. Этот признак в сравнении с окраской минерала является более постоянным, т.е. боле надежным диагностическим признаком.
Цвет черты в ряде случаев совпадают с цветом самого минерала. Например, окраска и цвет черты красные у киновари, у магнита – черные,. Для других минералов наблюдается резкое различие между цветом минерала и цветом черты. Например, у гематита: цвет минерала стально-серый или черный, черта красная; у пирита – цвет минерала латунно-желтый, черта черная и т.д.
Блеск. Падающий на минерал световой поток частично отражается его поверхностью, частично поглощается. Этот отраженный свет и создает впечатление блеска минерала, причем чем больше доля отраженного светового потока (в %), тем интенсивнее блеск.
Чисто практическим путем установлены градации интенсивностей блеска.

vk.com/club152685050 | vk.com/id446425943
1.Стеклянный блеск. Минералы с показателями преломления N=1.3-1.9. Это флюорит, кварц и
др.
2.Алмазный блеск. N=1.9-2.6. Сфалерит, циркон, рутил, алмаз.
3.Полуметаллический блеск. N=2.6-3.0. Киноварь, гематит.
4.Металлический блеск. N>3. Галенит, пирит и др.
Среди минералов стеклянным блеском обладают более 70%.
6. Коллоидные минералы
Это оригинальный концентрат коллоидных минералов, высокоэффективный продукт природного происхождения из растительных отложений, открытых в начале XX века в Центральной Америке. При переработке в экстракты не используются кислоты или высокие температуры. Нашему организму требуется 84 из 106 известных элементов для нормального функционирования. Особенно следует подчеркнуть важность минералов при формировании организмом гормонов и энзимов (ферментов), отсутствие или нехватка
которых приводит к целому ряду заболеваний.
Под этим названием в геологии понимают включения посторонних веществ в минералах, из которых слагаются горные породы. Включения эти могут быть разбиты на три группы: 1) включения стекла, 2) включения микролитов, 3) включения жидкости.Включения стекла образуются в минерале в том случае, когда кристалл этого минерала, выделяющийся из
расплавленной магмы, захватывает, при быстром остывании, частицы этой последней. Включения стекла, обыкновенно снабженные неподвижными пузырьками воздуха .Встречаются они в авгите,
роговой обманке, кварце, лейците .В Везувия включения встречаются в таком большом количестве, что как бы пропитывают собой весь минерал. Иногда из включений стекла выделяются небольшие кристаллические образования, что носит название процесса расстеклования. . Включения микролитов в породообразующих минералах — явление
очень распространенное. Микролиты (микроскопические кристаллические образования, природу которых не всегда бывает можно распознать) большею частью располагаются без всякого порядка в заключающем их минерале, иногда же они распределяются с известной закономерностью, напр. по зонам, параллельно очертаниям кристалла полевой шпат, роговая обманка, авгит, магнитный железняк и др. Среди микролитов, природу которых не всегда удается определить, различают белониты — мелкие прозрачные образования различной формы, трихиты —
непрозрачные кристаллические образования, иногда являющиеся в форме отдельных призмочек, иногда же изогнутые наподобие волоса (откуда и название θρίξ, τριχός — волос) и проч. Иногда микролиты располагаются в виде потока, обнаруживая так наз. "микрофлюидальную структуру". Включения жидкости — в кварце, топазе, каменной соли, гипсе и других минералах достигают иногда таких размеров, что могут быть видимы простым глазом (напр. в кварце с о-ва
Арран). В большинстве же случаев размеры их не превышают 0,06 мм. Включения эти имеют различную форму: овальную, яйцевидную и т. п. и обыкновенно содержат подвижный пузырек, чем отличаются от включений стекла. В качестве жидкости может служить вода, раствор хлористого натрия, жидкая углекислота Кроме указанных включений, в минералах нередко наблюдаются и поры, выполненные различными газами, иными словами, включения газов, характерные своими темными контурами, подобно пузырькам воздуха, наблюдаемым в микроскопическом препарате.
Секториальность. Для разных граней кристалла можно выделить пирамиду роста — сектор, который получился в результате нарастания слоев на конкретную грань. Вот различие в пирамидах нарастания разных граней в кристалле и называется секториальность Зональность — маркирует изменение условий роста кристалла во времени. Может повышаться или понижаться температура, меняться состав раствора, на кристалл могут нарастать другие кристаллы, оседать пыль и обломки минералов и т.д. Всё это отражается в кристалле —
изменяться может цвет, прозрачность, включения, могут появлятся или исчезать двойники и т.д. В отличии от секториальности, в которой мы имеем дело с одновременно росшими частями кристалла, в случае зональности части кристалла образовались в разное время.
6 вопрос:

vk.com/club152685050 | vk.com/id446425943
. Подавляющее большинство встречающихся в природе минералов представлено химическими
соединениями. Среди последних различают:
а) соединения постоянного состава (дальтониды) и
б) соединения переменного состава.
3.2.1 Соединения постоянного состава
Характерно, что эти соединения отличаются целым рядом особых физических свойств, отчетливо выступающих на физико-химических диаграммах плавкости, растворимости, электропроводности,
твердости, удельного веса, показателей преломления и пр.
Лишь отдельные индивиды минералов, формирующиеся в специфических условиях природной дистилляции, приближаются к соединениям постоянного состава. Тем не менее в качестве идеализации многие минералы полезно условно рассматривать как соединения постоянного состава.
К числу бинарных химических соединений относятся:
простые оксиды: 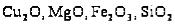
сульфиды: 
галогениды: 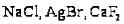
Соединения, состоящие из атомов трех элементов, называются тернарными; таковы различные кислородные соли. 
Существуют, конечно, и соединения более сложного состава.
Химический состав химических соединений может изображаться двояким способом:
ввиде эмпирических формул;
ввиде конституционных или структурных формул.
Помимо бинарных и тернарных химических соединений, в природе распространены и более сложные соединения, например, двойные соли. Двойными солями называются такие соединения постоянного состава, которые состоят как бы из двух простых солей, присутствующих в кратных отношениях. В качестве примеров могут быть приведены следующие:
3.2.2 Соединения переменного состава (твердые растворы, смешанные кристаллы, изоморфные
смеси)
Кроме химических соединений постоянного состава, получаемых обычно в лабораториях с использованием чистых исходных компонентов, существует огромное множество таких соединений, состав которых не является постоянным, а колеблется то в узких, то в более широких пределах, причем эти колебания состава не могут быть объяснены наличием каких-либо механических
примесей посторонних веществ. Наоборот, колеблющийся состав соединений с

vk.com/club152685050 | vk.com/id446425943
кристаллохимической точки зрения находит объяснение в растворимости составных компонентов в данном соединении.
Такие химические образования получили название соединений переменного состава.
Среди минералов соединения переменного состава составляют большинство. Существование веществ (фаз) переменного состава кажется вполне естественным, если речь идет о жидких растворах, состав которых определяется соотношением количеств растворенного вещества и растворителя. Таким образом, состав раствора колеблется в пределах от чистого растворителя до насыщенного раствора; он может быть любым из непрерывного множества возможных составов в пределах, зависящих от температуры и давления. Способность кристаллических веществ различного состава образовывать непрерывно меняющиеся по составу соединения одинаковой кристаллической структуры основана на изоморфизме, т. е. свойстве атомов различных элементов заменять друг друга в твердых химических соединениях.
3.2.3 Водные соединения
К числу водных соединений следует относить только такие, которые в своем составе содержат электрически нейтральные молекулы воды.
В зависимости от того, каким способом удерживается вода в минералах, различают:
кристаллизационную, или связанную, воду, входящую в кристаллические структуры минералов;
свободную воду, не участвующую в строении самого кристаллического вещества.
Связанная вода в кристаллической структуре участвует в виде молекул Н2О, занимающих в ней строго определенные места. Количество молекул воды находится в простых отношениях к другим компонентам соединения. В качестве примеров можно привести следующие: Na2CO3 . 10H2O (сода), Ca[SО4] . 2H2O (гипс), Ni3[AsO4]2 . 8H2O (аннабергит), Аl2[РО4](ОН)3 . 5Н2О (вавеллит).Свободная вода, присутствующая в минеральных массах, характеризуется тем, что не
принимает прямого участия в строении кристаллического вещества минералов. При нагревании она выделяется постепенно.
Различают три вида свободной воды:цеолитную;коллоидную;гигроскопическую.
ХИМИЧЕСКАЯ СВЯЗЬ в кристаллах – это взаимодействие между атомами, ионами или молекулами в кристаллической решётке в результате действия между упомянутыми частицами электрических сил притяжения. Тип и свойства химической связи определяются электPоотрицательностью элементов,
участвующих в ее образовании. Электроотрицательность – это способность атома в молекуле или кристаллической решетке притягивать к себе общие электронные пары.
Между атомами в кристаллических решетках возникают следующие типы химической связи: металлическая и ковалентная (полярная и неполярная; обменная и донорно-акцепторная). Между заряженными частицами
(ионами) возникает ионная связь. При образовании этих типов химической связи атомы и ионы стремятся приобрести устойчивую электронную оболочку, содержащую 2, 8 или 18 электронов и соответствующую внешней оболочке атома ближайшего инертного газа (завершенную оболочку). В качестве особых типов следует выделить ван-дер-ваальсовы межмолекулярные взаимодействия и водородные связи в кристаллах.
Следует понимать, что по своей природе химическая связь всегда одинакова, а выделенные типы лишь являются ее разновидностями
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ – характерна для элементов, атомы которых на внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей, а валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Такими свойствами
обладают атомы металлов. В кристаллических решетках металлов валентные орбитали соседних атомов перекрываются. Благодаря этому электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами металла.

vk.com/club152685050 | vk.com/id446425943
Наличие в кристаллической структуре свободно перемещающихся электронов определяет высокую электропроводность.
КОВАЛЕНТНАЯ СВЯЗЬ образуется путем объединения атомных орбиталей двух соседних атомов в кристаллической решетке. При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" - молекулярную орбиталь. Эта новая оболочка содержит по возможности завершенное
число электронов и заменяет атомам их соб ственные незавершенные атомные оболочки. Два атома могут обобществлять несколько пар электронов. Чем больше пар электронов задействовано в образовании связи, тем прочнее связаны между собой эти атомы и тем короче сама связь.
Ковалентная связь имеет некоторое сходство с металлической, поскольку и в ее основе лежит обобществление валентных электронов. Однако электроны, которые осуществляют ковалентную связь, находятся вблизи соединенных атомов и прочно с ними связаны. Электроны же, осуществляющие металлическую связь, свободно перемещаются по всему кристаллу и принадлежат всем его атомам.
Различают обменный и донорно-акцепторный механизмы образования ковалентной связи:
1)Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару;
2)Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом
(акцептор) предоставляет для этой пары свободную орбиталь. Образованная таким путем ковалентная связь называется ДОНОРНО-АКЦЕПТОРНОЙ. Но это не особый тип, а лишь иной механизм образования ковалентной связи.
Если сгущения электронной плотности, соответствующие молекулярным орбиталям, расположены симметрично между атомами, то ковалентная связь называется неполярной. Она может быть образована атомами одного и того же элемента, такая ковалентная связь существует в молекулах одноэлементных газов, например,H2, O2, N2, Cl2 и структуре алмаза. Если сгущение электронной плотности смещено к одному из
атомов, то ковалентная связь называется полярной. Она образуется между атомами элементов, обладающих различающейся электроотрицательностью. Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Ковалентная связь обладает высокой прочностью. Вещества с ковалентной связью характеризуются высокими температурами плавления, высокой твердостью и хрупкостью.
ИОННАЯ СВЯЗЬ. Тип связи, обусловленной переносом валентных электронов с одного атома на другой с образованием положительных и отрицательных ионов и электростатическим взаимодействием между ними.. Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения
электронов. При высокой разнице электроотрицательностей электронная пара, осуществляющая связь, переходит к наиболее электроотрицательному из них. Ионы, отдавшие электроны и имеющие положительный заряд, называются катионами, а принявшие электроны и имеющие отрицательный –
анионами.
Ионная связь обладает высокой прочностью, что определяет высокие температуры плавления ионных соединений. Отсутствие свободных электронов приводит к низкой электропроводности веществ с ионной связью. Вещества с ионным типом связи обладают в большинстве случаев средней и низкой твердостью, средними значениями плотности.
ВАН-ДЕР-ВААЛЬСОВА СВЯЗЬ (остаточная) соединяет нейтральные атомы, молекулы или структурные единицы с помощью малых остаточных зарядов на их поверхности Между такими диполями начинают действовать силы притяжения. Ван-дер-ваальсова связь – одна из самых слабых химических связей и,
присутствуя в минералах в качестве добавочной, определяет зоны хорошей спайности и низкой твердости. Можно представить следующие механизмы возникновения ван-дер-ваальсовой связи.
Диполь-дипольные взаимодействия. Электрическое поле мгновенного или постоянного диполя индуцирует мгновенный диполь в соседних частицах, если они достаточно сближены, и вследствие этого частицы ориентируются противоположными полюсами друг к другу и притягиваются. Силы, действующие между диполями, называются ориентационными.

vk.com/club152685050 | vk.com/id446425943
Диполь может индуцировать в другой молекуле диполь за счет поляризации последней. Такие взаимодействия называются индукционными. Оба диполя будут ориентироваться так, чтобы возникло притяжение между ними.
Ион-дипольные взаимодействия – это электростатическое притяжение некоторого заряда (например, иона) к молекуле с постоянным дипольным моментом.
ВОДОРОДНАЯ СВЯЗЬ может быть межмолекулярной и внутримолекулярной. Межмолекулярная водородная связь возникает между молекулами, в состав которых входит атом водорода и атом сильно электроотрицательного элемента (F, O, N и др.). Поскольку в такой молекуле общая электронная пара
сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной электронной парой атома или иона из другой молекулы, притягивая ее. В результате образуется вторая, более слабая связь – водородная.
На схеме, приведенной ниже, можно показать и положение отдельных видов химической связи в бинарных соединениях типа АВ, в которых А и В — элементы из любой группы Периодической системы.
Вкристаллохимии координационное число — характеристика, которая определяет число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке.
Прямые линии, соединяющие центры ближайших атомов или ионов в кристалле, образуют координационный многогранник, в центре которого находится данный атом.
Врешётках Браве для всех узлов координационное число одинаково. Число ближайших соседей отражает плотность упаковки вещества. Чем больше координационное число, тем больше плотность и соответственно свойства вещества ближе к металлическим. Данному параметру решетки соответствует первая, вторая (соседи, следующие за ближайшими), третья и т. д. координационные группы частиц. координационное число равно 4, координационный многогранник — тетраэдр; координационное число равно 6. Каждый ион натрия окружен шестью атомами хлора, расположенным по вершинам октаэдра, координационный многогранник — октаэдр. оординационное число равно 8; координационный многогранник — куб. координационное число равно 12; координационный многогранник — кубооктаэдр.
7 вопрос:
Координационные структуры характеризуются одинаковыми расстояниями между атомами. Некоторые минералы представлены огромными массами почти мономинеральных пород или промышленных скоплений - месторождений полезных ископаемых, такие как магнетит, магнезит,
кальцит, гипс, галит3+ и пр.
Островные структуры характеризуются различными межатомными расстояниями. Анионные радикалы или замкнутые молекулы представляют собой как бы отдельные
╚острова,оливи,топаз
Цепочечные структуры образованы бесконечными одномерными радикалами, которые состоят из линейно-связанных координационных полиэдров. Расстояние между атомами
в пределах цепочек меньше, а прочность химических связей больше, чем между ними Структуры слоистые (листовые) отличаются тем, что межплоскостные расстояния в пределах плоскости (слоя) меньше, чем между плоскостями (слоями), и соответственно атомы прочнее связаны с соседними атомами плоскости (слоя), чем с атомами другой плоскости (другого слоя). Графит С, тальк Каркасные структуры характеризуются ажурным объемным соединением
координационных полиэдров всеми общими вершинами или ребрами. В крупных пустотах каркаса могут располагаться большие по размерам атомы. Структуры с каркасным мотивом имеют кварц SiO2 и полевые шпаты
vk.com/club152685050 | vk.com/id446425943
Чтобы классифицировать дефекты кристаллической решетки, необходимо ввести некоторое понятие
совершен-ного кристалла, относительно которого можно определять характерные признаки несовершенств
кристаллической решетки. Совершенным крис-таллом называется полностью симметричная бесконечная структура с атомами, размещен-ными строго в узлах решетки, причем кристалл в целом находится в своем основном квантовомеханическом состоя-нии (при Т=ОК, когда кван-товомеханическая система име-ет
наименьший энергетический уровень). При любых нарушениях в расположении атомов или возбуждениях основного состояния говорят о несовершенном кристалле. Характером и степенью нарушения правильности, или совершенства, кристалличес-кого строения в значительной мере определяются свойства
кристаллических тел.
Совокупность дефектов решетки и их пространственное распределение в кристалле называют субструктурой кристалла. Несмотря на незначительную концентрацию дефектов решетки, они
оказы-вают на многие структурно-чувствительные св-ва сущест-венное, а на некоторые (напри-мер, на пластичность) решаю-щее влияние.
Условимся различать безде-фектные и дефектные области. Последние можно ограничить поверхностями,
проходящими полностью по бездефектным областям. Если такие замкнутые объемы ни в одном из измерений не превышают размеров атомов, то говорят о нульмерных, илиточечных, дефектах. Это незанятые узлы решетки — вакансии; неправи-льно занятые узлы решетки — примесные атомы; атомы, разместившиеся в межатомных промежутках, —межузельные чужие внедренные атомы.
Если размеры дефектной области хотя бы в одном направлении превышают размеры атомов, то говорят об одномерных, или линейных, дефектахрешетки, называемых дислокациями.
Имеются также двумерные дефекты решетки:границы зерен, дефекты упаковки, границы двойников.
Дефектную трехмерную область, размеры которой превышают размеры атомов, можно рассматривать как новую фазу.
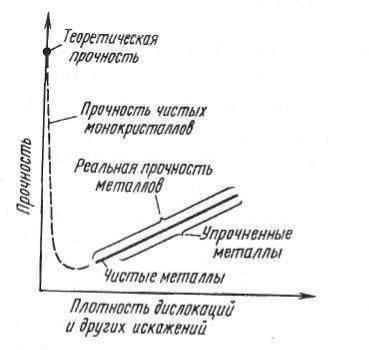
Прочность кристалла в зависимости от дефекта решетки
. Классификация типов дефектов.
В общем случае типы дефектов можно классифицировать следующим образом.
1). Колебания решетки.
vk.com/club152685050 | vk.com/id446425943
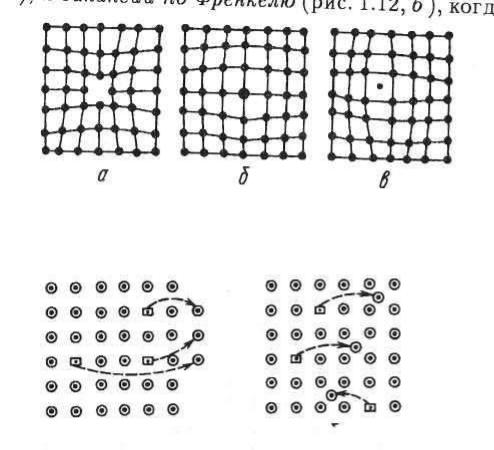
2). Вакансии и внедренные атомы. Незанятый узел решетки называется вакансией (рис. а), а атомы, расположен-ные между узлами, назы-ваются внедренными
(рис. в).. Число вакансий при нормальной (комнатной) температуре мало по сравнению с общим числом атомов (для металлов примерно 1 вакансия на 1018атомов), но сильно увеличивается с повы-шением температуры, особенно когда она становится близкой к температуре плавления (1 вакансия на 104 атомов).
Схемы точечных дефектов: а — вакансия; б — замещен-ный атом; в — внедренный атом
Схема дефектов (вакансий) по Шотки (1) и по Френклю (2).
Различают вакансии по Шотки (рис.1.), когда атом после отрыва от своего места в решетке попадает в конеч- ном счете на поверхность кристалла (возможно, и на внутреннюю), и вакансии по Френкелю(рис.2), когда
такой атом остается внутри решетки. Это означает, что одновременно с вакансией по Френкелю всегда образуется межузельный внедренный атом.
3).Примеси. Инородные атомы называются примесью замещения(рис. б) или примесью внедрения (рис. в)
в зависимости от того, занимают они место в узлах решетки или между ними.
Примеси, вакансии и внедренные атомы — это точечные дефекты.
4).Дислокации. Линейные дефекты кристаллической ре-шетки называются дислока-циями. Пусть в кристалли-ческой решетке по каким-либо причинам появилась лишняя полуплоскость атомов, так называемая экстраплоскость (рис. 3, а). Край 1—1 такой плоскости образует линейный дефект решетки,
который назы-вается краевой дислокацией.
Краевая дислокация может иметь любую форму и в пределе может перейти в спираль, образуя винтовую дислокацию (рис.3,б).
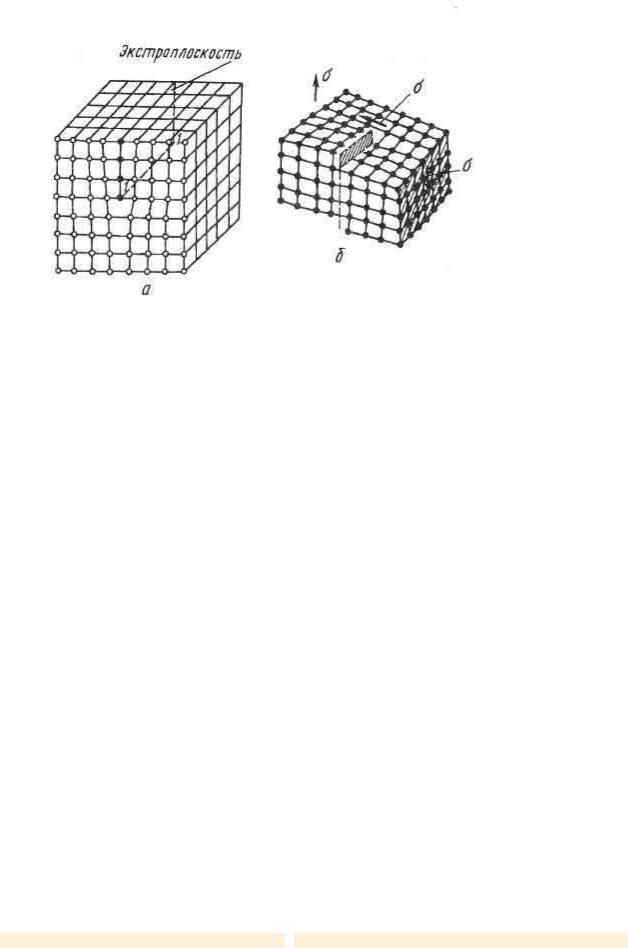
vk.com/club152685050 | vk.com/id446425943
Рис 3. Краевая (а) и винтовая (б) дислокации в кристаллической решетке.
5).Беспорядок. Некоторые кристаллы состоят более чем из одного типа атомов, например ионные кристаллы NaCl. В совершенном (полностью сим-метричном) кристалле каждый узел решетки занят опре-деленным химическим элемен-том. Если же некоторый химический элемент занимает не соответствующий ему узел
решетки, то образуется дефект, который называют беспорядком.
6). Поверхности. Любой реаль-ный кристалл ограничен в пространстве, поэтому струк-тура идеальной
решетки у поверхности нарушается и атомы в окрестности поверхности не могут находиться в полностью симметричном положении. Кро-ме внешних поверхностей крис-талл может иметь также внутренние поверхности: границы зерен и дефекты упаковки. Граница зернапредставляет собой разупоря-доченную область, отделяю-щую решетку с одной ориен-тацией от решетки с другой ориентацией. Возможна меж- зеренная граница особого типа, называемаядвойником, отно-сительно которой атомы зеркально
симметричны друг другу. Дефект упаковки связан с нарушением последовательности укладки кристаллических слоев, т.е. с отсутствием какого-либо одного слоя атомов в кристалле. Дефект упаковки представляет собой поверх-ность нерегулярности в криста-лле, в окрестности которого изменяется тип
межатомной связи.
7). Электронные дефекты. При выводе системы из основного квантовомеханического состоя-ния (при возбуждении каких-либо атомов кристалла) все атомы могут располагаться так же, как в совершенном кристал-ле. Тем не менее вследствие электронного возбуждения ато-мов кристаллическая решетка не будет совершенной. Например, в кристалле-изоляторе такими несовершен-ствами являются электроны
проводимости.
Приведенная классификация дефектов кристаллической решетки позволяет перейти к описанию строения зерен, совокупность которых составляет макроструктуру любого реального кристаллического тела. Зерно не является монолитным кристаллом, построенным из строго параллельных атомных слоев. В действительности оно состоит из мозаики отдельных блоков размерами 10-7...10-5 м, кристаллографические плоскости которых
повернуты относительно друг друга на небольшой угол, примерно равный нескольким минутам. Такое строение зерна носит название мозаичной структуры, а составляющие ее блоки называютсяблоками мозаики.
Часто блоки объединяются в более крупные агрегаты фрагменты.Каждый фрагмент содержит большое
количество блоков.
Таким образом, реальный кристалл содержит атомно-кристаллические (вакансии, дислокации и др.)
и структурные(блоки, фрагменты) несовершенства.
8 вопрос:
vk.com/club152685050 | vk.com/id446425943
. Вода находится в горных породах благодаря наличию в них всевозможных пустот (трещин, пор, каналов и т.д.). Абсолютно сплошных пород, не содержащих сколь-нибудь малое количество пор, в
природе не существует. Эти пустоты, как правило, и занимает вода благодаря своей высокой подвижности (мобильности, текучести) наряду с другими мобильными компонентами, например такими, как газы, углеводородные флюиды и др. Установлено, что ниже уровня грунтовых вод до глубин около 4 – 5 км и более практически все пустоты горных пород (за исключением
углеводородных залежей) заполнены водой, образующей в пределах литосферы региональные неразрывные макроскопические системы гидросферы. Они – предмет исследования гидрогеологии, науки, изучающей условия формирования, динамику и распространение запасов подземных вод на Земле. Мы же остановимся на некоторых интересных и важных особенностях воды в горных породах, проявляющихся в основном не на макроскопическом, а на микроскопическом уровне.
Очевидно, не многие знают, что вода в горных породах находится либо в свободном, либо в связанном состоянии. Поэтому выделяют две категории воды в горных породах – свободную и связанную. Свободная вода – это та, с которой все мы обычно привыкли иметь дело: она свободно может перемещаться в породах по крупным порам, трещинам путем фильтрации под действием силы тяжести или напора, она образует горизонты подземных вод и обладает обычными для воды физическими свойствами. Именно эта вода добывается и эксплуатируется человеком для различных нужд. В отличие от нее связанная вода находится и удерживается в наиболее мелких порах и трещинах горных пород и испытывает со стороны поверхности твердой фазы минералов «связывающее» влияние разной природы и интенсивности, изменяющее ее структуру и придающее ей аномальные свойства, то есть не такие, как у обычной, свободной воды. Суммарное содержание связанной воды в литосфере Земли составляет от 0,31 до 0,35 млрд. км3, то есть
около 42% от общего количества воды в земной коре (по данным Ф.А. Макаренко). Однако связанную воду не так просто извлечь из породы, в которой она находится. Под действием поверхностных сил разной природы она относительно прочно удерживается на поверхности минералов, не подчиняется силам гравитации и ее передвижение в породах может происходить лишь под влиянием сил иной природы.
Категории воды в горных породах
Связанная вода в горных породах неоднородна. В ней может быть выделен ряд категорий, отличающихся по природе и условиям образования, по свойствам и многим другим особенностям. С середины 30-х годов вплоть до нашего времени было предложено много различных
классификаций воды в горных породах, но наиболее обоснованной является классификация Р.И. Злочевской (1988), согласно которой вода в горных породах может относиться к трем категориям: связанной, переходного типа и свободной.
Согласно этой классификации, связанная вода удерживается в породе за счет химических и физических сил связи (с энергией 0,1 – 800 кДж/моль), действующих со стороны поверхности минералов и изменяющих структуру и свойства воды. Она бывает двух видов. К первому относится вода, входящая в состав кристаллических решеток различных минералов. Это так называемая конституционная, немолекулярная форма воды типа ОН-групп, кристаллизационная
вода различных кристаллогидратов (если они есть в данной горной породе), а также вода, «связанная» координационно-ненасыщенными атомами и ионами кристаллической решетки
минералов. Ко второму виду относится адсорбционная вода, образующаяся за счет адсорбционного «притяжения» молекул воды к активным адсорбционным центрам поверхности минералов. Среди нее выделяются две разновидности:
а) с наибольшей энергией притяжения к поверхности (около 40 – 120 кДж/моль) – вода мономолекулярной адсорбции.
б) с меньшей энергией связи (<40 кДж/моль) – вода полимолекулярной адсорбции.
Связанная вода образует адсорбционные пленки толщиной в один или несколько молекулярных слоев и в горных породах содержится в порах или микротрещинах размером менее 0,001 мкм. У этого типа воды физические свойства в наибольшей степени отличаются от свободной.
Вода переходного типа (от связанной к свободной) в меньшей степени подвергается действию поверхностных сил, она удерживается вблизи поверхности минералов за счет более слабых связей. Поэтому ее структура менее искажена, а отличия в физических свойствах по сравнению со свободной водой менее значительны или почти не существенны. В пределах этого типа выделяется два вида воды: осмотически-поглощенная и капиллярная. Первый вид образуется в
горных породах за счет процессов избирательной диффузии молекул воды в направлении к минеральной поверхности, обусловленной наличием у последней «ионной атмосферы» – так
vk.com/club152685050 | vk.com/id446425943
называемого двойного электрического слоя, состоящего обычно из катионов порового раствора, «компенсирующих» отрицательный заряд минеральных частиц.
Двойной электрический слой имеет две части: внутреннюю, называемую адсорбционным слоем (с), и внешнюю – диффузный слой (d). Концентрация катионов экспоненциально увеличивается по нормали к минеральной поверхности и это обусловливает наличие градиента концентрации, вызывающего «осмотическое» передвижение молекул воды из объема свободного порового раствора (е) в пределы двойного электрического слоя (d). Образующаяся таким образом осмотическая вода занимает внешнюю часть двойного электрического слоя – диффузный слой (d). «Осмотической» эту воду назвали потому, что ее образование связано с явлением микроскопического поверхностного осмоса, напоминающего обычный макроскопический осмос. Движение воды через полупроницаемую мембрану (то есть пропускающую относительно малые по размеру молекулы воды, но не пропускающую более крупные катионы) под действием градиента концентрации (хорошо известна роль подобных «мембран» в клетках многих животных организмов, тоже содержащих «осмотическую воду»). В горных породах роль этой «полупроницаемой мембраны» выполняет внешняя граница двойного электрического слоя. С этой категорией воды тесно связана способность многих глинистых пород набухать, то есть увеличивать свой объем при впитывании влаги.
Второй вид воды переходного состояния – это капиллярная вода. Она образуется в порах капиллярного размера (диаметром от 10- 3 до 103 мкм) за счет капиллярного давления и
удерживается в горной породе капиллярными силами водных менисков (силами поверхностного натяжения), образующихся на границе фаз вода-воздух-твердая поверхность. Капиллярные силы
практически не меняют структуры воды и поэтому капиллярная вода по основным физическим свойствам практически не отличается от свободной. Она может формироваться в горных породах двояко:
1)за счет так называемого явления капиллярной конденсации, когда молекулы воды постепенно конденсируются на поверхности пленки адсорбированной влаги, обволакивающей частицы породы, и, сливаясь в местах контакта (на стыке частиц), образуют водные мениски.
2)за счет капиллярного впитывания воды по сообщающимся порам, трещинам и каналам при контакте породы со свободной водой.
К третьему типу относится собственно свободная вода, обладающая физическими свойствами обычной воды. В горных породах она делится на два вида:
1)вода замкнутая (иммобилизованная) в крупных порах породы и поэтому не участвующая в процессах фильтрации и движении подземных вод.
2)текучая свободная вода (вода грунтового потока).
Виды воды в горных породах
Горные породы содержат различные виды воды. Ее состояние и свойства в рыхлых песчаных и глинистых породах впервые были экспериментально изучены советским ученым А.Ф. Лебедевым, выделившим несколько видов воды в горных породах, отличающихся физическими свойствами. Позднее идеи А.Ф. Лебедева получили дальнейшее развитие в работах В.А. Приклонского, А.А. Роде, А.М. Васильева, В.Д. Ломтадзе, Е.М. Сергеева и др. В настоящее время предложено следующее подразделение видов воды в породах:
I. Вода в форме пара.
II.Физически связанная вода:
1)прочносвязанная (гигроскопическая) вода;
2)слабосвязанная (пленочная) вода.
III.Свободная вода:
1)капиллярная вода;
2)гравитационная вода.
IV. Вода в твердом состоянии.
V. Кристаллизационная вода и химически связанная вода.
Вода в форме пара содержится в воздухе, заполняющем пустоты и трещины горных пород, свободные от жидкой воды. Парообразная вода находится в динамическом равновесии с другими видами воды и с парами атмосферы. Прочносвязанная вода образуется непосредственно на поверхности частиц горных пород в результате процессов адсорбции молекул воды из паров и прочно удерживается под влиянием электрокинетических и межмолекулярных сил. Вследствие этого она и получила название прочносвязанной или гигроскопической. Содержание
