
- •Химическая технология неорганических веществ. Основные производства
- •Химическая технология неорганических веществ. Основные производства
- •Предисловие
- •Лекции №1-2 получение синтетического аммиака
- •1. Общие сведения.
- •1.1.Свойства аммиака.
- •1.2. Значение и применение аммиака.
- •2.Физико-химические основы синтеза аммиака.
- •3. Технологическая схема синтеза аммиака при среднем давлении.
- •4. Основные направления развития производства аммиака.
- •Лекции №3-4 химия и технология азотной кислоты.
- •1.Общие сведения.
- •1.1.Физические свойства Диаграммы состояния.
- •1.2. Химические свойства.
- •1.4. Применение азотной кислоты.
- •1.5. Способы получения азотной кислоты.
- •2. Получение неконцентрированной азотной кислоты из аммиака (химические уравнения и стадии).
- •3. Физико-химические основы процесса окисления аммиака.
- •3.1. Химические уравнения процесса окисления аммиака и их анализ.
- •3.2. Выбор оптимальных условий процесса окисления аммиака.
- •3.2.1. Катализаторы процесса окисления аммиака.
- •3.2.2. Скорость окисления аммиака.
- •3.2.3. Определение оптимальной температуры.
- •3.2.4. Определение оптимального давления процесса.
- •3.2.5. Состав газовой смеси.
- •4. Физико-химические основы процесса окисления нитрозных газов (no в no2).
- •5. Физико-химические основы процесса поглощения оксидов азота водой.
- •6. Очистка отходящих газов.
- •Лекция № 5 Получение неконцентрированной азотной кислоты в промышленности.
- •1. Основные операции и принципиальная схема.
- •2. Технологические схемы производства неконцентрированной азотной кислоты.
- •3. Принципиальная технологическая схема получения неконцентрированной азотной кислоты под повышенным давлением
- •Лекция № 6 Получение концентрированной азотной кислоты.
- •1. Общая характеристика методов получения концентрированной азотной кислоты.
- •2. Получение концентрированной азотной кислоты из разбавленных растворов.
- •3. Прямой синтез концентрированной азотной кислоты.
- •3.2. Основные стадии.
- •3.3. Технологическая схема производства концентрированной азотной кислоты прямым синтезом.
- •Лекция № 7 Химическая технология серной кислоты
- •1. Общие сведения.
- •1.1 Значение и применение серной кислоты.
- •1.2 Свойства серной кислоты.
- •1.3 Сырьевые источники.
- •1.4. Промышленные сорта серной кислоты.
- •1.5. Способы получения серной кислоты.
- •2. Производство серной кислоты.
- •2.1. Основные стадии производства серной кислоты.
- •2.2. Получение диоксида серы so2.
- •3. Получение so2 из флотационного колчедана.
- •3.1. Основные стадии получения диоксида серы.
- •3.2. Физико-химические основы процесса обжига флотационного колчедана.
- •3.3. Очистка обжигового газа от пыли.
- •3.4. Специальная тонкая очистка печного газа
- •3.5. Осушка обжигового газа.
- •3.6. Принципиальная схема производства.
- •Лекция №8 Получение диоксида серы из серы.
- •Технологические свойства серы.
- •2. Теоретические основы горения серы.
- •3. Схема установки для сжигания серы в распылённом состоянии.
- •3.6. Схема производства серной кислоты из серы.
- •Лекция № 9 физико-химические основы Контактного окисления диоксида серы
- •Анализ химического уравнения.
- •Выражение для константы равновесия.
- •Кинетическое уравнение.
- •4. Выбор оптимальных условий ведения процесса.
- •4.1. Влияние состава исходной газовой смеси.
- •4.2. Влияние температуры.
- •4.3. Влияние давления.
- •4.4. Катализаторы
- •Лекция №10 абсорбция. Очистка отходящих газов. Производство серной кислоты из сероводорода
- •1. Абсорбция триоксида серы.
- •2. Очистка отходящих газов.
- •3. Производство серной кислоты из сероводорода.
- •4. Основные направления совершенствования сернокислотного производства.
- •Лекция № 11 Электрохимические производства.
- •1. Общие сведения.
- •2. Теоретические основы электролиза.
- •3. Электролиз воды.
- •Лекция №12 Электролиз водного раствора хлорида натрия
- •Общие сведения.
- •2. Электрохимические процессы, протекающие при электролизе водного раствора хлорида натрия.
- •3. Промышленные электрохимические методы получения хлора.
- •4. Электролиз водных растворов хлоридов с применением стального катода.
- •4.1. Приготовление и очистка рассола.
- •4.2. Побочные процессы электролиза.
- •4.4. Технологическая схема производства водорода, хлора и щелочи.
- •4.5. Выпаривание электролитического щёлока.
- •5. Электролиз водного раствора хлорида натрия с ртутным катодом.
- •5.1. Физико-химические основы процесса.
- •5.2. Принципиальная схема электролиза с ртутным катодом.
- •Лекция №13 Производство хлористого водорода и соляной кислоты.
- •1. Свойства и применение хлористого водорода.
- •2. Способы производства хлористого водорода.
- •3. Теоретические основы синтеза хлористого водорода.
- •4. Абсорбция хлороводорода или получение соляной кислоты.
- •5. Схема получения хлороводорода и соляной кислоты.
- •6. Получение жидкого хлороводорода.
- •Лекция № 14 Химическая технология Получения нитрата аммония или аммиачной селитры
- •1. Общие сведения.
- •Физические свойства нитрата аммония.
- •1.2. Химические свойства нитрата аммония.
- •1.3. Технологические свойства.
- •1.4. Применение нитрата аммония.
- •1.5. Характеристика готового продукта.
- •2. Технология производства нитрата аммония.
- •2.1. Физико-химические основы процесса синтеза нитрата аммония.
- •2.2. Технологические схемы производства.
- •3. Техника безопасности в производстве аммиачной селитры.
- •Лекция № 15 Производство карбамида.
- •1. Общие вопросы.
- •1.1. Свойства карбамида.
- •1.2. Применение карбамида.
- •1.3. Сырьё.
- •2. Физико-химические основы процесса синтеза карбамида.
- •2.1. Химические уравнения и их анализ.
- •2.2. Оптимальный технологический режим процесса синтеза карбамида.
- •3. Промышленные схемы производства карбамида.
- •4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
- •5.Стриппинг-процесс.
- •Лекция №16 Производство кальцинированной соды или карбоната натрия.
- •Общие сведения.
- •2. Свойства и нахождение в природе карбоната натрия.
- •3. Получение кальцинированной соды по способу Леблана.
- •4.1. Химические реакции их анализ.
- •4.2. Основные операции (или стадии) производства кальцинированной соды.
- •4.3 Теоретические основы производства кальцинированной соды аммиачным способом.
- •4.4. Принципиальная технологическая схема производства кальцинированной соды по аммиачному способу
- •5. Получение гидрокарбоната натрия
- •Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
- •1. Общие сведения.
- •2. Известковый способ производства гидроксида натрия
- •Химические реакции
- •Физико-химические основы процесса каустификации
- •Основные операции технологического процесса.
- •3.Ферритный способ производства гидроксида натрия.
- •3.1. Сырьё.
- •3.2. Химические реакции.
- •3.3. Основные стадии.
- •3.4. Расходные коэффициенты.
- •3.5. Совершенствование метода.
- •Элементы технологического расчёта реактора.
- •Список рекомендуемой литературы
- •Оглавление
- •650000, Кемерово, ул, Весенняя, 28.
- •650000, Кемерово, ул. Д.Бедного, 4а.
Основные операции технологического процесса.
Технологический процесс производства NaOH по известковому способу включает следующие основные операции:
1 – Приготовление содового раствора (или декарбонизация).
2 – Приготовление так называемого «нормального» раствора.
3 – Взаимодействие «нормального» содового раствора с гидроксидом кальция (первая каустификация).
4 – Отделение шлама, содержащего непрореагировавшую активную известь после первой каустификации.
5 – Обработка полученного шлама жидкостью из декарбонатора (вторая каустификация).
6 – Промывка шлама
7 – Упаривание щелоков
8 – Обезвоживание гидроксида натрия.
Приготовление содового раствора. Для получения каустической соды по известковому способу обычно технический (или сырой) гидрокарбонат разлагают паром в растворе. Этот процесс называют декарбонизацией. Ему соответствует уравнение реакции:
2NaHCO3 = Na2CO3 + CO2↑ + H2O. (2.3).
При нагревании раствора в течении нескольких минут до 95–98 ºС превращается в NaOH около 75 % NaHCO3. Для превращения остальных 25 % NaHCO3 требуется значительно больше времени.
Разложение ускоряется при пропускании в раствор водяного пара, который подогревает жидкость до 105–110 ºС, уносит диоксид углерода, понижая, таким образом, его давление над раствором и смещая равновесие реакции (2.3) вправо.

Рис.35. Схема декарбонизации
1 – скребковый транспортер; 2– смеситель с питателем; 3, 5 – сборники; 4 – декарбонатор; 6 – напорный бак.
При декарбонизации одновременно с диоксидом углерода отгоняется паром аммиак, содержащийся в сыром гидрокарбонате в виде (NH4)2CO3. Карбонат аммония разлагается по уравнению:
(NH4)2CO3 = 2NH3 + CO2↑ + H2O. (2.4).
На рисунке (Рис.35) представлена схема декарбонизации раствора гидрокарбоната натрия.
Описание схемы.
Со скребкового транспортера 1 часть сырого гидрокарбоната поступает через питатель в вертикальный смеситель 2 (большая часть сырого гидрокарбоната идет на кальцинирование). Сюда же из напорного бака 6 непрерывно подается жидкость (конденсат), поступающая из цеха выпарки гидроксида натрия.
Образующаяся в смесителе 2 гидрокарбонатная пульпа перетекает в сборник 3, снабженный мешалкой, оттуда насосом перекачивается в декарбонатор 4. В верхней части декарбонатора имеются барботажные тарелки; нижняя (скруберная) часть колонны заполнена насадкой. В нижнюю часть декарбонатора подается отработанный пар давлением не ниже 0,15 МПа, который движется противотоком к гидрокарбонатной суспензии и нагревает ее. При этом происходит разложение NaHCO3 (уравнение 2.3) с образованием раствора, содержащего примерно 305 г/дм3 Na2CO3. Раствор карбоната натрия стекает в нижнюю бочку-базу декарбонатора и далее через сборник 5 перекачивается на каустификацию.
Парогазовая смесь (ПГС), выходящая из верхней части декарбонатора, направляется в холодильник газа содовых печей, где присоединяется к потоку СО2, поступающему из печей (см. «Производство каустической соды Na2CO3»).
Декарбонатор – чугунная колонна барботажного или барботажно-скруберного типа D = 2,8 м и Н = 31 м. Верхняя часть состоит из семи барботажных бочек с одинаковыми тарелками. Под барботажными тарелками расположены 18 скруберных бочек, заполненных коксовой насадкой.
Пар подается в третью бочку снизу; две нижние бочки переливные. Гидрокарбонатная суспензия поступает в верхнюю часть колонны; содовый раствор выходит из нижней бочки-базы.
В нижней части декарбонатора поддерживается давление около 0,14 – 0,15 МПа и температура 105–110 ºС, что уменьшает растворимость СО2, увеличивает скорость разложения NaHCO3 и, следовательно, увеличивает степень декарбонизации.
Технологический режим процесса декарбонизации
Общая щелочность суспензии, н.д. 105–115
Состав готового раствора:
Na2CO3…………………………………………………...90–100
NaHCO……………………………………………………10–15
NaCl………………………………………………………...0,3
Степень декарбонизации, % не менее…………………….85
Температура газа на выходе из декарбонатора, ºС…….90–92
Расход тепла в процессе декарбонизации ~ 2500 кДж из 1 кг соды в растворе.
*1 н.д. (нормальное давление) соответствует 1/20 моль экв. вещества в 1 дм3 раствора. Для того, чтобы концентрацию, выраженную г/дм3, представить в н.д., необходимо данную величину разделить на моль экв. вещества и умножить на 20. Например, 305–310 г/дм3 NaCl соответствует 104,3–106 н.д. Для пересчета н.д. в г/дм3 нужно число н.д. умножить на моль экв. данного вещества и разделить на 20.
Приготовление «нормального» раствора. «Нормальный» содовый раствор приготавливают в смесителе 1, куда подаются дозированные количества декарбонизованного содового раствора, раствора осадка после выпаривания щелока и щелочной воды
«Нормальный» содовый раствор должен иметь следующий состав (в н.д.):
Общая щелочность, не менее………………………………. 80
NaOH, не более……………………………………………….20
NaCl, не более……………………………………………......0,2
Na2SO4……………………………………………………..…6–7
*Установлено, что при упаривании в присутствии Na2SO4 улучшается выпадение NaOH в осадок.
Температура «нормального» содового раствора должна быть не выше ºС. При повышении температуры раствор охлаждают.
Первая каустификация. Эта стадия проводится при избытке извести около 10 % во вращающемся аппарате – горизонтальном каустицере 2. Внутри барабана имеется стальная рубашка толщиной 10 мм, предохраняющая стенки барабана от истирания. С торцов барабан закрыт стальными крышками с отверстиями. Через одну из этих крышек загружается известь (СаО) и «нормальный» содовый раствор (Na2CO3).
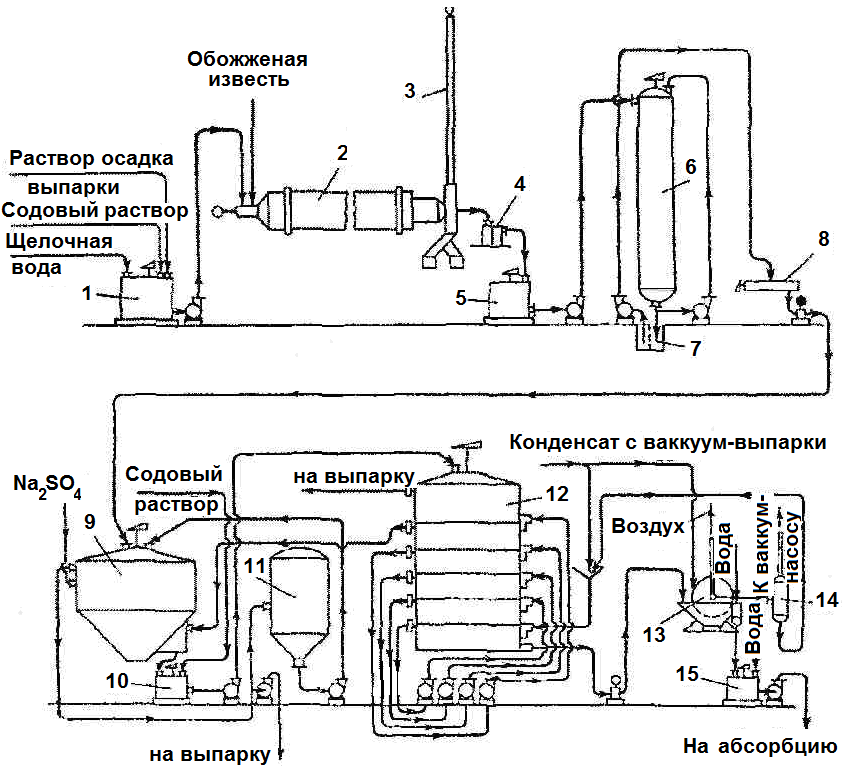
Рис. 36. Схема производства каустической соды по известковому способу:
1 – смеситель; 2, 6 – каустицеры; 3 – вытяжная труба; 4 – ловушка; 5, 7, 11, 15 – сборники; 8 – распределительный коллектор; 9 – отстойник: 10 – бак с мешалкой; 12 –аппарат для промывки шлама; 13 – вакуум-фильтр; 14 – отделитель.
С противоположного торца выгружают полученную суспензию (щелок со шламом). Каустицер слегка наклонен в сторону выгрузки.
Характеристика каустицера:
– производительность каустицера – 150 т/сут. каустической соды;
– степень каустификации раствора – 75 %;
– объем каустицеров – 1,0–1,5 м3 на 1 т/сут. каустической соды.
В каустицер поступает обожженная известь в виде кусков размером 20–40 мм и дозируемое количество «нормального» содового раствора из смесителя 1. В каустицере протекают реакции (2.1) и (2.2).
Получается суспензия – в растворе гидроксид натрия NaOH, а в твердой фазе малорастворимые соединения (СаСО3, непрореагировавший Са(ОН)2 и примеси).
На выходе суспензии из кауститцера 2 установлена вытяжная труба 3 для удаления выделяющихся паров в атмосферу.
Отделение шлама. Полученная в каустицере 2 щелочная суспензия отделяется в ловушке 4 от шлама, представляющего собой мелкие куски извести, кокса и твердых примесей. Суспензия поступает в сборник 5 с мешалкой, а оттуда – в систему (из 2–3 шт.) вертикальных каутицеров, на вторую стадию каустификации.
Вторая каустификация. В вертикальных каустицерах 6 (на рисунке 36 показан один) происходит вторая стадия каустификация. Степень каустификации доводится до 85–90 %. Далее жидкость стекает в сборник 7, где отделяется от твердых примесей (песка) и подается в распределительный коллектор щелоков 8.
Осветление щелоков и промывка шлама. Из распределительного коллектора 8, снабженного шнековой мешалкой, суспензия плунжерным насосом подается в отстойник 9 для осветления.
Из средней части отстойника осветленный щелок с концентрацией 135 г/дм3 NaOH при температуре 80 ºС поступает в общий коллектор. Оттуда подается на выпарку.
Избыток щелока направляется в буферный сборник 11 и снова перекачивается в отстойник 9.
Для получения чистого продукта с минимальным содержанием примесей к осветленному щелоку (в среднюю часть отстойника) добавляется небольшое количество Na2SO4. Шлам через отверстие в нижней конической части отстойника 9 попадает в специальный карман, куда для разжижения шлама подается промывная жидкость из второго яруса аппарата 12. Для более полного использования оставшейся в шламе извести образовавшаяся пульпа из кармана отстойника поступает в аппарат 10, куда добавляется содовый раствор.
Далее пульпа, содержащая известь и соду, подается в многоярусный аппарат 12 на промывку. Шлам промывается водами шламового фильтра и конденсатом с вакуум-выпарки.
Промывка проводится по принципу противотока: шлам движется сверху вниз (от первого яруса до шестого), промывная вода вводится в нижний (шестой) ярус и далее последовательно перекачивается центробежными насосами на вышележащие ярусы, кончая вторым.
При промывке шлама промывные воды обогащаются щелочью.
Из второго яруса вода поступает в карман отстойник 9 для разжижения шлама, о чем говорилось выше.
Прозрачная жидкость из первого яруса при температуре 75 ºС направляется в отдельные выпарки для растворения осадков, выделяющихся в процессе упаривания щелоков.
Шлам выходит из нижнего яруса промывного аппарата 12 и поступает на вращающейся вакуум-фильтр 13, где окончательно обмывается от щелочи конденсатом с вакуум-выпарки.
Отфильтрованная жидкость и промывные воды из вакуум-фильтра 13 поступает на промывку шлама в аппарат 12.
Промытый шлам продувается на вакуум-фильтре воздухом, разбавляется водой в сборнике шлама 15 и перекачивается на станции абсорбции и дистилляции.
Таким образом, основная операция – получение гидроксида натрия из кальцинированной соды – проводится в горизонтальном каутицере (первая каустификация) и в вертикальных каустицерах (вторая каустификация).
Наиболее медленными процессами получения каустической соды NaOH по известковому способу является отслаивание и промывка шламов. Скорость отслаивания шлама возрастает при добавлении Na2SO4, крахмала и солей железа. Аппаратура для этих процессов громоздкая и дорогостоящая. Скорость промывки шлама можно увеличить при замене громоздких многоярусных промывателей более компактными вращающимися вакуум-фильтрами.
Совершенствование технологии каустической соды можно вести в направлении уменьшения количества промывных вод. Этого можно добиться, применяя фильтрование шлама первой каустификации.
Повторный обжиг значительного количества карбонатного шлама, который идет в отходы, дал бы большую экономическую выгоду.
