
- •Федеральное агентство по образования
- •Стартерная аккумуляторная батарея Методические указания
- •Стартерная аккумуляторная батарея
- •5.4. Емкость аккумулятора
- •5.5. Разрядная вольт – амперная характеристика аккумуляторной батареи.
- •5.6. Мощность аккумуляторной батареи Мощность, развиваемая батареей в замкнутой электрической цепи
- •6. Проверка технического состояния аккумуляторных батарей
- •Дополнительные сведения
- •Литература
Федеральное агентство по образования
Сибирская государственная автомобильно-дорожная академия (СибАДИ)
Кафедра “Электроника и автотракторное электрооборудование”
Стартерная аккумуляторная батарея Методические указания
к лабораторной работе по дисциплине
“Электрооборудование автомобилей”: 150200 и 240400
Составители: А.П. Попов, В.И. Горбунков, С.М. Клеванский
Омск
Издательство СибАДИ
2007
Лабораторная работа №1
Стартерная аккумуляторная батарея
1. Цель работы
- освоение методики проверки технического состояния стартерных аккумуля-торных батарей;
- определение основных параметров аккумуляторной батареи: степени разря-жённости, ЭДС, внутреннего сопротивления;
- построение вольт – амперной характеристики и кривой мощности, развивае-мой стартерной аккумуляторной батареей;
оценка потенциальной возможности исследуемой аккумуляторной батареи.
2. Правила безопасной работы
Содержатся в инструкции по охране труда при выполнении лабораторных ра-бот в лаборатории №272 “Электрооборудование”.
3. Домашняя подготовка
- изучить по литературе [13] теоретические вопросы по устройству и характе-ристикам свинцовых аккумуляторных батарей, требования, представляемые к стартерным аккумуляторным батареям, маркировке батарей;
- ознакомиться с требованиями по оформлению отчетов по лабораторным рабо-там [4] по курсу “Электрооборудование автомобилей”.
4. Выполнение лабораторной работы
К выполнению лабораторной работы допускаются лишь те студенты, кото-рые показали достаточное знание теории и имеющие практические навыки ра-боты с электроизмерительными приборами.
Порядок выполнения лабораторной работы писан в разделе 6.
5. Конструкция, принцип действия и основные характеристики аккумуля-торных батарей
Электрический аккумулятор – устройство, в котором химическая энергия заложенных в него активных веществ непосредственно преобразуется в электрическую при протекании электрохимических реакций.
Устройство такого типа называется химическим источником тока, но в отли-чие от гальванических элементов, является вторичным и предназначено для многократного использования за счет восстановления химической энергии ве-ществ.
5.1. Конструкция аккумуляторов
Устройство почти всех свинцовых аккумуляторов одинаково и основано на принципе баночной конструкции. Широкое применение этих аккумуляторов обусловлено их дешевизной, надежностью в работе и хорошими показателями. Они обладают высоким и стабильным напряжением, мало меняющимся с тем-пературой и токами нагрузки. Ресурс свинцовых аккумуляторов составляет не-сколько сотен зарядно – разрядных циклов.
Электродный блок помещается в баке из кислотостойкого изоляционного материала. Сама блочная структура представляет собой параллельное соедине-ние разнополярных пластин, дающее аккумулятору низкое внутреннее сопро-тивление, что очень важно для стартерных батарей. При сборке аккумуляторов полублоки положительных и отрицательных пластин вводят друг в друга и изолируются сепараторами. Назначение сепараторов состоит в предотвращении соприкосновения разнополярных электродов. Сепараторы способствуют также доступу жидкого электролита по всем участкам электродов.
Расстояние между верхними кромками пластины и крышкой аккумулятора составляет не менее 20 мм. Это расстояние необходимо для компенсации коле-бания уровня электролита и отделения капель электролита при сильном газовы-делении (“кипении”) в конце заряда. В крышке имеется два отверстия для шты-рей – токовыводов. Еще одно отверстие в крышке предназначено для вентиля-ционной пробки, которое обеспечивает выход газов при саморазряде и переза-ряде, а также для доливки электролита, замера его уровня и концентрации. От-дельные аккумуляторы в батарее соединяются хорошо проводящими свинцовы-ми перемычками, которые в последнее время делаются закрытыми общей крышкой, уменьшая саморазряд батареи во время эксплуатации.
Электроды свинцового стартерного аккумулятора представляют собой отно-сительно жесткий электронопроводящий каркас, пронизанный большим коли-чеством пор, с диаметрами 5-10 мкм для губчатого свинца Pb (отрицательной активной массы) и 1-5 мкм для губки двуокиси PbO2 ( положительно активной массы) при объемной пористости около 50 % в заряженном состоянии. Элект-ролит – водный раствор серной кислоты
H2SO4 + H2O ,
часть которого всегда диссоциирована на положительные ионы водорода H+ и отрицательные сульфат- ионы SO4 ; часть H2O – также на ионы H+ и ионы гид-роксильной группы OH- (гидратированные ионы обеих знаков).
5.2. Электролит. Механизмы переноса зарядов
Водный раствор серной кислоты, в котором имеются подвижные ионы электропроводен. Под действием электрического поля в электролите начинает-ся перемещение ионов вдоль направления поля. Скорость миграции каждого иона пропорциональна как напряженности поля, так и величине, которую назы-вают подвижностью данного иона. Подвижность ионов пропорциональна удельной электрической проводимости электролита (См/м), обратную вели-чину которой, численно равной 1/, называют удельным сопротивлением электролита (Омм), и связывают с главной величиной определяющей внут-реннее сопротивление аккумулятора.
В очень разбавленных растворах как видно из рис.1 проводимость растет пропорционально концентрации. При дальнейшем увеличении концент-рации подвижность снижается вследствие межионных взаимодействий, роста вязкости, а кроме того возможно снижение степени диссоциации электролита. Соответственно, рост замедляется (см. рис.1)
Рис 1. Зависимость удельной электропроводимости серной кислоты
от плотности (концентрации электролита) и температуры.
Область концентрации где - наибольшее соответствует наименьшему значению удельного сопротивления электролита.
Сильная зависимость от температуры обусловлена прежде всего изменением подвижности ионов. Так как плотность растворов изменяется с температурой, то всегда указывают при какой температуре производится измерение плотности.
Подвижность ионов связана с другими механизмами переноса ионов, действующими в электролитах свинцовых аккумуляторов – конвективных по-токов жидкости (за счет небольших различий температур и плотностей), а так-же диффузионного переноса реагентов который действует вблизи поверхности электродов, выравнивая концентрацию электролита в порах активных масс и объеме всего аккумулятора.
5.3. Принцип действия
Рассмотрим процессы, происходящие на поверхности обеих электродов.
Губчатый свинец отрицательного электрода частично растворяется в элект-ролите с образованием положительных ионов Pb2+ , освободившиеся при этом электроны сообщают электроду отрицательный заряд; ионы свинца могут всту-пать в реакцию с отрицательными ионами сульфата образуя нейтральный суль-фат свинца который имеет слабую растворимость и поэтому может осаждаться на любой поверхности, включая отрицательный электрод.
Pb2+ + SO4 PbSO4 ,
Одновременно с этим двуокись свинца PbO2 положительного электрода, растворяясь в электролите в значительно меньшем количестве, чем губчатый свинец при взаимодействии с водой диссоциируется на ионы четырехвалентно-го свинца Pb4+ и гидроксила OH-. Гидроксильная группа, соединяясь с ионом водорода, образует воду
4 OH- + 4 H+ 4 H2O ,
ионы Pb4+ сообщают электроду положительный потенциал.
Таким образом, на границе электролита c обеими электродами имеют мес-то два связанных между собой явления [5]:
- адсорбция, т.е. изменение концентрации компонентов раствора вблизи по-верхности электродов;
- пространственное разделение зарядов, формирующее двойной электрический слой и создающее в нем электрическую разность потенциалов.
Поскольку все носители зарядов, создающие на электроде потенциал, ос-таются на нем, пополняя заряд его поверхности (в таком случае говорят, что электроды являются идеально поляризованными) , а также то, что адсорбция ионов раствора на электроде обусловлена только кулоновским взаимодействи-ем заряда поверхности с зарядами ионов, то по истечении некоторого времени в системе установится динамическое равновесие между электростатическими си-лами системы зарядов. Для него характерно: электролит в целом (за исключе-нием пограничных зон, в которых сосредоточен двойной электрический слой) является электронейтральным, т.е. алгебраическая сумма заряда всех ионов рав-на нулю. Толщина двойного электрического слоя, в котором наблюдается изме-нение потенциала, составляет 3 4 А. Электроды аккумулятора – эквипотенци-альны (см. рис. 2).
Это равновесие приостанавливает дальнейший ход электрохимических ре-акций, а объёмные заряды на поверхности электродов для плотности электроли-та, например = 1,25 [г / см3] составляют, соответственно:
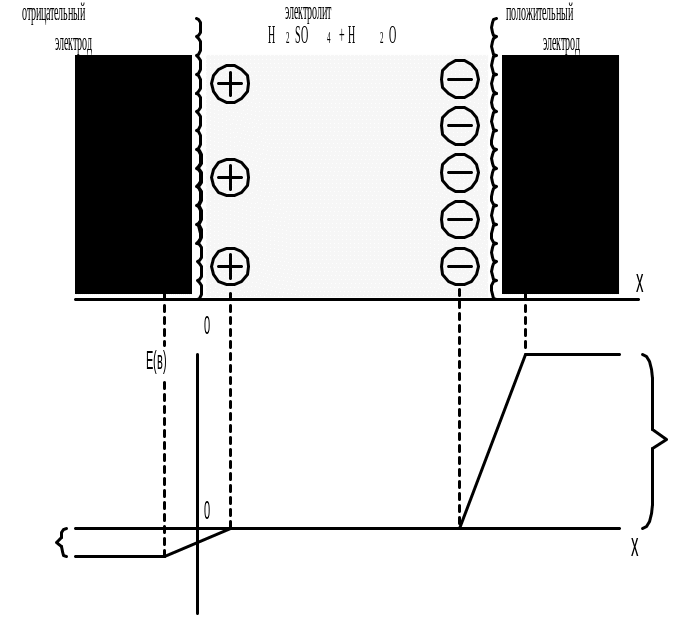
Рис. 2. Строение двойных слоев на границе электролита с обоими
электродами свинцового аккумулятора.
Здесь + и - – скачки потенциалов на электродах, вызванные работой выхода “основных” носителей за пределы кристаллических решеток материала электродов.
- для отрицательного электрода потенциал - = - 0,38 В;
- для положительного электрода + = +1,72 В, как видно из рис. 2
Разность электродных потенциалов, измеренная в разомкнутой цепи + - - даёт значение ЭДС Е0 =2,10 В
Равновесная ЭДС свинцового аккумулятора Е0 , как и любого химического источника тока, зависит об химических и физических свойств веществ, прини-мающих участие в токообразующем процессе и совершенно не зависит от раз-меров и формы электродов, а также от количества активных масс и электроли-та. Вместе с тем в свинцовом аккумуляторе электролит принимает непосред-ственное участие в токообразующем процессе на аккумуляторных электродах и изменяет свою плотность в зависимости от степени заряженности аккумулято-ров. Поэтому равновесная ЭДС, которая в свою очередь является функцией плотности электролита, будет также функцией степени разряженности аккуму-лятора, температуры и других факторов.
Установившееся равновесие нарушается, когда между электродами по внеш-ней цепи пойдет ток: электроны с отрицательного электрода устремляются к положительному, потенциальный барьер снижается, на смену ушедшим элект- ронам приходят новые. На положительном электроде ионы Pb4+ присоединяя электроны, пришедшие по внешней цепи, восстанавливаются до ионов двухва-лентного свинца
Pb4+ + 2е- Pb2+ ,
которые взаимодействуют с ионами SO4 образуют сернистый свинец (сульфат свинца) PbSO4 который осаждается на поверхности положительного электрода (см. рис.2)
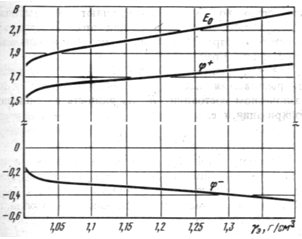
Рис. 3. Зависимость равновесной ЭДС и потенциалов электродов свинцового аккумулятора от плотности электролита.
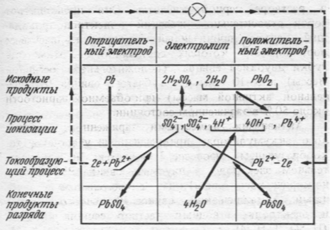
Рис. 4. Схема электрохимических процессов при разряде свинцового аккумулятора
Следовательно, в результате разряда аккумулятора активные материалы положительного и отрицательного электродов преобразуются в сульфат свинца PbSO4 . При этом расходуется серная кислота Н2SO4 , а из ионов H+ и OH- обра-зуется вода , что приводит к снижению уровня электролита при разряде:
- на отрицательном электроде Pb - 2е + SO4 PbSO4 ,
- на положительном электроде - PbО2 + 2е + 4H+ SO4 PbSO4 + 2 Н2O .
По плотности электролита поэтому судят о разряде.
Схема электрохимических процессов при заряде аккумулятора показана на рис. 5.
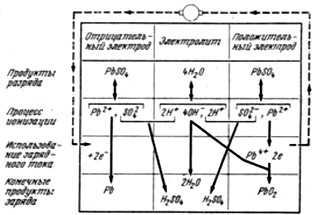
Рис. 5. Схема электрохимических процессов при заряде свинцового аккумулятора
В электролите у обоих электродов присутствуют в небольшом количестве ионы сульфата свинца (Pb+ , SO4) и воды (H+, ОH-).
Под влиянием напряжения источника постоянного тока во внешней цепи ус-танавливается направленное движение электронов к отрицательному электроду.
Двухвалентные ионы свинца у отрицательного электрода нейтрализуются поступившими двумя электронами, превращая активную массу отрицательного электрода в металлический губчатый свинец: Pb2+ +2е Pb , ионы SO4 и 2 Н+ образуют серную кислоту:
SO4 + 2Н+ Н2SO4 .
У положительного электрода под действием зарядного тока двухвалентные ионы свинца Pb2+ отдают электроны 2е, становясь 4-х валентными ионами свинца Pb4+ ,которые, соединяясь через промежуточные реакции с двумя иона-ми кислорода, образуют двуокись свинца PbО2 . Ионы 2H+ и SO4 образуют сер-ную кислоту, в результате чего растет плотность электролита.
Суммарная реакция зарядного процесса имеет вид
PbSO4 + 2 Н2O PbО2 + Pb + 2H2SO4 .
Когда процессы преобразования веществ в активных массах положительно-го и отрицательного электронов окончены, плотность электролита перестает из-меняться, то это служит признаком окончания процесса заряда аккумулятора. При дальнейшем продолжении заряда начинается процесс активного электро-литического разложения воды на Н2 и О2, которые выделяются у электролита создают эффект его “кипения”, что также является признаком окончания заряд-ного процесса.
