- •Оглавление
- •Классификация мэт
- •Проводниковые материалы
- •Физическая природа электропроводности металлов
- •Зависимость электропроводности металлов от температуры и примеры
- •Электрические свойства металлических сплавов
- •Сопротивление проводников на высоких частотах
- •Сопротивление тонких металлических плёнок. Размерный эффект
- •Контактные явления в металлах
- •Материалы высокой проводимости. Медь
- •Алюминий
- •Сверхпроводящие металлы и сплавы
- •Специальные сплавы
- •Сплавы для термопар
- •Сплавы для корпусов приборов
- •Тугоплавкие металлы
- •Благородные металлы
- •Неметаллические проводящие материалы
- •Полупроводники. Классификация полупроводниковых материалов
- •Собственные и примесные полупроводники
- •Температурная зависимость концентрации носителей заряда.
- •Подвижность носителей заряда в полупроводниках
- •Электрофизические явления в полупроводниках.
- •Кремний
- •Физико-химические и электрические свойства Si
- •Марки кремния.
- •Германий
- •Физико-химические и электрические свойства германия
- •Карбид кремния (SiC)
- •Полупроводниковые соединения аiii вv
- •Твердые растворы на основе аiii вv
- •Полупроводниковые соединения aiibvi и трз на их основе
- •Полупроводниковые соединения aivbvi и трз на их основе
- •Диэлектрики, классификация, основные свойства
- •Электропроводность диэлектриков
- •Потери в диэлектриках
- •Пробой диэлектриков
- •Полимеры в электронной технике
- •Композиционные пластмассы и пластики
- •Электроизоляционные компаунды
- •Неорганические стекла
- •Ситаллы
- •Керамики
- •Активные диэлектрики
- •Сегнетоэлектрики
- •Пьезоэлектрики
- •Пироэлектрики
- •Электреты
- •Жидкие кристаллы
- •Материалы для твердотельных лазеров
- •Магнитные материалы. Их классификация
- •Магнитомягкие материалы
- •Магнитотвердые материалы
- •Технология получения материалов электронной техники Методы получения тонких пленок
- •Вакуумные методы. Термическое вакуумное напыление.
- •Кинетика процесса конденсации. Роль подложки
- •Создание вакуума в вакуумных установках
- •Измерение вакуума
- •Вакуумные установки термического напыления
- •Катодное вакуумное распыление (диодное)
- •Ионно - плазменное распыление
- •Эпитаксиальные процессы в технологии материалов электронной техники
- •Механизм процесса эпитаксии
- •Автоэпитаксия кремния
- •Гетероэпитаксия кремния
- •Эпитаксия полупроводниковых соединений аiiibv и трз на их основе
- •Температурно - временной режим эпитаксии
- •Эпитаксия SiC
- •Оборудование для наращивания эпитаксиальных слоев
- •Элионные технологии
- •Ионно-лучевые установки
- •Механическая обработка полупроводниковых материалов
- •Шлифование и полирование пластин
- •Химическая обработка поверхности полупроводника
- •Методы отчистки поверхности
- •Фотолитография (операции, материалы)
- •Нанотехнология, определения и понятия
- •Инструменты для измерения наноструктур
- •Наноструктуры и наноустройства
- •Методы нанотехнологий
Германий
Один из первых полупроводниковых материалов, атомный номер 32.
Применение:
- выпрямительные плоскостные диоды от 0.3 до 1000 А.
- транзисторы как мощные, так и маломощные.
- туннельные и СВЧ - диоды.
- варикапы (полупроводниковый диод с регулируемой емкостью).
- датчики Холла и другие магниточувствительные приборы.
Недостаток – рабочая температура не больше 60-700С. Из-за этого вытесняется Si и GаAs.
Получение. Ge – рассеянный элемент, не имеет своих месторождений. Основные источники Ge – побочные продукты цинкового производства, коксования углей, концентраты из Cu-Pb-Zn-руд. Сырье хлорируют. Получают GeCl4 (жидкость с tкип=830С), ее очищают экстракцией, ректификацией. Далее путем гидролиза переводят в GeO2:
GeCl4 + 2H2O = GeO2 + 4HCl
Далее восстанавливают H2 в электрических печах при 650-7000С в графитовых тиглях: GeO2 + 2H2 = Ge + 2H2O
Восстановление совмещают с плавлением и кристаллизацией.
Поликристаллические слитки подвергают зонной плавке для получения Ge особой чистоты, либо выращивают легированные монокристаллы методом вытягивания из расплава.
Физико-химические и электрические свойства германия
Имеет металлический
блеск, характеризуется твердостью и
хрупкостью. Тпл
= 9360С,
d
= 5.3 г/см3.
Структура алмаза с периодом 5.66
![]() ,
ширина запрещенной зоны при 300
К 0.665 эВ.
,
ширина запрещенной зоны при 300
К 0.665 эВ.
При комнатной
температуре химически стоек. При
температуре больше 6500С
окисляется до GeO2.
GeO2
заметно растворяется в воде, из-за чего
не может служить защитой поверхности
Ge
(в отличии от SiO2).
Кристаллический Ge
при комнатной температуре не растворим
в воде, соляной кислоте, разбавленной
серной кислоте. Растворяется в смеси
HNO3+HF,
смеси H2O2
и окислителей. При нагревании
взаимодействует с галогенами и серой.
До температуры плавления не взаимодействует
с графитом и кварцем, поглощает H2
до
![]() .
.
Для температуры
больше 200 К
![]() Прозрачен для излучения с
Прозрачен для излучения с
![]() >
1.8мкм.
>
1.8мкм.
В качестве доноров и акцепторов при легировании используют элементы V и III групп: As, Sb, Bi; Al, Ga, In. ионизации примесей 0.01 эВ. Элементы I,II,VI,VII,VIII групп создают более глубокие уровни в запрещенной зоне. В нормальных условиях концентрация носителей заряда в Ge определяется концентрацией примесей (уже для температуры больше 90 К).
Собственная электропроводность появляется при 500С при концентрации примеси равной 8*1019 м-3 и для 2000С при содержании 7*1021 м-3. Удельное сопротивление при 200С – 0.47 Ом*м, а в расплаве 6.5*10-7 Ом*м (близкое к жидким металлам).
Карбид кремния (SiC)
В природе встречаются очень редко. Следствием сильных ковалентных связей отличается высокой температурной и химической стойкостью и твердостью.
Получают в электрических печах по реакции восстановления кварцевого песка углеродом:
SiO2 + 3C = SiC + 2CO
До 20000С
имеет кубическую
![]() -
модификацию с а=4.359
.
-
модификацию с а=4.359
.
При температуре
больше 2600-2700 возгоняется. При получении
образует друзы кристаллов, которые
дробят до порошка и для получения
полупроводниковой чистоты возгоняют
в атмосфере аргона при Т = 2400-26000С.
Образует до 100 политипов (различающихся
наложением атомных слоев). В зависимости
от политипа имеет ширину запрещенной
зоны от 2.39 до 3.33 эВ. Фактически это группа
полупроводниковых соединений одного
химического состава. Управление
политипизмом сложный процесс. Наиболее
легко воспроизводится политип 6H
(![]() ).
В то же время химические механические
свойства SiC
слабо зависят политипа. Твердость –
9.5. Не окисляется до Т=14000С.
При комнатной температуре не взаимодействует
с кислотами. При нагревании взаимодействует
с расплавами щелочей, H3PO4,
HNO3+HF.
Электропроводность примесная. От ее
вида зависит окраска. Примеси P,
As,
Sb,
Bi,
Fe
дают зеленую окраску, N,
B-желтую
и “n”
–тип.Ca,
Mg,
B,
Al,
Ge,
In
- голубую и фиолетовую, и “p”-
тип. Избыток Si
дает “n”,
избыток углерода -“p”
тип. Собственная электропроводность
при Т>14000С.
).
В то же время химические механические
свойства SiC
слабо зависят политипа. Твердость –
9.5. Не окисляется до Т=14000С.
При комнатной температуре не взаимодействует
с кислотами. При нагревании взаимодействует
с расплавами щелочей, H3PO4,
HNO3+HF.
Электропроводность примесная. От ее
вида зависит окраска. Примеси P,
As,
Sb,
Bi,
Fe
дают зеленую окраску, N,
B-желтую
и “n”
–тип.Ca,
Mg,
B,
Al,
Ge,
In
- голубую и фиолетовую, и “p”-
тип. Избыток Si
дает “n”,
избыток углерода -“p”
тип. Собственная электропроводность
при Т>14000С.
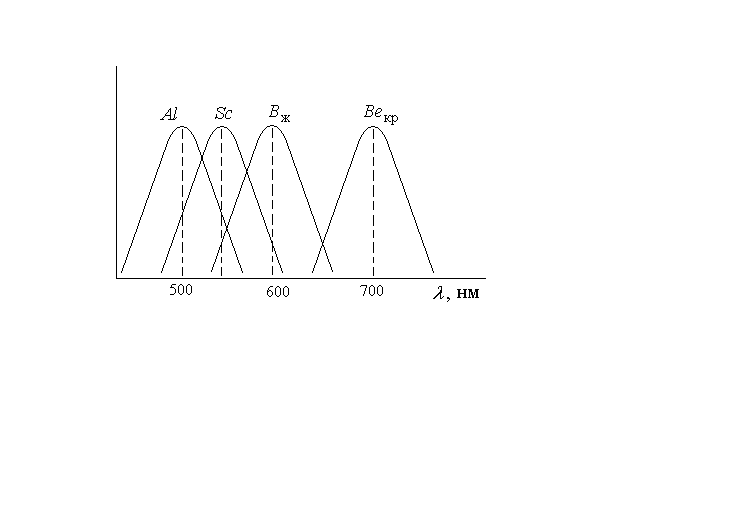
Замечательная особенность SiC – способность к люминесценции в видимой области. Изменяя политип и примеси можно получать излучение от красного до фиолетового. Это используется для создания светодиодов на принципе инжекционной электролюминесценции. Основой светодиодов является “р-n“ переход, формирующийся за счет диффузии примесей при 1800-20000С. Наиболее распространены желтые светодиоды (примеси В и N). Несмотря на невысокую эффективность преобразования энергии – не деградируют, очень стабильны (световые эталоны). Применяют также для изготовления мощных выпрямителей, тензорезисторов, полевых транзисторов, варисторов. Высокую твердость используют при получении образивных материалов.