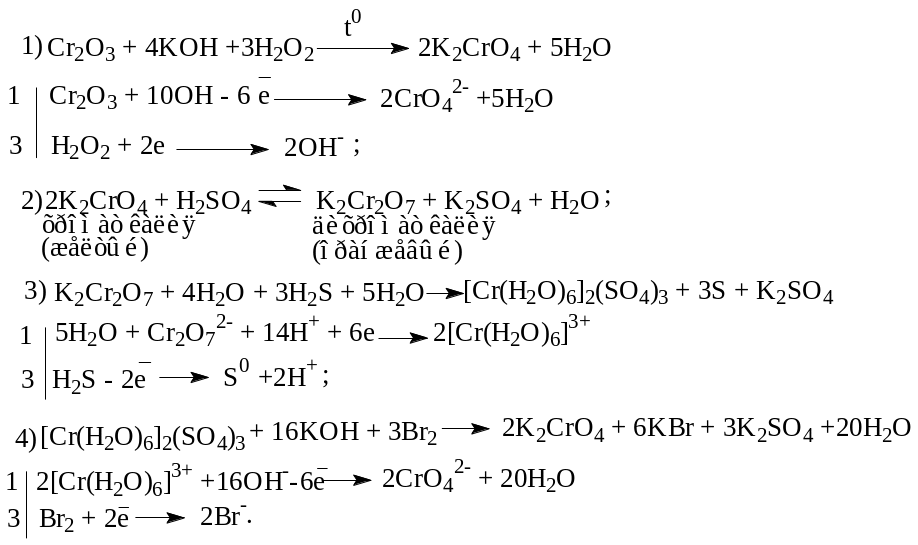- •Государственное образовательное учреждение высшего профессионального образования
- •Задание 1 по теме "строение вещества"
- •1 Задание 1 по теме: «строение атома»
- •2.1 Опишите строение предложенных в варианте задания молекул и молекулярных ионов по методу валентных связей (мвс).
- •2.2 Строение молекул и ионов по методу молекулярных орбиталей (мо)
- •Раздел 3.1
- •3.1 Проанализируйте влияние сил межмолекулярного взаимодействия на свойства веществ (решите задачу с указанным номером).
- •Список рекомендуемой литературы
- •Задание 2 по теме: «термохимия. Направление химических реакций»
- •Примеры решения задач
- •Вычисление стандартных теплот образования веществ и тепловых эффектов химических реакций
- •2 Рекомендации для самостоятельной работы студентов и варианты заданий
- •3 Задачи для самостоятельного решения
- •4. Варианты заданий
- •1 Примеры решения задач
- •Вычисление скорости химических реакций
- •1.3 Вычисление константы химического равновесия
- •1.4 Вычисление равновесных концентраций
- •1.5 Направление смещения равновесия
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание 4 по теме «Растворы»
- •Примеры решения задач
- •1.1 Процентная концентрация
- •Молярная и эквивалентная концентрации
- •1.3 Моляльная концентрация (моляльность) , мольная доля, титр
- •1.4 Осмотическое давление. Закон вант- гоффа
- •1.5 Давление насыщенного пара растворов. Тонометрический закон рауля
- •1.6 Температуры кипения и замерзания растворов.
- •2.Задачи для самостоятельного решения
- •3. Варианты заданий для самостоятельной работы
- •Список рекомендуемой литературы
- •Задание 5 по теме "растворы электролитов"
- •Примеры решения задач
- •1.1 Вычисление степени диссоциации слабых электролитов
- •1.2 Сильные электролиты. Вычисление степени электролитической диссоциации
- •1.3 Произведение растворимости
- •1.5 Обменные реакции в растворах электролитов
- •Задачи для самостоятельного решения
- •Варианты домашних заданий
- •Приложение а
- •Список рекомендуемой литературы
- •Задание 6 по теме «гидролиз солей»
- •Примеры решения задач
- •Вопросы и задачи для самостоятельного решения
- •Варианты контрольных заданий
- •Приложение а
- •Список рекомендуемой литературы
- •Задание 7 по теме «Окислительно–восстановительные реакции. Электрохимия»
- •Примеры решения задач
- •2 Задания для самостоятельного решения
- •Список рекомендуемой литературы
- •Задание 8 по теме «Классификация и свойства неорганических веществ»
- •Примеры решения задач
- •Пример 5. С какими из перечисленных веществ вступит в реакцию серная кислота: koh, CuO, Ba(oh)2, Fe2o3, Al2o3, co2, SiO2, h3po4, o2, h2o? Составьте уравнения возможных реакций.
- •Задания для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание 9 по теме "Комплексные соединения"
- •Примеры решения задач
- •2 Задачи для самостоятельного решения
- •3 Варианты заданий
- •Список рекомендуемой литературы
- •Задание 10 по теме «свойства элементов и их соединений»
- •ПримерЫ решения задач
- •Задачи для самостоятельного решения
- •3 Варианты заданий
- •Список рекомендуемой литературы
- •Сборник заданий для самостоятельной работы студентов по дисциплине «Общая и неорганическая химия»
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
3 Варианты заданий
Вариант |
Номера задач |
||||
1 |
2.1.1. |
2.2.1. |
2.3.1. |
2.4.1. |
2.5.1. |
2 |
2.1.2. |
2.2.2. |
2.3.2. |
2.4.2. |
2.5.2 |
3 |
2.1.3. |
2.2.3. |
2.3.3. |
2.4.3. |
2.5.3. |
4 |
2.1.4. |
2.2.4. |
2.3.4. |
2.4.4. |
2.5.4. |
5 |
2.1.5. |
2.2.5. |
2.3.5. |
2.4.5. |
2.5.5. |
6 |
2.1.6. |
2.2.6. |
2.3.6. |
2.4.6. |
2.5.6. |
7 |
2.1.7. |
2.2.7. |
2.3.7. |
2.4.7. |
2.5.7. |
8 |
2.1.8. |
2.2.8. |
2.3.8. |
2.4.8. |
2.5.8. |
9 |
2.1.9. |
2.2.9. |
2.3.9. |
2.4.9. |
2.5.9. |
10 |
2.1.10. |
2.2.10 |
2.3.10. |
2.4.10. |
2.5.10. |
11 |
2.1.11. |
2.2.11. |
2.3.11. |
2.4.11. |
2.5.11. |
12 |
2.1.12. |
2.2.12. |
2.3.12. |
2.4.12. |
2.5.12. |
13 |
2.1.13. |
2.2.13. |
2.3.13. |
2.4.13. |
2.5.13. |
14 |
2.1.14. |
2.2.14. |
2.3.14. |
2.4.14. |
2.5.14. |
15 |
2.1.15. |
2.2.15. |
2.3.15. |
2.4.15. |
2.5.15. |
Список рекомендуемой литературы
1. Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 2002.-743 с.
Глинка Н.Л. Задачи и упражнения по общей химии. М. Интеграл-Пресс, 2004.- с. 240
Гольбрайх З.Е. Сборник задач и упражнений по химии.- М.: Высшая школа, 2004.- 224 с.
Задание 10 по теме «свойства элементов и их соединений»
ПримерЫ решения задач
Пример 1
Вычислите общую жесткость воды , если в 2 л её находится по 800 мг ионов Mg2+ и Ca2+.
Решение: Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле
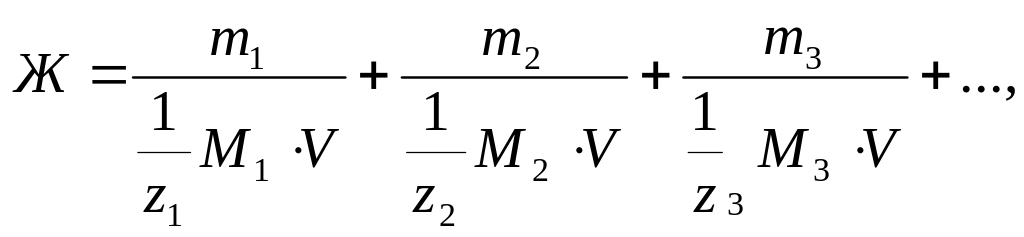
где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
![]() –
эквивалентные
массы ионов металлов (или их солей),
мг/экв;
–
эквивалентные
массы ионов металлов (или их солей),
мг/экв;
V – объём воды, л.
Подставим числовые значения в предлагаемую формулу
![]() 33,33
+ 20 = 53,33 мэкв/л.
33,33
+ 20 = 53,33 мэкв/л.
Ответ: общая жесткость равна 53,33 мэкв/л.
Пример 2
Чему равна жесткость воды, если на титрование 100 мл образца её израсходовано: 12 мл 0,04 н раствора HCl?
Решение: Временная жесткость воды определяется по объёму кислоты, пошедшей на её титрование:
НСО3- + НС1 = Н2О + СО2↑ + С1-.
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Следовательно:
![]() ,
,
где
![]() – объём кислоты, пошедшей на титрование,
мл;
– объём кислоты, пошедшей на титрование,
мл;
![]() – объём
пробы воды, взятой для титрования, мл;
– объём
пробы воды, взятой для титрования, мл;
![]() – нормальная
концентрация кислоты, экв./л;
– нормальная
концентрация кислоты, экв./л;
Отсюда:
![]() =
=
![]() =
4,8мэкв/л.
=
4,8мэкв/л.
Ответ: жесткость равна 4,8мэкв/л.
Пример 3
Почему растворы щелочей надо хранить в хорошо закрытой посуде? Составьте уравнения реакций между гидоксидом калия и…
а) хлором;
б) оксидом серы (VI);
в) сероводородом.
Решение:
Растворы щелочей поглощают из воздуха углекислый газ, при этом образуются карбонаты щелочных металлов.
а) реакция гидроксида калия с хлором:
1) при комнатной температуре
2KOH + Cl2 → KCl + KClO + H2O;
хлорид гипохлорит
калия калия
2) при нагревании
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O;
хлорид хлорат
калия калия
б) уравнения реакций между гидроксидом калия и оксидом серы (VI):
1) KOH + SO3 → KHSO4;
гидросульфат
калия
2) 2КОН + SO3 → K2SO4+ H2O;
сульфат
калия
в) уравнения реакций между гидроксидом калия и сероводородом:
1) KOH + H2S → KHS+ H2O;
гидросульфид
калия
2) 2КОН + Н2S → K2S+ 2H2O.
сульфид
калия
Пример 4
Определите объем газа (л, н.у.) полученный при взаимодействии 0,2 моль эквивалентов KMnO4 c избытком концентрированной соляной кислоты, если практический выход составляет 80%.
Решение: Между перманганатом калия и концентрированной соляной кислотой происходит реакция
1) 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5 Cl2↑ +8H2O;
2 MnO4-
+ 8H++
5ē
→
Mn2+
+4H2O
MnO4-
+ 8H++
5ē
→
Mn2+
+4H2O
5 2Cl- - 2 ē → Cl2.
При взаимодействии 0,2 моль эквивалентов KMnO4 получается также 0,2 моль эквивалентов Cl2 (по закону эквивалентов).
Объем Cl равен 0,2экв · 11,2 л/экв = 2,24 л (теоретический выход). Практический выход 2,24 л · 0,8 = 1,792 л.
Ответ: 1,792 л.
Пример 5
Составьте уравнения реакций по следующей схеме:
![]()
Решение: