
С) Состав лимфы
В состав лимфы входят клеточные элементы, белки, липиды, низкомолекулярные органические соединения (аминокислоты, глюкоза, глицерин), электролиты. Клеточный состав лимфы представлен в основном лимфоцитами. В лимфе грудного протока их число достигает 8*109/л. Эритроциты в лимфе в норме встречаются в ограниченном количестве, их число значительно возрастает при травмах тканей, тромбоциты в норме не определяются. Макрофаги и моноциты встречаются редко. Гранулоциты могут проникать в лимфу из очагов инфекции. Ионный состав лимфы не отличается от ионного состава плазмы крови и интерстициальной жидкости. В то же время по содержанию и составу белков и липидов лимфа значительно отличается от плазмы крови. В лимфе человека содержание белков составляет в среднем 2—3% от объема. Концентрация белков в лимфе зависит от скорости ее образования: увеличение поступления жидкости в организм вызывает рост объема образующейся лимфы и уменьшает концентрацию белков в ней. В лимфе в небольшом количестве содержатся все факторы свертывания, антитела и различные ферменты, имеющиеся в плазме. Холестерин и фосфолипиды находятся в лимфе в виде липопротеинов. Содержание свободных жиров, которые находятся в лимфе в виде хиломикронов, зависит от количества жиров, поступивших в лимфу из кишечника. Тотчас после приема пищи в лимфе грудного протока содержится большое количество липопротеинов и липидов, всосавшихся в желудочно-кишечном тракте. Между приемами пищи содержание липидов в грудном протоке минимально.
Д) Движение лимфы
Скорость и объем лимфообразования определяются процессами микроциркуляции и взаимоотношением системной и лимфатической циркуляции. Так, при минутном объеме кровообращения, равном 6 л, через стенки кровеносных капилляров в организме человека фильтруется около 15 мл жидкости. Из этого количества 12 мл жидкости реабсорбируется. В интерстициальном пространстве остается 3 мл жидкости, которая в дальнейшем возвращается в кровь по лимфатическим сосудам. Если учесть, что за час в крупные лимфатические сосуды поступает 150—180 мл лимфы, а за сутки через грудной лимфатический проток проходит до 4 л лимфы, которая в дальнейшем поступает в общий кровоток, то значение возврата лимфы в кровь становится весьма ощутимым.
Движение лимфы начинается с момента ее образования в лимфатических капиллярах, поэтому факторы, которые увеличивают скорость фильтрации жидкости из кровеносных капилляров, будут также увеличивать скорость образования и движения лимфы. Факторами, повышающими лимфообразование, являются увеличение гидростатического давления в капиллярах, возрастание общей поверхности функционирующих капилляров (при повышении функциональной активности органов), увеличение проницаемости капилляров, введение гипертонических растворов. Роль лимфообразования в механизме движения лимфы заключается в создании первоначального гидростатического давления, необходимого для перемещения лимфы из лимфатических капилляров и посткапилляров в отводящие лимфатические сосуды.
В лимфатических сосудах основной силой, обеспечивающей перемещение лимфы от мест ее образования до впадения протоков в крупные вены шеи, являются ритмические сокращения лимфангионов. Лимфангионы, которые можно рассматривать как трубчатые лимфатические микросердца, имеют в своем составе все необходимые элементы для активного транспорта лимфы: развитую мышечную «манжетку» и клапаны. По мере поступления лимфы из капилляров в мелкие лимфатические сосуды происходит наполнение лимфангионов лимфой и растяжение их стенок, что приводит к возбуждению и сокращению гладких мышечных клеток мышечной «манжетки». Сокращение гладких мышц в стенке лимфангиона повышает внутри него давление до уровня, достаточного для закрытия дистального клапана и открытия проксимального. В результате происходит перемещение лимфы в следующий центрипетальный лимфангион. Заполнение лимфой проксимального лимфангиона приводит к растяжению его стенок, возбуждению и сокращению гладких мышц и перекачиванию лимфы в следующий лимфангион. Таким образом, последовательные сокращения лимфангионов приводят к перемещению порции лимфы по лимфатическим коллекторам до места их впадения в венозную систему. Работа лимфангионов напоминает деятельность сердца. Как в цикле сердца, в цикле лимфангиона имеются систола и диастола. По аналогии с гетерометрической саморегуляцией в сердце, сила сокращения гладких мышц лимфангиона определяется степенью их растяжения лимфой в диастолу. И наконец, как и в сердце, сокращение лимфангиона запускается и управляется одиночным платообразным потенциалом действия
Стенка лимфангионов имеет развитую иннервацию, которая в основном представлена адренергическими волокнами. Роль нервных волокон в стенке лимфангиона заключается не в побуждении их к сокращению, а в модуляции параметров спонтанно возникающих ритмических сокращений. Кроме этого, при общем возбуждении симпатико-адреналовой системы могут происходить тонические сокращения гладких мышц лимфангионов, что приводит к повышению давления во всей системе лимфатических сосудов и быстрому поступлению в кровоток значительного количества лимфы. Гладкие мышечные клетки высокочувствительны к некоторым гормонам и биологически активным веществам. В частности, гистамин, увеличивающий проницаемость кровеносных капилляров и приводящий тем самым к росту лимфообразования, увеличивает частоту и амплитуду сокращений гладких мышц лимфангионов. Миоциты лимфангиона реагируют также на изменения концентрации метаболитов, рО2 и повышение температуры.
В организме, помимо основного механизма, транспорту лимфы по сосудам способствует ряд второстепенных факторов. Во время вдоха усиливается отток лимфы из грудного протока в венозную систему, а при вдохе он уменьшается. Движения диафрагмы влияют на ток лимфы — периодическое сдавление и растяжение диафрагмой цистерны грудного протока усиливает заполнение ее лимфой и способствует продвижению по грудному лимфатическому протоку. Повышение активности периодически сокращающихся мышечных органов (сердце, кишечник, скелетная мускулатура) влияет не только на усиление лимфооттока, но и способствует переходу тканевой жидкости в капилляры. Сокращения мышц, окружающих лимфатические сосуды, повышают внутрилимфатическое давление и выдавливают лимфу в направлении, определяемом клапанами. При иммобилизации конечности отток лимфы ослабевает, а при активных и пассивных ее движениях — увеличивается. Ритмическое растяжение и массаж скелетных мышц способствуют не только механическому перемещению лимфы, но и усиливают собственную сократительную активность лимфангионов в этих мышцах.2
Переливание крови и ее производных зачастую остается единственным способом спасения жизни человека, перенесшего сильную кровопотерю. Но и службы скорой медицинской помощи, и реанимационные отделения больниц зачастую не могут его использовать из-за недостатка донорской крови.
Тем не менее, врачи не перестают надеяться, что когда-нибудь ситуация изменится к лучшему. А основания для надежды дают так называемые кровезаменители - искусственные препараты, имитирующие человеческую кровь.
Кровезамещающей жидкостью называется физически однородная трансфузионная среда с целенаправленным действием на организм, способная заменить определенную функцию крови. Смеси различных кровезамещающих жидкостей или - последовательное их применение могут воздействовать на организм комплексно.
Кровезамещающие жидкости должны отвечать следующим требованиям:
1) быть схожими по физико-химическим свойствам с плазмой крови;
2) полностью выводиться из организма или метаболизироваться ферментными системами;
3) не вызывать сенсибилизации организма при повторных введениях;
4) не оказывать токсического действия на органы и ткани;
5) выдерживать стерилизацию автоклавированием, в течение длительного срока сохранять свои физико-химические и биологические свойства.
1. Классификация кровезаменителей
В зависимости от направленности действия кровезамещающие жидкости классифицируют следующим образом.
1) препараты противошокового действия;
2) препараты дезинтоксикационного действия;
3) препараты для парентерального питания. Многие кровезаменители обладают комплексным действием.
Существующие заменители крови можно разделить на две группы:
естественные заменители, являющиеся препаратами человеческой крови (нативная и сухая плазма и сыворотка крови, альбумин сыворотки крови человека);
искусственные плазмозаменяющие средства.
Заменители плазмы и других компонентов крови предназначены для восполнения ОЦК, сохранения ее агрегатного состояния, замещения определенных функций крови (лейкоцитарная масса, препараты плазмы, концентрат тромбоцитов), поддержания водно-электролитного баланса, онкотического давления крови, коррекции КЩС. Препараты этой группы используются и в качестве детоксицирующих средств (см. Детоксицирующие средства, включая антидоты), обладающих способностью связывать различные токсические вещества и ускорять их выведение из организма, а также уменьшать агрегацию форменных элементов крови в капиллярах.
Собственно плазмозаменители выполняют лишь одну функцию — поддержание необходимого ОЦК. Они должны отвечать ряду требований:
- не проходить через гистогематические барьеры и не проникать из сосудов в ткани;
- поддерживать достаточное и стабильное осмотическое давление;
- иметь минимальный и пролонгированный метаболизм, сопровождающийся образованием нейтральных продуктов или метаболитов, включающихся в обычные реакции обмена, либо интенсивно фильтрующихся с мочой;
- не обладать антигенными свойствами и пирогенностью.
К заменителям плазмы относятся плазма донорской крови (естественныйплазмозаменитель), декстраны и растворы солей электролитов (растворы кристаллоидов).
Плазма содержит все компоненты жидкой части крови человека, но требует особых способов хранения и небезразлична для донорского организма в антигенном отношении.
Декстраны — растворы полисахаридов из культур ряда бактерий, лишенных антигенных свойств. Декстраны могут иметь различную степень полимеризации и соответственно разную молекулярную массу; из них могут быть получены плазмозамещающие растворы различного функционального назначения. Растворы, содержащие декстраны с высокой молекулярной массой, используются, главным образом, в качестве гемодинамических средств, а с меньшей молекулярной массой — как корректоры реологических свойств крови. При введении в ток крови декстраны увеличивают онкотическое давление и усиливают процессы перемещения жидкости из тканей в кровяное русло. Они повышают диурез, чем способствуют процессам детоксикации. Подвергаясь в организме частичному гидролизу, декстраны выводятся в основном почками (почечная недостаточность является ограничением к их применению).
Растворы кристаллоидов (Рингера, Рингера-ацетат, Хартмана) содержат различные комбинации солей (натрия хлорид, натрия гидрокарбонат, натрия ацетат, кальция хлорид, калия хлорид), а также глюкозу в концентрациях, близких к физиологическим. Действие солевых растворов направлено на коррекцию дегидратации, содержания электролитов, концентрации ионов водорода и, соответственно, КЩС (см. Регуляторы водно-электролитного баланса и КЩС). При отсутствии значительных потерь электролитов для коррекции гиповолемии вводят 5% (изотонический) раствор декстрозы.
Ряд патологических состояний (непроходимость пищевода, нарушение всасывания из кишечника, тяжелые интоксикации и др.), операции на желудке и кишечнике обусловливают необходимость парентерального введения питательных веществ, в первую очередь белков. Плазмозамещающие средства (альбумин 20–25%, декстроза 20–50% растворы) могут применяться в таких ситуациях как препараты для парентерального питания (см. Средства для энтерального и парентерального питания). Белки (см. Белки и аминокислоты) субстратно обеспечивают многие ферментные процессы, декстроза — энергетический обмен. Однако следует учитывать, что парентеральное введение белков может приводить к сенсибилизации организма с развитием анафилактических реакций при повторных инъекциях.
Заменители плазмы и других компонентов крови применяются главным образом для лечения и профилактики шока различного происхождения, нормализации АД и улучшения гемодинамических показателей. Они используются при кровопотере, ожогах, других состояниях, сопровождающихся дегидратацией и гиповолемией, для профилактики послеоперационной и посттравматической тромбоэмболии, при интоксикациях различного генеза. Препараты декстрозы (20–40% раствор) применяются также для коррекции гипогликемических состояний. С целью парентерального питания эти препараты используются для обеспечения текущих энергозатрат организма и регенеративных процессов в клетках, когда питание естественным путем по ряду причин невозможно.
![]()
Иммунологические реакции используются для выявления специфических антител, идентификации возбудителей и других антигенов, определения групп крови и подбора адекватного донора при пересадках органов и тканей.
Клетки одного типа (В-клетки) происходят из костного мозга и при встрече с антигеном превращаются в клетки, образующие антитела (плазматические клетки). Клетки другого типа (Т-клетки) происходят из тимуса. Им свойственна способность специфически реагировать на антигенные молекулы и обеспечивать взаимодействие В-клеток с антигеном.
В иммунологически зрелом (иммунокомпетентном) организме фагоцитирующие клетки и Т- и В-лимфоциты осуществляют все формы специфического ответа: образуют циркулирующие антитела, относящиеся к разным классам иммуноглобулинов, реализуют иммунные реакции клеточного типа - замедленную повышенную чувствительность, отторжение трансплантата и др. Так организм отвечает на ряд бактериальных и паразитарных инвазий (туберкулёз, бруцеллёз, лейшманиоз), а также на пересадку клеток и тканей от другого организма. Дифференцировка и взаимодействие этих клеток под влиянием антигена могут привести к возникновению иммунологической "памяти" или специфической иммунологической толерантности.
У большинства млекопитающих иммунные реакции развиваются в полной мере только после рождения. Во время эмбрионального развития, когда зародыш защищен от действия антигенов, функционирует система избирательного переноса иммуноглобулинов от матери к плоду. Однако к 4-5 месяцам плод человека самостоятельно образует иммуноглобулины М и G. Птицы и млекопитающие, в том числе человек, обладают одинаковым спектром иммунологических реакций. Степень иммунореактивности связана с возрастом и заметно снижается по мере старения организма.
Физиология иммунных реакций изучает механизмы, с помощью которых организм обнаруживает и удаляет "чужое" - вещества, не являющиеся нормальными компонентами его собственных тканей: мёртвые и злокачественно перерожденные клетки, собственные поврежденные молекулы, чужеродные клетки и молекулы, бактерии, вирусы, простейшие, гельминты и их яды и т. п. Функциональным выражением чужеродности антигена является его способность вызывать образование специфических антител и соединяться с ними. Природа антигенности, вопрос о том, почему организм, не вырабатывая антитела на громадное множество собственных молекул, образует антитела к бесконечному числу чужеродных антигенов, сущность специфического иммунного ответа, в частности синтеза антител, являются главными вопросами так называемой теории образования антител. Предполагают, что образование антител, т. е. биосинтез высокоспециализированных белковых молекул, осуществляется подобно синтезу других белков плазмы крови.
Общая теория иммунологических реакций должна объяснить физико-химическую природу антигенности, описать молекулярные механизмы синтеза антител и расшифровать иммунохимическую специфичность. Создание такой теории возможно при последовательном решении трёх важнейших и взаимосвязанных проблем иммунного ответа:
1) генетические основы разнообразия иммуноглобулинов;
2) вопросы о том, сколько различных по специфичности антител может синтезировать клетка, о межклеточных взаимодействиях и о том, на каком уровне, клеточном или субклеточном, осуществляется действие антигена;
3) механизм специфической иммунологической толерантности (отсутствие специфического ответа на антиген).
Константы крови
Начало формы
Кровь как жидкая ткань организма характеризуется множеством констант, которые можно разделить на мягкие и жесткие. Мягкие (пластичные) константы крови - константы, которые могут отклоняться (изменять свою величину) от константного уровня в относительно широких пределах без существенных изменений жизнедеятельности клеток и, следовательно, функций организма. К мягким константам относятся: количество циркулирующей крови, соотношение объемов плазмы и форменных элементов, количество форменных элементов, количество гемоглобина, скорость оседания эритроцитов, вязкость крови, относительная плотность крови и др. 1. Количество крови, циркулирующей по сосудам. Общее количество крови в организме составляет 4-6 л, из них в состоянии покоя циркулирует около половины, другая половина (45-50 %) находится в депо (в печени до 20%, в селезенке до 16%, в кожных сосудах до 10%). 2. Соотношение объемов плазмы крови и форменных элементов. Это соотношение определяется путем центрифугирования крови в специальном капилляре с делениями - гематокрите. В нормальных условиях оно составляет 45% форменных элементов и 55% плазмы. Эта величина у здорового человека может претерпевать существенные и достаточно длительные изменения лишь при адаптации к большим высотам. Плазма, лишенная фибриногена, называется сывороткой. 3. Содержание форменных элементов, крови. Эритроцитов у мужчин 4,0-5,0х1012 /л, у женщин 3,9-4,7х1012 /л; лейкоцитов 4,0-9,0х109/л; тромбоцитов 180-320х109/л. 4. Количество гемоглобина. У мужчин - 130-160 г/л, у женщин - 120-140 г/л. Гемоглобин - сложное химическое соединение, состоящее из белка глобина и четырех молекул гема. Гем содержит двухвалентное железо, которое играет ключевую роль в деятельности гемоглобина, являясь его активной (простетической) группой. Гемоглобин синтезируется эритро- и нормобластами костного мозга. Для нормального синтеза гемоглобина необходимо достаточное поступление железа с пищей. При разрушении эритроцитов гемоглобин, после отщепления гема, превращается в билирубин - желчный пигмент, который поступает, в основном, в кишечник в составе желчи, где превращается в стеркобилин, выводящийся из организма с каловыми массами. Часть билирубина удаляется из организма через почки в виде уробилина. Основная функция гемоглобина - перенос кислорода и частично углекислого газа. Соединение гемоглобина с кислородом - оксигемоглобин - происходит в капиллярах легких. В виде оксигемоглобина переносится большая часть кислорода. Соединение гемоглобина с углекислым газом - карбгемоглобин - происходит в капиллярах тканей организма. В виде карбгемоглобина транспортируется 20% углекислого газа. В особых условиях происходит соединение гемоглобина с окисью углерода (СО) с образование карбоксигемоглобина. Гемоглобин связывает СО в 300 раз интенсивнее, чем кислород. Поэтому карбоксигемоглобин очень прочное соединение, в котором гемоглобин оказывается блокированным угарным газом (СО) и; неспособным осуществлять перенос кислорода. Слабое отравление угарным газом является обратимым процессом. При дыхании свежим воздухом происходит постепенное отщепление СО, его выведение из организма и восстановление способности гемоглобина связывать кислород. При взаимодействии гемоглобина с сильным окислителем (перманганат калия, бертолетова соль, анилин и др.) образуется метгемоглобин - прочное соединение, в котором происходит окисление железа и его переход в трехвалентную форму. В результате окисления гемоглобин прочно удерживает кислород и теряет способность отдавать его тканям, что может привести к гибели организма. 5. Скорость оседания эритроцитов (СОЭ): у мужчин - 2-10 мм/ч, у женщин - 2-15 мм/ч. Скорость оседания эритроцитов зависит от многих факторов: количества эритроцитов, их морфологических особенностей, величины заряда, способности к агломерации (агрегации), белкового состава плазмы. На скорость оседания эритроцитов влияет физиологическое состояние организма. Так, например, при беременности, воспалительных процессах, эмоциональных напряжениях и других состояниях скорость оседания увеличивается. 6. Вязкость крови. Она обусловлена наличием белков и эритроцитов. Вязкость цельной крови равна 5,0 (если вязкость воды принять за 1), плазмы - 1,7-2,2. 7. Удельный вес (относительная плотность) крови зависит от содержания форменных элементов, белков и липидов. Удельный вес цельной крови равен 1,050-1,060, плазмы - 1,025-1,034. Жесткие константы крови, их колебание допустимо в очень небольших диапазонах, т. к. отклонение на значительные величины приводит к нарушению жизнедеятельности клеток или функций целого организма. К жестким константам относятся: постоянство ионного состава крови, количество белков в плазме, осмотическое давление крови, количество глюкозы, количество кислорода и углекислого газа, кислотно-основное равновесие (рН) крови и др. 1. Постоянство ионного состава крови. Общее количество неорганических веществ плазмы крови составляет около 0,9%. К этим веществам относятся: катионы (натрия, калия, кальция, магния) и анионы (хлора, НРО42-, НСО3-), причем, содержание катионов является более жесткой величиной, чем содержание анионов. 2. Количество белков в плазме. Функции белков крови: • создают онкотическое давление крови, от которого зависит обмен воды между кровью и межклеточной жидкостью; • определяют вязкость крови, что в свою очередь оказывает влияние на гидростатическое давление крови; • принимают участие в процессе свертывания крови (фибриноген, глобулины); • соотношение альбуминов и глобулинов влияет на величину СОЭ; • являются важным компонентом защитной функции крови (особенно гамма-глобулины); • принимают участие в транспорте продуктов обмена, жиров, гормонов, витаминов, солей тяжелых металлов; • являются незаменимым резервом для построения тканевых белков; • участвуют в поддержании кислотно-основного равновесия, выполняя буферные функции (белковый барьер). Общее количество белков в плазме составляет 7-8%. Белки плазмы различают по строению и функциональным свойствам. Их делят на три основные группы: альбумины (4,5%), глобулины (1,7-3,5%) и фибриноген (0,2-0,4%). Альбумины. Большая суммарная поверхность мелких молекул альбуминов играет существенную роль в транспорте кровью различных веществ, например, билирубина, солей тяжелых металлов, жирных кислот, лекарственных препаратов (антибиотиков, сульфаниламидов). Одна молекула альбумина может связать 25-50 молекул билирубина. Альбумины образуются в печени, период полураспада их составляет 10-15 дней. Глобулины. Эта группа белков подразделяется на несколько фракций: альфа-, бета-, гамма-глобулины. Во фракции альфа-глобулинов имеются белки, простетической группой которых являются углеводы. Эти белки называют гликопротеинами. Около 10% ввей глюкозы плазмы циркулирует в составе гликопротеидов. Бета-глобулины участвуют в транспорте фосфолипидов, холестерина, стероидных гормонов, катионов металлов. Гамма-глобулины участвуют в формировании антител, защищающих организм от воздействия вирусов, бактерий, токсинов. К гамма-глобулинам относятся и антитела крови (агглютинины) , определяющие ее групповую принадлежность. Глобулины образуются в печени, костном мозге, селезенке, лимфатических узлах. Период полураспада глобулинов 5 дней. При ряде патологических состояний важным показателем является альбумино-глобулиновый (белковый) индекс, т. е. отношение количества альбуминов к количеству глобулинов. В норме этот индекс равен 1,2-2,0. Уменьшение индекса наблюдается при уменьшении содержания альбуминов (например, при усиленном удалении их с солями тяжелых металлов) или при увеличении содержания глобулинов плазмы (например, при интоксикации). Фибриноген обладает свойством становиться нерастворимым, переходя под воздействием фермента тромбина в волокнистую структуру - фибрин, что и обусловливает свертывание (коагуляцию) крови. Фибриноген образуется в печени. 3. Осмотическое давление крови. Под осмотическим давлением понимают силу, с которой растворенное вещество удерживает или притягивает растворитель (сила, обусловливающая движение растворителя через полупроницаемую мембрану из менее концентрированного раствора в более концентрированный). Осмотическое давление крови равно 7,6 атм. Оно зависит в основном от содержания солей и воды в плазме крови и обеспечивает поддержание на физиологически необходимом уровне концентрации различных веществ, растворенных в жидких средах организма. Осмотическое давление способствует распределению воды между тканями, клетками и кровью. Растворы, осмотическое давление которых равно осмотическому давлению клеток, называются изотоническими, и они не вызывают изменения объема клеток. Растворы, осмотическое давление которых выше осмотического давления содержимого клеток, называются гипертоническими. Они вызывают сморщивание клеток в результате перехода части воды из клеток в раствор. Растворы с более низким осмотическим давлением называются гипотоническими. Они вызывают увеличение объема клеток в результате перехода воды из раствора в клетку. Незначительные изменения солевого состава плазмы крови могут оказаться губительными для клеток организма (прежде всего клеток самой крови) из-за изменения осмотического давления. Часть осмотического давления, создаваемая белками плазмы, составляет так называемое онкотическое давление, величина которого равна 0,03-0,04 атм или 25-30 мм рт. ст. Онкотическое давление является фактором, способствующим переходу воды из тканей в кровяное русло. При снижении величины онкотического давления крови происходит выход воды из сосудов в интерстициальное пространство, что приводит к отеку тканей. 4. Содержание глюкозы. В нормальных условиях оно равно 3,3-5,5 ммоль/л. 5. Содержание кислорода и углекислого газа в крови. Артериальная кровь содержит 18-20 об % кислорода и 50-52 об % углекислого газа, в венозной крови кислорода 12 об % и углекислого газа 55-58 об %. 6. Кислотно-основное равновесие крови. Активная реакция крови обусловлена соотношением водородных и гидроксильных ионов и является жесткой константой, так как только при строго определенном кислотно-основном равновесии возможно нормальное протекание обменных процессов. Для оценки активной реакции крови используют водородный показатель или рН крови, равный 7,36 (артериальной крови 7,4, венозной - 7,35). Увеличение концентрации водородных ионов приводит к сдвигу реакции крови в кислую сторону, что называется ацидозом. Уменьшение концентрации водородных ионов и увеличение концентрации гидроксильных ионов ОН-приводит к сдвигу реакции в щелочную сторону, что называется алкалозом. Удержание констант крови на определенном уровне осуществляется по принципу саморегуляции, что достигается формированием соответствующих функциональных систем. В качестве примера рассмотрим схему функциональной системы, направленной на поддержание рН крови. В результате обмена веществ образуются продукты обмена, которые могут привести к изменению рН крови, т. е. к смещению активной реакции крови в кислую или щелочную сторону. Вместе с тем, у человека в условиях нормы рН крови сохраняется на относительно постоянном уровне, что обусловлено наличием в крови прежде всего буферных систем: гемоглобиновой, карбонатной, фосфатной, белковой. Эти системы нейтрализуют значительную часть кислых и щелочных веществ, поступающих в кровь, и препятствуют сдвигу рН. Буферные системы имеются и в тканях, где они представлены в основном клеточными белками и фосфатами. В процессе метаболизма кислых продуктов образуется больше, чем щелочных. Следовательно, опасность сдвига рН крови в кислую сторону больше. Поэтому буферные системы крови и тканей более устойчивы к действию кислот, чем щелочей. Так, для сдвига рН крови в щелочную сторону требуется прибавить к ней в 70 раз больше едкого натра, чем к чистой воде. Для сдвига рН в кислую сторону необходимо добавить к плазме в 300 раз больше соляной кислоты, чем к воде. Если буферные системы неспособны противодействовать изменению рН, то включаются другие механизмы. Так, накопление продуктов метаболизма приводит к раздражению хеморецепторов сосудов (прежде всего сосудистых рефлексогенных зон) импульсы от головного мозга. Эти структуры на основе поступающей информации формируют ответные реакции, направленные на восстановление исходной величины рН. При этом изменяется деятельность почек, желудочно-кишечного тракта, в результате чего из организма удаляется избыток веществ, вызвавших сдвиг рН. Например, при ацидозе почки выделяют больше кислого одноосновного фосфата натрия, а при алкалозе - больше щелочных солей. Через потовые железы удаляется молочная кислота, а изменение легочной вентиляции приводит к удалению углекислого газа. В регуляции рН обязательное участие принимает гормональная регуляция. Включение всех этих аппаратов реакций приводит к восстановлению константы рН. Если же этого не происходит, то формируется поведенческий компонент функциональной системы, б результате соответствующего поведения (исключение или увеличение потребления кислых или щелочных веществ) константа рН возвращается к исходному уровню. |
Объем и физико-химические свойства крови
Объем крови – общее количество крови в организме взрослого человека составляет в среднем 6 – 8% от массы тела, что соответствует 5 – 6 л. Повышение общего объема крови называют гиперволемией, уменьшение – гиповолемией.
Относительная плотность крови – 1,050 – 1.060 зависит в основном от количества эритроцитов. Относительная плотность плазмы крови – 1.025 – 1.034, определяется концентрацией белков.
Вязкость крови – 5 усл.ед., плазмы – 1,7 – 2,2 усл.ед., если вязкость воды принять за 1. Обусловлена наличием в крови эритроцитов и в меньшей степени белков плазмы.
Осмотическое давление крови – сила, с которой растворитель переходит через полунепроницаемую мембрану из менее в более концентрированный раствор. Осмотическое давление крови вычисляют криоскопическим методом путем определения точки замерзания крови (депрессии), которая для нее равна 0,56 – 0,58 С. Осмотическое давление крови в среднем составляет 7,6 атм. Оно обусловлено растворенными в ней осмотически активными веществами, главным образом неорганическими электролитами, в значительно меньшей степени – белками. Около 60% осмотического давления создается солями натрия (NаСl).
Осмотическое давление определяет распределение воды между тканями и клетками. Функции клеток организма могут осуществляться лишь при относительной стабильности осмотического давления. Если эритроциты поместить в солевой раствор, имеющий осмотическое давление, одинаковое с кровью, они не изменяют свой объем. Такой раствор называют изотоническим, или физиологическим. Это может быть 0,85% раствор хлористого натрия. В растворе, осмотическое давление которого выше осмотического давления крови, эритроциты сморщиваются, так как вода выходит из них в раствор. В растворе с более низким осмотическим давлением, чем давление крови, эритроциты набухают в результате перехода воды из раствора в клетку. Растворы с более высоким осмотическим давлением, чем давление крови, называются гипертоническими, а имеющие более низкое давление – гипотоническими.
Онкотическое давление крови – часть осмотического давления, создаваемого белками плазмы. Оно равно 0,03 – 0,04 атм, или 25 – 30 мм рт.ст. Онкотическое давление в основном обусловлено альбуминами. Вследствие малых размеров и высокой гидрофильности они обладают выраженной способностью притягивать к себе воду, за счет чего она удерживается в сосудистом русле, При снижении онкотического давления крови происходит выход воды из сосудов в интерстициальное пространство, что приводит к отеку тканей.
Кислотно-основное состояние крови (КОС). Активная реакция крови обусловлена соотношением водородных и гидроксильных ионов. Для определения активной реакции крови используют водородный показатель рН – концентрацию водородных ионов, которая выражается отрицательным десятичным логарифмом молярной концентрации ионов водорода. В норме рН – 7,36 (реакция слабоосновная); артериальной крови – 7,4; венозной – 7,35. При различных физиологических состояниях рН крови может изменяться от 7,3 до 7,5. Активная реакция крови является жесткой константой, обеспечивающей ферментативную деятельность. Крайние пределы рН крови, совместимые с жизнью, равны 7,0 – 7,8. Сдвиг реакции в кислую сторону называется ацидозом, который обусловливается увеличением в крови водородных ионов. Сдвиг реакции крови в щелочную сторону называется алкалозом. Это связано с увеличением концентрации гидроксильных ионов ОН и уменьшением концентрации водородных ионов.
В организме человека всегда имеются условия для сдвига активной реакции крови в сторону ацидоза или алкалоза, которые могут привести к изменению рН крови. В клетках тканей постоянно образуются кислые продукты. Накоплению кислых соединений способствует потребление белковой пищи. Напротив, при усиленном потреблении растительной пищи в кровь поступают основания. Поддержание постоянства рН крови является важной физиологической задачей и обеспечивается буферными системами крови. К буферным системам крови относятся гемоглобиновая, карбонатная, фосфатная и белковая.
Буферные системы нейтрализуют значительную часть поступающих в кровь кислот и щелочей, тем самым препятствуя сдвигу активной реакции крови. В организме в процессе метаболизма в большей степени образуется кислых продуктов. Поэтому запасы щелочных веществ в крови во много раз превышают запасы кислых, Их рассматривают как щелочной резерв крови.
Гемоглобиновая буферная система на 75% обеспечивает буферную емкость крови. Оксигемоглобин является более сильной кислотой, чем восстановленный гемоглобин. Оксигемоглобин обычно бывает в виде калиевой соли. В капиллярах тканей в кровь поступает большое количество кислых продуктов распада. Одновременно в тканевых капиллярах при диссоциации оксигемоглобина происходит отдача кислорода и появление большого количества щелочно реагирующих солей гемоглобина, Последние взаимодействуют с кислыми продуктами распада, например угольной кислотой. В результате образуются бикарбонаты и восстановленный гемоглобин, В легочных капиллярах гемоглобин, отдавая ионы водорода, присоединяет кислород и становится сильной кислотой, которая связывает ионы калия. Ионы водорода используются для образования угольной кислоты, в дальнейшем выделяющейся из легких в виде Н2О и СО2.
Карбонатная буферная система по своей мощности занимает второе место. Она представлена угольной кислотой (Н2СО3) и бикарбонатом натрия или калия (NaНСО3, КНСО3) в пропорции 1/20. Если в кровь поступает кислота, более сильная, чем угольная, то в реакцию вступает, например, бикарбонат натрия. Образуются нейтральная соль и слабодиссоциированная угольная кислота. Угольная кислота под действием карбоангидразы эритроцитов распадается на Н2О и СО2, последний выделяется легкими в окружающую среду. Если в кровь поступает основание, то в реакцию вступает угольная кислота, образуя гидрокарбонат натрия и воду. Избыток бикарбоната натрия удаляется через почки. Бикарбонатный буфер широко используется для коррекции нарушений кислотно-основного состояния организма.
Фосфатная буферная система состоит из натрия дигидрофосфата (NаН2РО4) и натрия гидрофосфата (Nа2НРО4). Первое соединение обладает свойствами слабой кислоты и взаимодействует с поступившими в кровь щелочными продуктами. Второе соединение имеет свойства слабой щелочи и вступает в реакцию с более сильными кислотами.
Белковая буферная система осуществляет роль нейтрализации кислот и щелочей благодаря амфотерным свойствам: в кислой среде белки плазмы ведут себя как основания, в основной – как кислоты.
Буферные системы имеются и в тканях, что способствует поддержанию рН тканей на относительно постоянном уровне. Главными буферами тканей являются белки и фосфаты.
Поддержание рН осуществляется также с помощью легких и почек. Через легкие удаляется избыток углекислоты. Почки при ацидозе выделяют больше кислого одноосновного фосфата натрия, а при алкалозе – больше щелочных солей: двухосновного фосфата натрия и бикарбоната натрия.
Эритропоэз
Образование эритроцитов, или эритропоэз, происходит в красном костном мозге. Эритроциты вместе с кроветворной тканью носят название “красного ростка крови”, или эритрона.
Для образования эритроцитов требуются железо и ряд витаминов.
Железо организм получает из гемоглобина разрушающихся эритроцитов и с пищей. Трехвалентное железо пищи с помощью вещества, находящегося в слизистой кишечника, превращается в двухвалентное железо. С помощью белка трансферрина железо, всосавшись, транспортируется плазмой в костный мозг, где оно включается в молекулу гемоглобина. Избыток железа депонируется в печени в виде соединения с белком – ферритина или с белком и липоидом – гемосидерина. При недостатке железа развивается железодефицитная анемия.
Для образования эритроцитов требуются витамин В12 (цианокобаламин) и фолиевая кислота. Витамин В12 поступает в организм с пищей и называется внешним фактором кроветворения. Для его всасывания необходимо вещество (гастромукопротеид), которое вырабатывается железами слизистой оболочки пилорического отдела желудка и носит название внутреннего фактора кроветворения Касла. При недостатке витамина В12 развивается В12-дефицитная анемия, Это может быть или при недостаточном его поступлении с пищей (печень, мясо, яйца, дрожжи, отруби), или при отсутствии внутреннего фактора (резекция нижней трети желудка). Считается, что витамин В12 способствует синтезу глобина, Витамин В12 и фолиевая кислота участвуют в синтезе ДНК в ядерных формах эритроцитов. Витамин В2 (рибофлавин) необходим для образования липидной стромы эритроцитов. Витамин В6 (пиридоксин) участвует в образовании гема. Витамин С стимулирует всасывание железа из кишечника, усиливает действие фолиевой кислоты. Витамин Е (a -токоферол) и витамин РР (пантотеновая кислота) укрепляют липидную оболочку эритроцитов, защищая их от гемолиза.
Для нормального эритропоэза необходимы микроэлементы. Медь помогает всасыванию железа в кишечнике и способствует включению железа в структуру гема. Никель и кобальт участвуют в синтезе гемоглобина и гемсодержащих молекул, утилизирующих железо. В организме 75% цинка находится в эритроцитах в составе фермента карбоангидразы. Недостаток цинка вызывает лейкопению. Селен, взаимодействуя с витамином Е, защищает мембрану эритроцита от повреждения свободными радикалами.
Физиологическими
регуляторами эритропоэза являются
эритропоэтины,
образующиеся
главным образом в почках, а также в
печени, селезенке и в небольших количествах
постоянно присутствующие в плазме крови
здоровых людей. Эритропоэтины
усиливают пролиферацию клеток-предшественников
эритроидного ряда – КОЕ-Э (колониеобразующая
единица эритроцитарная) и ускоряют
синтез гемоглобина. Они стимулируют
синтез информационной РНК, необходимой
для образования энзимов, которые
участвуют в формировании гема и глобина.
Эритропоэтины увеличивают также кровоток
в сосудах кроветворной ткани и увеличивают
выход в кровь ретикулоцитов. Продукция
эритропоэтинов стимулируется при
гипо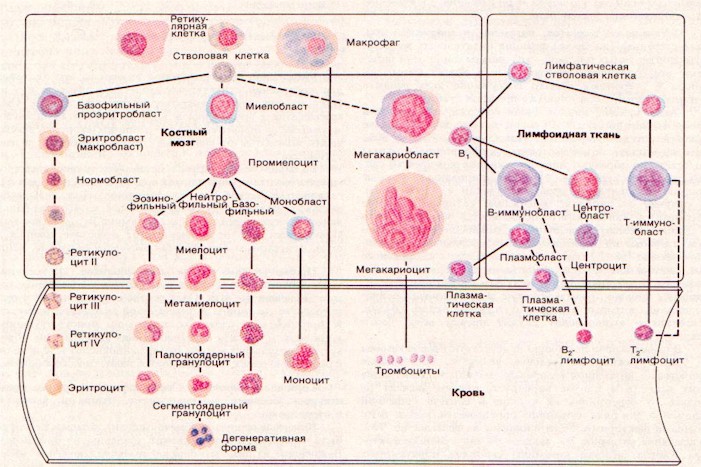 ксии
различного происхождения: пребывание
человека в горах, кровопотеря, анемия,
заболевания сердца и легких. Эритропоэз
активируется мужскими половыми гормонами,
что обусловливает большее содержание
эритроцитов в крови у мужчин, чем у
женщин. Стимуляторами эритропоэза
являются соматотропный гормон, тироксин,
катехоламины, интерлейкины. Торможение
эритропоэза вызывают особые вещества
– ингибиторы эритропоэза, образующиеся
при увеличении массы циркулирующих
эритроцитов, например у спустившихся
с гор людей. Тормозят эритропоэз женские
половые гормоны (эстрогены), кейлоны.
Симпатическая нервная система активирует
эритропоэз, парасимпатическая –
тормозит. Нервные и эндокринные влияния
на эритропоэз осуществляются, по-видимому,
через эритропоэтины.
ксии
различного происхождения: пребывание
человека в горах, кровопотеря, анемия,
заболевания сердца и легких. Эритропоэз
активируется мужскими половыми гормонами,
что обусловливает большее содержание
эритроцитов в крови у мужчин, чем у
женщин. Стимуляторами эритропоэза
являются соматотропный гормон, тироксин,
катехоламины, интерлейкины. Торможение
эритропоэза вызывают особые вещества
– ингибиторы эритропоэза, образующиеся
при увеличении массы циркулирующих
эритроцитов, например у спустившихся
с гор людей. Тормозят эритропоэз женские
половые гормоны (эстрогены), кейлоны.
Симпатическая нервная система активирует
эритропоэз, парасимпатическая –
тормозит. Нервные и эндокринные влияния
на эритропоэз осуществляются, по-видимому,
через эритропоэтины.
Об интенсивности эритропоэза судят по числу ретикулоцитов – предшественников эритроцитов. В норме их количество составляет 1 – 2%. Созревшие эритроциты циркулируют в крови в течение 100 – 120 дней.
Разрушение эритроцитов происходит в печени, селезенке, в костном мозге посредством клеток мононуклеарной фагоцитарной системы. Продукты распада эритроцитов также являются стимуляторами кроветворения.
Лейкопоэз
Все лейкоциты образуются в красном костном мозге из единой стволовой клетки. Предшественники лимфоцитов первыми ответвляются от общего древа стволовых клеток; формирование лимфоцитов происходит во вторичных лимфатических органах.
Лейкопоэз стимулируется специфическими ростовыми факторами, которые воздействуют на определенные предшественники гранулоцитарного и моноцитарного рядов. Продукция гранулоцитов стимулируется гранулоцитарным колониестимулирующим фактором (КСФ-Г), образующимся в моноцитах, макрофагах, Т-лимфоцитах, а угнетается – кейлонами и лактоферрином, секретируемыми зрелыми нейтрофилами; простагландинами Е. Моноцитопоэз стимулируется моноцитарным колониестимулирующим фактором (КСФ-М), катехоламинами. Простагландины Е, a - и b -интерфероны, лактоферрин тормозят продукцию моноцитов. Большие дозы гидрокортизона препятствуют выходу моноцитов из костного мозга. Важная роль в регуляции лейкопоэза принадлежит интерлейкинам. Одни из них усиливают рост и развитие базофилов (ИЛ-3) и эозинофилов (ИЛ-5), другие стимулируют рост и дифференцировку Т- и В-лимфоцитов (ИЛ-2,4,6,7). Лейкопоэз стимулируют продукты распада самих лейкоцитов и тканей, микроорганизмы и их токсины, некоторые гормоны гипофиза, нуклеиновые кислоты,
Жизненный цикл разных видов лейкоцитов различен, Одни живут часы, дни, недели, другие на протяжении всей жизни человека.
Лейкоциты разрушаются в слизистой оболочке пищеварительного тракта, а также в ретикулярной ткани.
