
Белки мембран
Если основная роль липидов в составе мембран заключается в стабилизации бислоя, то белки отвечают за функциональную активность мембран. Одни из них обеспечивают транспорт определённых молекул и ионов, другие являются ферментами, третьи участвуют в связывании цитоскелета с внеклеточным матриксом или служат рецепторами для гормонов, медиаторов, эйкозаноидов, липопротеинов, оксида азота (NO). На долю белков приходится от 30 до 70% массы мембран. Белки определяют особенности функционирования каждой мембраны.
Особенности строения и локализации белков в мембранах
Мембранные белки, контактирующие с гидрофобной частью липидного бислоя, должны быть амфифильными. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно неполярные аминокислоты. Участки белка, находящиеся в области полярных "головок", обогащены гидрофильными аминокислотными остатками.
Белки мембран различаются по своему положению в мембране.

Расположение (локализация) белков в мембранах. Трансмембранные белки, например: 1 - гпикофорин А; 2 - рецептор адреналина. Поверхностные белки: 3 - белки, связанные с интегральными белками, например, фермент сукци-натдегидрогеназа; 4 - белки, присоединённые к полярным "головкам" липидного слоя, например, протеинкиназа С; 5 - белки, "заякоренные" в мембране с помощью короткого гидрофобного концевого домена, например, цитохром b5; 6 - "заякоренные" белки, ковалентно соединённые с липидом мембраны (например, фермент щелочная фосфатаза).
Они могут глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки, либо разными способами прикрепляться к мембране - поверхностные белки.
Поверхностные белки
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны
Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника.
Примерами таких комплексов могут быть сахараза-изомальтаза и мальтаза-гликоамилаза. Возможно, связь этих пищеварительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой.
Белки, связанные с полярными «головками» липидов мембран
Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными "головками" липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного "якоря"
"Якорем" может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов.
Роль мембранного "якоря" может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой - С14 или пальмитиновой - С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина.
Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот "якорь" - часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Трансмембранные (интегральные) белки
Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой.

Интегральные белки мембран, содержащие от 1 до 12 трансмембранных доменов. 1- рецептор ЛПНП; 2 - ГЛЮТ-1 - транспортёр глюкозы; 3 - рецептор инсулина; 4 - адренорецептор.
Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют "вывернутыми" по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности.
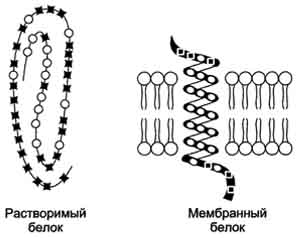
Локализация неполярных (незакрашенные кружки) и полярных (закрашенные квадраты) аминокислот в растворимых и мембранных белках.
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2).
Гликозилированные белки
Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина.

Строение рецептора липопротеина низкой плотности (ЛПНП).
1 - внутриклеточный домен; 2 - трансмембранный домен; 3 - Олигосахаридные остатки, присоединённые к ОН-группам серина или треонина; 4 - Олигосахаридные остатки, присоединённые через амидную группу аспарагина; 5-ЛПНП-связывающий домен.
Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
Латеральная диффузия белков
Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия) или поворачиваются вокруг оси, перпендикулярно его поверхности.
Например, фермент фосфолипаза А2, связываясь с цитоплазматической поверхностью мембраны, может латерально перемещаться по поверхности бислоя и гидролизовать несколько тысяч фосфолипидов в минуту до тех пор, пока не отделится от мембраны.
Латеральная диффузия интегральных белков в мембране ограничена, это связано с их большими размерами, взаимодействием с другими мембранными белками, элементами цитоскелета или внеклеточного матрикса.
Белки мембран не совершают перемещений с одной стороны мембраны на другую ("флип-флоп" перескоки), подобно фосфолипидам.
