
- •Лекция 3. Механизм действия ферментов и кинетика ферментов
- •Ионы металлов выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно, третичной и четвертичной структур.
- •Коферменты
- •Коферменты как вторые субстраты
- •В ходе реакции кофермент претерпевает химические изменения, в точности противоположные изменениям, которые происходят в субстрате.
- •Этапы ферментативного катализа
- •Механизмы ферментативного катализа
- •Основы кинетики ферментативных реакций
- •1. Температура
- •Изоферменты
Лекция 3. Механизм действия ферментов и кинетика ферментов
Основу жизнедеятельности любого организма составляют химические процессы. Практически все реакции в живом организме протекают с участием ферментов или энзимов.
Ферментами называют катализаторы, которые способны ускорять химические реакции. В ходе реакции они претерпевают физические изменения, но по ее завершении возвращаются в исходное состояние.
Ферменты являются белковыми катализаторами биохимических реакций, большая часть которых в отсутствие ферментов протекала бы крайне медленно. В отличие от небелковых катализаторов (Н+, ОН-, ионы металлов) каждый фермент способен катализировать лишь очень небольшое число реакций, часто только одну.
Таким образом, ферменты представляют собой реакционно-специфические катализаторы.
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) или ионах металлов (кофакторах).
Многие ферменты оказывают каталитическое действие на субстраты только в присутствии специфического термостабильного низкомолекулярного органического соединения - кофермента.
В таких случаях кофермент с апоферментом (белковая часть) формируют холофермент, обладающего каталитической активностью.
апофермент + кофактор (кофермент) холофермент
Кофермент может быть связан с апоферментом ковалентными или нековалентными связями.
Термин «простетическая группа» относится к ковалентно связанному коферменту.
К числу реакций, требующих присутствия коферментов, относятся ОВР, реакции переноса функциональных групп и изомеризации, а также реакции конденсации
Гидролитические реакции, катализируемые пищеварительными ферментами, протекают в отсутствие кофермента
КОФАКТОРЫ
Более 25% всех ферментов для проявления каталитической
Активности нуждается в ионах металлов.
Ионы металлов выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно, третичной и четвертичной структур.
Например, для большинства киназ в качестве одного из субстратов выступает не АТФ, а комплекс АТФ с магнием.
Магний не взаимодействует с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его
присоединение к активному центру фермента.
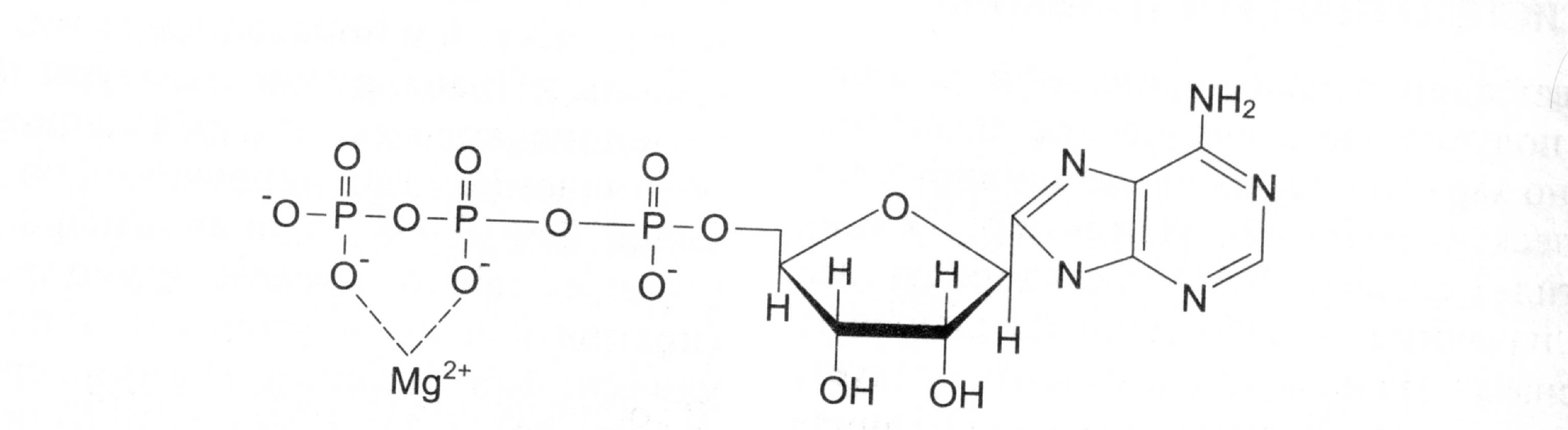
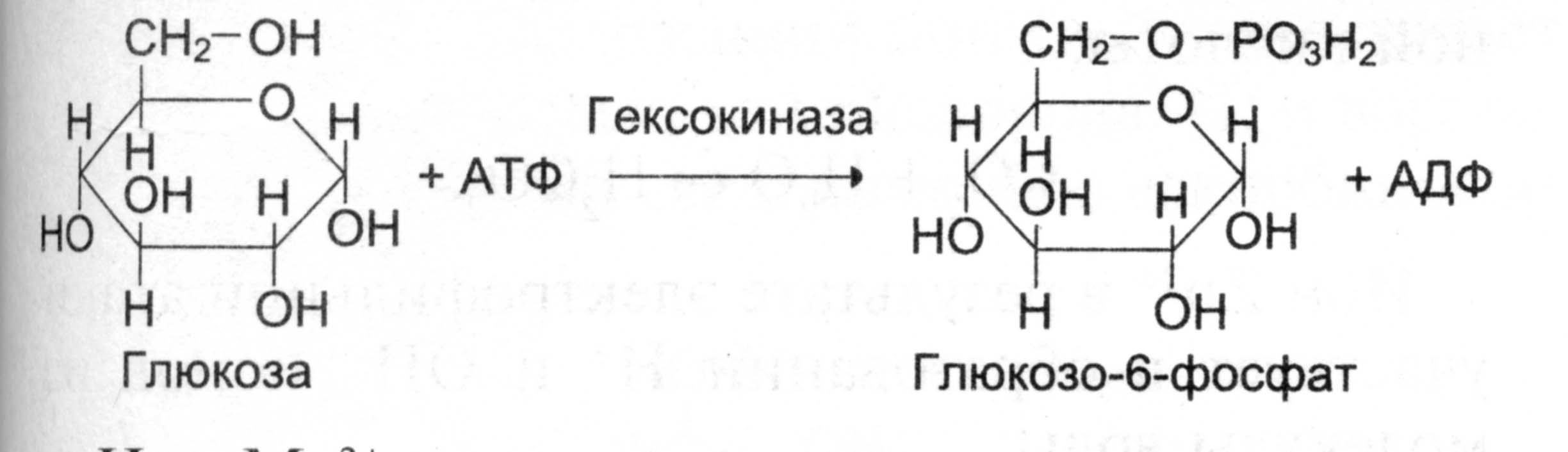
В качестве примера можно привести расположение субстратов в активном центре гексокиназы. Гексокиназа катализирует перенос фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
Ион Mg2+ ослабляет фосфоэфирную связь и облегчает перенос фосфата на глюкозу
В некоторых случаях ионы металла служат «мостиком» между ферментом и субстратом.
Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. Это магний, марганец, цинк, кобальт, молибден. В отсутствие металла ферменты активностью не обладают.
Такие ферменты получили название «металлоэнзимы». Например, пируваткиназа
 фосфоэнолпируват
+ АДФ пируват + АТФ
фосфоэнолпируват
+ АДФ пируват + АТФ
Ионы металлов обеспечивают сохранение вторичной, третичной и четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны.
Их активность снижается и даже полностью исчезает при небольших изменениях рН и температуры. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Например, для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка.
Удаление ионов цинка приводит к потере активности фермента.
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Эту функцию выполняют цинк, железо, марганец, медь.
Например, карбоангидраза, катализирующая образование угольной кислоты, содержит ионы цинка, который участвует в образовании Н+ и ОН-.
Эти ионы присоединяются к СО2 с образованием Н2СО3
СО2 + Н2О Н2СО3
