
- •Лекция 3. Механизм действия ферментов и кинетика ферментов
- •Ионы металлов выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно, третичной и четвертичной структур.
- •Коферменты
- •Коферменты как вторые субстраты
- •В ходе реакции кофермент претерпевает химические изменения, в точности противоположные изменениям, которые происходят в субстрате.
- •Этапы ферментативного катализа
- •Механизмы ферментативного катализа
- •Основы кинетики ферментативных реакций
- •1. Температура
- •Изоферменты
1. Температура
В некотором ограниченном интервале температур скорость ферментативной реакции повышается с ростом температуры. Коэффициент, указывающий, во сколько раз повышается скорость реакции при повышении температуры на каждые 10оС, называется температурным коэффициентом. Для большинства биологических реакций при повышении температуры на 10оС скорость увеличивается в 2-4 раза.
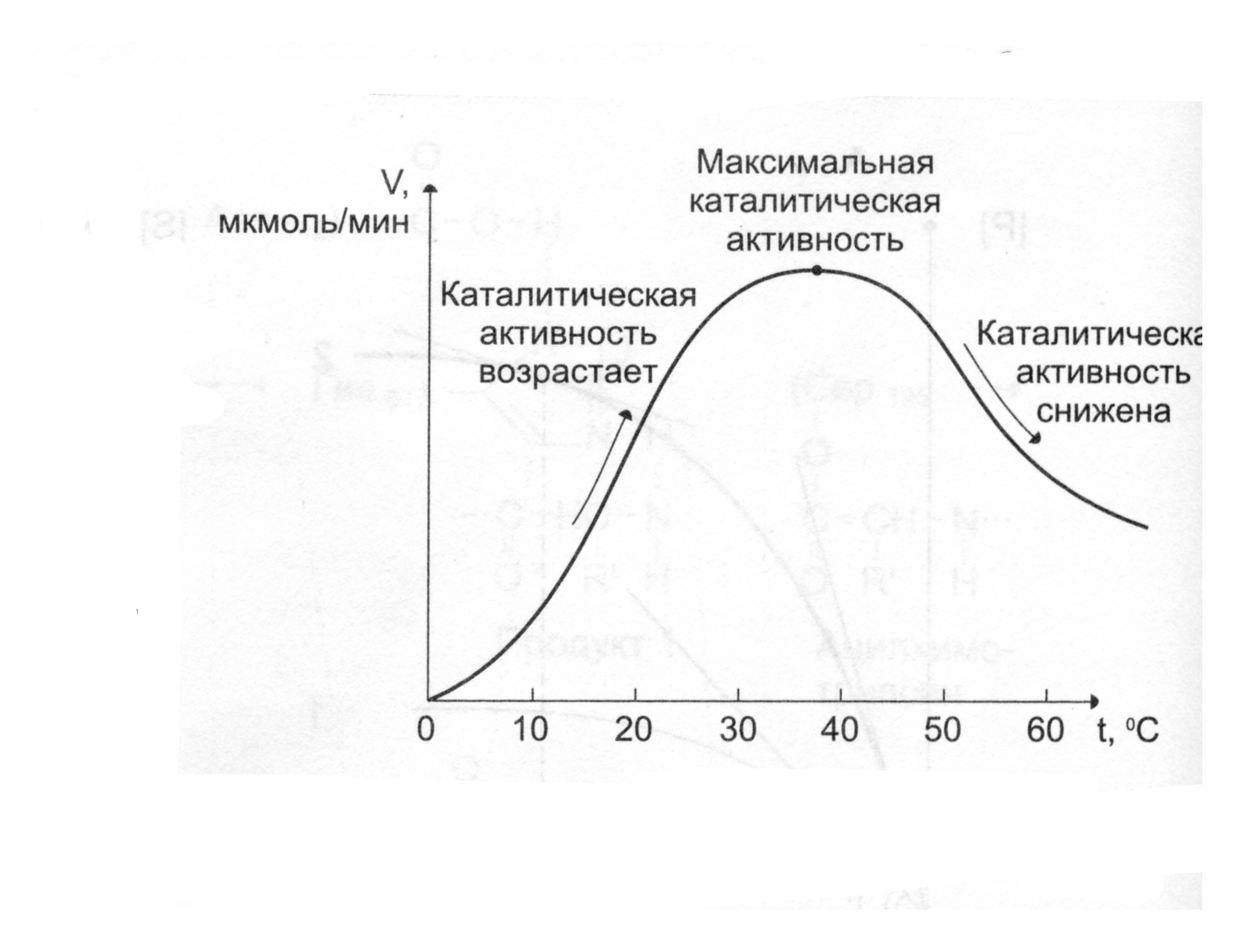
При некой оптимальной температуре скорость реакции максимальна. Повышение скорости реакции по мере приближения к оптимальной температуре слева объясняется увеличением кинетической энергии реагирующих молекул. При дальнейшем повышении температуры кинетическая энергия молекулы фермента становится достаточной для разрыва связей, поддерживающих вторичную структуру фермента в нативном, каталитически активном состоянии (происходит тепловая денатурация фермента). Вторичная и третичная структура фермента разрушается, что сопровождается потерей каталитической активности. Для большинства ферментов оптимальная температура равна или выше той, при которой клетки находятся в норме. Это 37-38оС.
2. рН
Умеренные изменения рН оказывают влияние на ионное состояние фермента и субстрата. Как показывают измерения ферментативной активности при различных рН, оптимум активности для разных ферментов находится в широких пределах рН.

Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
-
Фермент
Оптимальное значение рН
Пепсин
1,5-2
Каталаза
6,8-7
Уреаза
6,8-7,2
Трипсин
6,5-7,5
Аргиназа
9,5-9,9
Зависимость активности от рН определяется следующими факторами.
денатурацией фермента при очень высоких или низких рН
изменением величины заряда молекул субстрата или фермента. Активность фермента может изменяться в результате изменений либо его структуры, либо заряда функциональных остатков, участвующих в катализе или связывании субстрата. Для примера рассмотрим взаимодействие «-» фермента (Е) с «+» субстратом (SH).
Е -
+ SH+
Е
-SH
-
+ SH+
Е
-SH
При низких рН происходит протонирование Е-
Е - + H+ ЕH
При высоких рН – депротонирование субстрата
SH+ S + H+
Поскольку взаимодействовать друг с другом могут только Е- и SH+, при крайних значениях рН эффективная концентрация Е- и SH+ будет низкой, что приведет к снижению скорости реакции. И только в области, выделенной двойной штриховкой, в нужном ионном состоянии находятся одновременно и Е, и S, а максимальной концентрации они достигают в точке Х.

3. КОНЦЕНТРАЦИЯ ФЕРМЕНТА И СУБСТРАТА
Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента. Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например, в начальный период ферментативной реакции, т.к. в этот период не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции. Именно в этом случае начальная скорость реакции будет пропорциональна концентрации фермента. Фермент при взаимодействии с субстратом образует фермент-субстратный комплекс, который подвергается распаду на продукт и свободный фермент.
Если упростить это уравнение
то в уравнениях для скоростей прямой и обратной реакций обязательным компонентом является концентрация фермента
Однако в уравнениях для константы равновесия концентрация фермента не имеет значения
Как видно, константа равновесия ферментативной реакции не зависит от концентрации фермента.
4. ИНГИБИРОВАНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
Это снижение каталитической активности фермента под действием ингибиторов. Ингибиторы ферментов принято делить на 2 класса: обратимые и необратимые. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определенных условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
1. конкурентное ингибирование – это обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор – структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат или фермент-ингибитор. Классический пример конкурентного ингибирования - ингибирование сукцинатдегидрогеназной реакции малоновой кислотой. Сукцинат связывается с активным центром фермента сукцинатдегидрогеназы. В ходе ферментативной реакции происходит отщепление двух атомов водорода от сукцината и присоединение их к коферменту ФАД. В результате образуется фумарат, который высвобождается из активного центра сукцинатдегидрогеназы. Малоновая кислота – структурный аналог сукцината и может также взаимодействовать с активным центром сукцинатдегидрогеназы. При этом химическая реакция не идет.
Многие лекарственные препараты оказывают свое терапевтическое действие по механизму конкурентного ингибирования. Например, аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибитора активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечной дистрофии. Эффективные ацетилхолинэстеразные препараты – прозерин, эндрофоний.
 А.
присоединение ацетилхолина в активном
центре фермента.
А.
присоединение ацетилхолина в активном
центре фермента.
Б. присоединение конкурентного ингибитора – прозерина в активном центре фермента.
В. присоединение конкурентного ингибитора – эндрофония в активном центре фермента. Эндрофоний связывается в активном центре ацетилхолинэстеразы, препятствуя присоединению ацетилхолина.
2. неконкурентное ингибирование – ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентный ингибитор связывается либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким об разом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Необратимое ингибирование наблюдается в случае образования ковалентных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента. В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжелых металлов (ртути, серебра, мышьяка), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению.
Специфические и неспецифические ингибиторы
Специфические ингибиторы блокируют определенные группы активного центра фермента. Например, диизопропилфторфосфат (ДФФ) специфически реагирует лишь с одним из многих остатков серина в активном центре фермента. ДФФ относят к специфическим необратимым ингибиторам «сериновых» ферментов, так как он образует ковалентную связь с гидроксильной группой серина, находящегося в активном центре.
Ацетат йода легко вступает в реакции с SH-группами остатков цистеина любых белков, поэтому его относят к неспецифическим ингибиторам.
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов – аспирин.
Ферменты могут быть простыми или сложными белками. Если фермент сложный белок, то его небелковую часть называют кофактором или коферментом, а белковую часть – апоферментом. Апофермент с коферментом образует активную форму катализатора – холофермент
а пофермент + кофактор (кофермент) холофермент
Взаимодействие субстрата с ферментом происходит в центре связывания (активном центре) и сопровождается образованием множественных связей между ними.
Кофакторы ферментов
1. ионы металлов (цинк, магний, железо, медь). Металл может являться частью активного центра фермента и участвовать в катализе. Он может быть связующим звеном между ферментом и субстратом, может проявлять координирующее свойство, благодаря которому субстрат оказывается в активном центре фермента
2. органические соединения с низкой молекулярной массой, обладающие способностью обратимо связываться с апоферментом (НАД+-никотинамидадениндинуклеотид, НАДФ+-никотинамидадениндинуклеотидфос-
фат, коэнзим А)
3. простетические группы – прочно присоединенные к апоферменту (ФАД-флавинадениндинуклекотид, ФМН-флавинмононуклеотид)
Коферменты принимают участие в связывании и превращении субстратов, поэтому в его отсутствие фермент теряет свою каталитическую активность.
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Влияние температуры на скорость ферментативной реакции
Ферментативные реакции ускоряются при повышении температуры и их кинетика согласуется с правилом Вант-Гоффа. Для биологических катализаторов, которые являются белками, этот закон действует только в строго определенном температурном интервале. Температурный оптимум для большинства ферментов человека составляет 37-38оС. При увеличении температуры выше 40оС происходит денатурация фермента, сопровождающаяся изменением конформации белка.
Снижение температуры замедляет движение молекул, взаимодействие фермента с субстратом, а значит, и образование продукта реакции идет с низкой скоростью. При 0оС ферменты сохраняют слабую активность, но в процессе замораживания клеток биохимические реакции приостанавливаются. После оттаивания ферментативные процессы возобновляются.
Влияние рН на активность ферментов
Ионы (Н+) оказывают влияние на ферментативную активность различными путями. Они изменяют степень ионизации субстрата, продукта и самого фермента. Особое значение имеет ионизация функциональных групп активного центра фермента и фермент-субстратного комплекса, определяющих скорость реакции.
При оптимальном для каждого фермента значении рН конформация активного центра фермента комплементарна субстрата. При изменении рН относительно оптимальных значений изменяется конформация фермента, активного центра, нарушается комплементарность и снижается скорость реакции.
ИНГИБИТОРЫ ФЕРМЕНТОВ
Ингибиторы – это природные или синтетические вешества, полностью подавляющие или снижающие активность ферментов. Выяснение строения активных центров ферментов, механизмов их действия, расшифровка многих биохимических процессов, а также понимание фармакологического действия лекарственных веществ стали возможными благодаря исследованию ингибиторов ферментов. Эти вещества могут иметь разную химическую природу.
Они взаимодействуют с ферментом в области активного центра, изменяют конформацию фермента, активного центра и снижают его активность. В зависимости от прочности взаимодействия ингибитора с ферментом различают – обратимые и необратимые ингибиторы.
Обратимые ингибиторы – связываются с ферментом посредством образования слабых нековалентных связей. Фермент восстанавливает свою нативную конформацию и активность после диссоциации ингибитора. Обратимые ингибиторы бывают двух типов: конкурентные и не конкурентные.
Обратимые конкурентные ингибиторы являются структурными аналогами субстратов. Они связываются в активном центре фермента, но не могут превращаться в продукт. Обратимые конкурентные ингибиторы конкурируют с субстратом за активный центр фермента. При повышении концентрации субстрата он вытесняет ингибитор из активного центра фермента. Например, малоновая кислота очень близкая по структуре к янтарной кислоте конкурирует с ней за активный центр фермента сукцинатдегидрогеназы, которая катализирует превращение сукцината в фумарат. Субстрат и ингибитор (малонат) взаимодействуют с одними и теми же положительно заряженными группами каталитического центра фермента, так как обе кислоты при физиологических значениях рН имеют две отрицательно заряженные карбоксильные группы.
Обратимые неконкурентные ингибиторы присоединяются к ферменту не в активном центре, а в другом месте, вызывая изменение конформаци фермента и его активного центра. Следовательно, обратимое неконкурентное ингибирование фермента не может быть устранено повышением концентрации субстрата. Неконкурентный ингибитор может связываться обратимо как со свободным ферментом, так и с фермент-субстратным комплексом.
Необратимые специфические ингибиторы ковалентно связываются или разрушают функциональную группу молекулы активного центра фермента, необходимую для проявления его каталитической активности.
Примером такого ингибирования может быть действие производных фторфосфатов. Диизопропилфторфосфат образует прочную ковалентную связь с ОН-группой серина в активном центре фермента ацетилхолинестеразы. Ацетилхолинестераза является сериновой гидролазой и катализирует расщепление ацетилхолина до ацетата и холина. При связывании с ингибитором ацетилхолинестераза не гидролизует ацетилхолин, это блокирует проведение нервного импульса через мембрану клетки.
Другой необратимый специфический ингибитор – йодацетамид – может взаимодействовать с SH-группами остатка цистеина, в активном центре фермента.
При оптимальных условиях активность фермента зависит от:
количества субстрата
количества продукта
количества фермента
концентрации кофактора
присутствия активаторов или ингибиторов
