
- •Цитология и
- •Глава 1
- •Глава 2
- •Глава 3
- •7 Mcp иРнк
- •Глава 4
- •Глава 5
- •Покровные эпителии (образуют разнообразные выстилки),
- •Железистые эпителии (образуют железы),
- •3) Сенсорные эпителии (выполняют репепторные функции, вхо- дят в состав органов чувств).
- •1. Плоские
- •Гистогенетическая классификация эпителиев (по н.Г.Хлопину)
- •Глава 6
- •1. Кровь, лимфа
- •2. Кроветворные ткани
- •3. Волокнистые соединительные ткани (собственно соединительные ткани)
- •4. Соединительные ткани со специальными свойствами
- •5. Скелетные соединительные ткани
- •Глава 7
- •4. Миграция адгезированных лейкоцитов через эндотелий
- •Глава 8
- •Глава 10
- •Распределение гликозаминогликанов в организме человека
- •Глава 11
- •Глава 12
- •Глава 13 мышечные ткани
- •Глава 14
- •Глава 1. Предмет и задачи гистологии и цитологии, их место в медицинском образовании и значение
- •Глава 2. Методы цитологических
- •Глава 3. Цитология:
Распределение гликозаминогликанов в организме человека
Гликозаминогликаны |
Органы и ткани |
Гиалуроновая кислота |
Хрящ, синовиальная жидкость, кожа, пуповина, стекловидное тело, аорта |
Хондроитинсульфат, дерматансульфат |
Хрящ, кость, кожа, кровеносные сосуды, сердце |
Гепарансульфат, гепарин Кератансульфат |
Базальные мембраны, аорта, артерии легкого легкое, печень, кожа, гранулы тучных клеток Хрящ, роговица, межпозвонковый диск (студенистое ядро) |
Функции протеогликанов:
Ф взаимодействие с молекулами коллагена (связаны с ними с через каждые 60-65 нм) и влияние на образование коллагеновых волокон (способствуют правильной укладке молекул тропоколлагена в фибриллах и фибрилл в волокнах и ограничивают их рост в толщину);
© обеспечение связи между поверхностью клеток и компонентами межклеточного вещества (фибронектином, ламинином и коллагеном). СЮ44 и синдекан пронизывают плазмолемму, прикрепляясь своим цитоплазматическим участком к элементам цитоскелета (актиновым микрофиламентам), а внеклеточным участком - к компонентам межклеточного вещества (рис. 10-9).
Аналогичную функцию выполняют интегрины (см. также главы 3 и 4) - адгезивные гликопротеины, которые через белки талин и винку-лин связывают актиновые микрофиламенты цитоскелета с коллагеновы-ми волокнами - непосредственно или опосредованно - через молекулы фибронектина (см. рис. 10-9);
© играют важную роль в транспорте электролитов и воды благодаря связыванию большого количества молекул воды;
© связывают, накапливают и выделяют
факторы роста (особенно
активно эту функцию осуществляют гепарин
и гепарансульфат);
связывают, накапливают и выделяют
факторы роста (особенно
активно эту функцию осуществляют гепарин
и гепарансульфат);
Наиболее важные протеогликаны рыхлой волокнистой соединительной ткани включают декорин (связьшается с коллагеном и ре-улирует рост его фибрилл), верзикан (связывает поверхность клеток компонентами межклеточного вешества), перлекан, связьтаюгпийся с фибронектином и опосредующий прикрепление фибробласта к компонентам межклеточного вещества), сшдекан (связывает поверхность клетки с фибронектином), СВ44 (связывает поверхность клетки с фибронектином, ламинином и коллагеном).
Структурные гликопротеины представляют собой нефибриллярные белки, которые способствуют образованию базальных мембран, формированию фибрилл в межклеточном веществе, а также опосредуют взаимодействия между клетками и межклеточным веществом (благодаря присутствию соответствующих рецепторов на поверхности клеток). Они характеризуются разветвленной пептидной цепью, с которой связано небольшое количество простых гексоз. К наиболее важным структурным гликопротеинам относят фибронектин, ламинин и энтактин/нидо-ген.
Фибронектин - гликопротеин, синтезируемый фибробластами и другими клетками мезенхимного происхождения, а также эпителио-цитами. Он обеспечивает организацию компонентов межклеточного вещества: взаимодействует с ГАГ, связывается с коллагеном и опосредует прикрепление к нему тромбоцитов, фибробластов и других клеток, влияя на их различные функции (адгезию, подвижность, рост, синтети-чес-кую и секреторную активность).
Ламинин - гликопротеин, входящий в состав базальных мембран, связьшается с молекулами коллагена IV типа и с рецепторами на поверхности клеток.
Энтактин/нидоген связывается с коллагеном IV типа и ламинином, входит в состав плотной пластинки базальной мембраны.
ВОСПАЛЕНИЕ
Координированное взаимодействие различных клеток рыхлой волокнистой соединительной ткани друг с другом и с элементами межклеточного вещества особенно отчетливо проявляется в таких важнейших взаимосвязанных процессах, как воспаление и регенерация.
Воспаление - эволюционно сформировавшаяся стереотипная защитно-приспособительная реакция на местное повреждение, которая может быть вызвана действием различных факторов - экзогенных (инфекция, травма, ожог, гипоксия и др.) или эндогенных (очаг некроза, гемостаза, отложения солей, иммунных комплексов). Биологический смысл воспаления состоит в ликвидации (или отграничении от здоровой ткани) очага повреждения и вызвавших его патогенных агентов, максимальное анатомическое восстановление ткани с минимальными функциональными нарушениями.
Острое воспаление продолжается от нескольких часов до нескольких суток и характеризуется преимущественным накоплением ней-трофильных гранулоцитов и белкового экссудата в участке повреждения ткани. Хроническое воспаление развивается в том случае, если острая реакция не обеспечила устранения повреждающего агента. При этом происходит инфильтрация ткани моноцитами, макрофагами и лимфоцитами, пролиферация фибробластов и рост мелких кровеносных сосудов. Процесс регенерации тесно связан с воспалением и обычно начинается сразу же после нейтрализации повреждающего агента.
Клиническими признаками воспаления (в особенности, острого), согласно классическим описаниям, являются: покраснение ткани (rubor), ее припухлость (tumor), повышение температуры (calor), боль (dolor) и нарушение функции (functio laesa). Хотя воспаление по своей сути служит защитной реакцией, в некоторых случаях его проявления не адекватны выраженности действия патогенного фактора и сами способны вызвать тяжелые повреждения тканей.
Фазы воспаления
В развитии воспалительной реакции традиционно выделяют три взаимосвязанные и частично перекрывающиеся фазы: (1) фазу альтерации, (2) фазу экссудации и (3) фазу пролиферации.
1. Фаза альтерации (от лат. alteratio - изменение, нарушение) характеризуется повреждением тканей и выделением медиаторов воспаления - комплекса биологически активных веществ, отвечающих за возникновение и поддержание воспалительных явлений. Компоненты поврежденных тканей выделяют хемотаксические факторы, в частности, деполимеризованные белково-гликозаминогликановые комплексы, свободные аминокислоты, полипептиды.
Медиаторы воспаления включают: (а) гуморальные медиаторы, поступающие из плазмы крови (кинины, факторы свертывания, производные комплемента) и (б) клеточные медиаторы, содержащиеся в цитоплазме или вырабатываемые в ответ на стимуляцию моноцитами, макрофагами, тучными клетками, гранулоцитами, тромбоцитами, лимфоцитами и др. клетками (биогенные амины, производные арахидоновой кислоты - эйкозаноиды, лизосомальные ферменты, активные метаболиты кислорода и др.)- Характер и количество выделяемых медиаторов воспаления совместно с природой, выраженностью и распостраненностью действия повреждающего фактора, определяют всю последующую картину воспалительной реакции.
2. Фаза экссудации (от лат. ехвиааио - выпотевание) включает: (1) изменения микроциркуляторого русла, (2) формирование жидкого (бесклеточного) экссудата (3) формирование клеточного экссудата (эмиграцию лейкоцитов),
Изменения микроциркуляторого русла. Реакция сосудов в очаге воспаления начинается с кратковременного (длительностью от нескольких секунд до нескольких минут) спазма мелких артерий и ар-териол, который сменяется их расширением (позднее - также капилляров и венул. Возникает артериальная, а затем и венозная гиперемия (продолжается от нескольких часов - до нескольких суток), которая проявляется типичными местными призаками воспаления - покраснением ткани и повышением ее температуры. Механизм гиперемии связан с выделением вазоактивных веществ - медиаторов воспаления (гистами-на, кининов, серотонина, ФАТ, лейкотриенов и др.) макрофагами, тучными клетками, базофилами, эндотелиальными клетками и тромбоцитами.
Формирование жидкого (бесклеточного) экссудата. Факторами, обеспечивающими усиленную экссудацию жидкой части крови в ткани служат:
(а) Резкое увеличение проницаемости стенок микрососудов (наи- более выраженное в венулах) в очаге воспаления под действием указан- ных медиаторов, а также микробных ферментов. Происходит в резуль- тате усиления везикулярного транспорта, а также сокращения эндотели- альных клеток с появлением щелей между ними.
(б) Повышение гидростатического давления в сосудах вследствие гиперемии ткани.
(в) Увеличение осмотического и онкотического давления в очаге воспаления (в результате альтерации тканей с расщеплением макромо- лекул).
Отек ткани возникает вследствие усиленной экссудации жидкой части крови в участок воспаления при снижении активности венозного оттока и лимфооттока и клинически проявляется возникновением припухлости. Выделение кининов и повышенное гидростатическое давление обусловливают боль в области очага воспаления и нарушение функции органа.
Экссудация способствует притоку в очаг альтерации: (а) бактерицидных факторов сыворотки (антител, компонентов комплемента); (б) ИФНу - неспецифического противовирусного агента; (в) фибриногена, превращающегося в фибрин (который играет роль цементирующего вещества, связывающего различные ткани, является барьером, препятствующим распространению микроорганизмов, и фактром, усиливающим их поглощение фагоцитами); (г) фибронектина, оказывающего на лейкоциты хемоаттрактантное и адгезивное действие.
Замедление кровотока в расширенных сосудах усугубляется нарушениями реологических свойств крови в результате ее сгущения и изменения состава (из-за усиленной экссудации), что способствует марги-нации (краевому стоянию), адгезии и последующей эмиграции (выселению) лейкоцитов. При резком повреждении эндотелия проницаемость его пласта может увеличиваться столь значительно, что будет происходить выход (диапедез) эритроцитов за пределы сосудистого русла.
(3) Формирование клеточного экссудата (эмиграция лейкоцитов). По мере замедления кровотока активируются адгезивные взаимодействия лейкоцитов с эндотелиальными клетками (преимущественно посткапиллярных венул): сначала усиливается их качение по поверхности эндотелия, в дальнейшем оно сменяется прочным прикреплением лейкоцитов к эндотелию и их распластыванием по его поверхности. Эти процессы обусловливаются изменением экспрессии адгезивных молекул на поверхности как эндотелия сосудов, так и лейкоцитов, вызванным локальным действием цитокинов и медиаторов воспалительных реакций (см. главу 7).
После прикрепления к стенке микрососудов лейкоциты мигрируют через межклеточные промежутки в эндотелиалыюй выстилке и базаль-ную мембрану за пределы сосуда. Этот процесс обычно занимает от 3 до 30 мин. (интервалы очень вариабельны). Далее они перемещаются по межклеточному веществу в очаг поврежедения тканей под действием хемотаксических факторов.
Клеточный состав экссудата на разных сроках после альтерации определяется закономерной избирательностью и последовательностью эмиграции отдельных видов лейкоцитов в участок повреждения тканей. Он обусловлен (а) природой повреждающего агента (например, характером продуктов жизнедеятельности микроорганизмов и веществ, образующихся в тканях под влиянием микробных ферментов); (б) особенностями медиаторов воспаления, выделяющихся в ответ на повреждение; (в) дифференциальной (меняющейся во времени) экспрессией адгезивных молекул на эндотелии и лейкоцитах при их стимуляции (в значительной мере связанной с действием медиаторов воспаления). Последовательное выселение в очаг клеток различных типов соответствует тем задачам, которые каждый из них способен выполнить исходя из своих функциональных особенностей.
Нейтрофильные гранулоциты, как правило, наиболее активно выселяются в ткань на начальных этапах острого воспаления (первые 6-24 ч). Они появляются в очаге уже через 10 мин., а через 4-6 ч их содержание в нем обычно достигает пика (составляя более 90% всех клеток). Нейтрофильные гранулоциты в очаге воспаления благодаря наличию мощных антимикробных систем (см. главу 7) выполняют фагоцитарную и микробицидную функции, блокируя проникновение микроорганизмов в окружающие ткани внутренней среды. Продукты их распада, а также вещества, вьщеляющиеся из полностью или частично разрушенных микробных клеток, вызывают приток новых нейтрофилов, а позднее - моноцитов и макрофагов.
Моноциты преобладают в экссудате через 16-24 ч, их содержание в очаге максимально обычно на третьи сутки. Одновременно с ними или несколько позднее эмигрируют лимфоциты. Моноциты крови, которые интенсивно выселяются в очаг воспаления, последовательно превращаются в незрелые, а в дальнейшем - в зрелые макрофаги (см. главу 7). Макрофаги сначала концентрируются по периферии зоны повреждения, содержащей живые и погибшие нейтрофильные гранулоциты, затем проникают вглубь нее. Они активируются под действием цитокинов и микробных продуктов и фагоцитируют погибшие нейтрофилы, клеточный детрит и микроорганизмы, формируя второй отграничивающий (антимикробный) барьер. Однако роль макрофагов, очевидно, не сводится к фагоцитозу и уничтожению патогенного агента, а включает выявление его антигенных детерминант и инициацию иммунной реакции (антаген-представляющая функция).
Хроническое воспаление. Описанные защитные гуморальные и клеточные механизмы, участвующие в острой воспалительной реакции обычно устраняют патогенный фактор в течение 4-6 нед. (в большинстве случаев - за 1.5-2 нед.). Если этого не происходит в указанные сроки, то говорят о том, что воспалительный процесс приобретает хроническое течение. По мнению ряда авторов, в некоторых случаях воспаление изначально может развиваться как хроническое. При хроническом воспалении в очаге численно преобладают макрофаги и лимфоциты, которые часто образуют компактные скопления - гранулемы. Макрофаги в очаге хронического воспаления способны преобразовываться: сливаясь друг с другом, они формируют гигантские многоядерные клетки, а дифференцируясь в элементы, специализированные на секреции различных регуляторных веществ, превращаются в эпителиоидные клетки (см. главу 7). Хроническое воспаление может нередко иметь очень длительное течение, так как клетки, образующие его очаги (макрофаги, лимфоциты, фибробласты, гранулоциты и др.), выделяют различные стимулирующие факторы, способствующие его самоподдержанию.
3. Фаза пролиферации (продуктивная фаза, или фаза репарации). Макрофаги, лимфоциты и другие клетки, инфильтрирующие очаг воспаления, выделяют ряд биологически активных веществ (фибронек-гин, ИЛ-1, ФНО, ТРФР, ТФРР и др.), которые вызывают: (1) хемотаксис, пролиферацию и стимуляцию синтетической активности фибробластов, (2) активацию образования и роста сосудов (ангиогенез).
В результате привлечения в очаг воспаления фибробластов, их усиленной пролиферации и активной синтетической деятельности, а также быстрому разрастанию мелких сосудов формируется богато вас-куляризованная молодая рыхлая волокнистая соединительная ткань с высоким содержанием различных клеточных элементов - грануляционная ткань. В этой ткани постепенно откладывается все большее количество коллагеновых волокон и она со временем из рыхлой преобразуется в плотную, которая формирует рубец.
Благодаря использованию методов тканевой инженерии получены культуры интенсивно пролиферирующих и синтетически активных фибробластов человека, которые вводят в плохо заживающие кожные раны. После трансплантации такие клетки обеспечивают активную выработку межклеточного вещества, заполняющего раневой дефект; одновременно их секреторные продукты стимулируют процессы регенерации поврежденной эпителиальной ткани. Тем самым удается достичь высокого клинического эффекта заживления ран.
Чрезмерному отложению коллагена и других компонентов межклеточного вещества препятствуют: (1) гибель значительного количества активных фибробластов механизмом апоптоза по мере созревания ткани, (2) снижение синтетической активности оставшихся фибробластов, (3) повышение коллагенолитической активности фибробластов и макрофагов. В перестройке рубца и его частичной инволюции принимают участие также гранулоциты (например, эозинофилы), лимфоциты и тучные клетки.
Роль рыхлой волокнистой соединительной ткани в регенерации различных органов и тканей неоднозначна. При гибели участка органа вследствие каких-либо патологических процессов имеющаяся в органе рыхлая волокнистая соединительная ткань активно реагирует на повреждение и способна, разрастаясь и преобразуясь в соответствии с описанной выше последовательностью, заполнять участки погибшей функционально ведущей ткани органа. Такая регенерация органа называется неполной (заместительной), поскольку соединительная ткань лишь замещает ранее имевшуюся ткань, но не может компенсировать ее утраченную функцию.
Если поврежденная функционально ведущая ткань органа неспособна к регенерации на тканевом и клеточном уровнях, то соединительная ткань играет в целом полезную роль, замещая образующейся дефект и связывая ее неповрежденные участки. Так, при инфаркте миокарда, вызванном острым нарушением кровоснабжения отдельного участка сердечной мьшщы, на месте погибшей и неспособной к регенерации сердечной мышечной ткани возникает соединительнотканный рубец, который обеспечивает целостность мышечной оболочки сердца. Однако этот участок миокарда функционально неполноценен, поскольку он не обеспечивает необходимой сократительной функции. Более того, при значительных размерах рубца он может постепенно мешковидно растягиваться (вследствие высокого давления в камерах сердца), формируя аневризму сердца (от греч. апеигупо - расширение), которая со временем истончается и в конечном итоге разрывается, вызывая мгновенную смерть больного.
Если функционально ведущая ткань органа способна к регенерации на тканевом и клеточном уровнях, то быстро разрастающаяся волокнистая соединительная ткань во многих случаях может препятствовать нормальному течению этого процесса. Так, опережая восстановление функционально ведущих тканей и формируя рубцы, она способна нарушать регенерацию нервов, скелетных мышц и стенки полых органов, содержащих гладкую мышечную ткань (например, матки, маточной трубы, мочеточника, кишки).
Соединительнотканные рубцы, возникающие в различных органах после повреждений, могут изменить их архитектонику, деформировать, сузить просвет (вплоть до его полной облитерации), вызвать смещение (при образовании спаек в плевральной, брюшной полости или сердечной сумке), нарушить кровоснабжение и иннервацию. Рубцовые изменения клапанов сердца способны полностью нарушить его функцию.
ПЛОТНАЯ ВОЛОКНИСТАЯ СОЕДИНИТЕЛЬНАЯ ТКАНЬ
Плотная волокнистая соединительная ткань образована теми же компонентами, что и рыхлая волокнистая соединительная ткань, отличаясь от нее (1) очень высоким содержанием волокон (преимущественно коллагеновых), формирующих толстые пучки и занимающих основную часть объема ткани, (2) малым количеством основного аморфного вещества в составе межклеточного вещества (3) сравнительно низким содержанием клеточных элементов и (4) преобладанием одного (главного) типа клеток - фиброцитов - над остальными (особенно в плотной оформленной ткани).
Главное свойство плотной волокнистой соединительной ткани - очень высокая механическая прочность - обусловлено присутствием мощных пучков коллагеновых волокон. Ориентация этих волокон соответствует направлению действия сил, вьпывающих деформацию гкани.
Плотная волокнистая неоформленная соединительная ткань характеризуется неупорядоченным расположением пучков коллагеновых волокон в трех различных плоскостях, которые переплетаются между собою, формируя трехмерную сеть (рис. 10-10). Последняя обеспечивает прочность ткани при воздействии деформирующих сил нобой направленности. Помимо коллагеновых волокон, имеются также ¡1 эластические, также формирующие трехмерную сеть. Содержание основного аморфного вещества невелико, клетки немногочисленны. Сре-ти клеток преобладают фиброциты и фибробласты, но встречаются и другие клеточные элементы (тучные клетки, гистиоциты, лейкоциты). Чалодифференцированные элементы сосредоточены в тонких прослой-ках рыхлой волокнистой ткани, окружающих сосуды. Такая ткань обра-(ует глубокий (сетчатый) слой дермы (соединительнотканной части кожи), капсулы различных органов. Ткань, образующая капсулы, отличатся более упорядоченным расположением коллагеновых волокон (преимущественно параллельно поверхности органа), чем в сетчатом слое гермы, благодаря чему отчасти напоминает плотную волокнистую офор-шенную соединительную ткань.
Плотная волокнистая оформленная соединительная
ткань содержит толстые пучки коллагеновых волокон, располагающейся параллельно друг другу (в направлении действия нагрузки), которые вязаны небольшим количеством основного аморфного вещества (рис.
1 0-11).
Между ними специальными красителями
можно выявить тонкие сети эластических
волокон. Содержание клеток невелико;
среди них подавляющее большинство
составляют фиброциты.
Описанное
строение имеет ткань, образующая
сухожилия,
связки, фасции и апоневрозы.
0-11).
Между ними специальными красителями
можно выявить тонкие сети эластических
волокон. Содержание клеток невелико;
среди них подавляющее большинство
составляют фиброциты.
Описанное
строение имеет ткань, образующая
сухожилия,
связки, фасции и апоневрозы.
т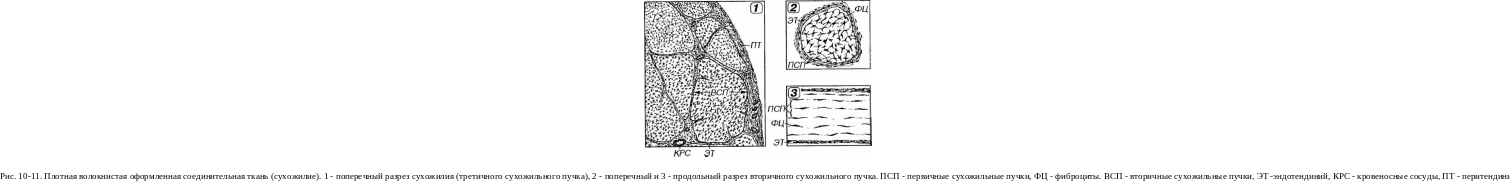 орые
связывают клетки электрически и
химически. При этом фиброциты образуют
единую систему (подобную той, что
объединяет остеоци-ты в костной ткани
- см. главу 12). Так как клеточные отростки
посредством интегринов связаны с
коллагеновыми волокнами, малейшие
изменения нагрузки передаются на клетки
и влияют на активность их синтетических
процессов, регулируя выработку компонентов
межклеточного вещества.
орые
связывают клетки электрически и
химически. При этом фиброциты образуют
единую систему (подобную той, что
объединяет остеоци-ты в костной ткани
- см. главу 12). Так как клеточные отростки
посредством интегринов связаны с
коллагеновыми волокнами, малейшие
изменения нагрузки передаются на клетки
и влияют на активность их синтетических
процессов, регулируя выработку компонентов
межклеточного вещества.
Сухожилия представляют собой удлиненные цилиндрические или уплощенные образования, которые связывают поперечнополосатую соматическую мышцу с костью. Они образованы плотно упакованными параллельными пучками коллагеновых волокон, между которыми располагаются ряды фиброцитов, которые именуют также сухожильными клетками, или тендиноцитами (от лат. *епс1о - сухожилие). Последние характеризуются удлиненными ядрами, ориентированными вдоль оси сухожилия (параллельно коллагеновым пучкам), и слабо оксифильной цитоплазмой, трудно различимой на уровне светового микроскопа. Периферические участки цитоплазмы образуют уплощенные пластинчатые отростки, охватывающие пучки коллагеновых волокон. На поперечных срезах сухожилия его клетки имеют звездчатую форму; специальными исследованиями показано, что своими отростками они латерально контактируют друг с другом, формируя типичные щелевые соединения, ко-
Сухожилие как орган включает: (1) компоненты, образованные плотной волокнистой соединительной тканью - пучки коллагеновых волокон различных порядков с расположенными между ними фиброцитами; (2) оболочки (прослойки) из рыхлой и плотной неоформленной соединительных тканей, окружающие пучки коллагеновых волокон и несущие кровеносные сосуды и нервы. В сухожилии выделяют первичные, вторичные и третичные сухожильные пучки (см. рис. 10-6 и 10-11).
Первичные сухожильные (коллагеновые) пучки (пучки первого порядка) располагаются между рядами фиброцитов.
Вторичные сухожильные (коллагеновые) пучки (пучки второго порядка) образованы группой первичных пучков, окруженных снаружи оболочкой из рыхлой волокнистой неоформленной соединительной ткани - эндотендшшем, в которой проходят кровеносные и лимфатические сосуды и нервные волокна.
Третичные сухожильные (коллагеновые) пучки (пучки третьего порядка) состоят из нескольких вторичных пучков, которые окружены снаружи оболочкой из плотной волокнистой неоформленной соединительной ткани - перитендишем, отдающего вглубь сухожилия прослойки эндотендиния.
Сухожилие в целом может представлять собой третичный пучок, в некоторых случаях оно складывается из нескольких третичных пучков, окруженный общей оболочкой - эпшпендинием.
Связки соединяют кости друг с другом и по строению сходны с сухожилиями, отличаясь от них несколько менее строго ориентированным расположение коллагеновых волокон. В большинстве связок преобладают коллагеновые волокна, однако в некоторых из них (желтые связки, соединяющих позвонки, голосовые связки, а также подвешивающая связка полового члена) функционально ведущими элементами служат толстые пучки эластических волокон, разделенные тонкими прослойками коллагеновых волокон и рядами фиброцитов. Такие связки называют эластическими.
Фасции и апоневрозы также образованы плотной волокнистой соединительной тканью, в которой пучки коллагеновых волокон и фиброциты располагаются в виде пластин (мембран). В каждой пластине волокна располагаются параллельно друг другу, но они могут менять свое направление в различных пластинах.
