
Задание для выполнения ргр (I этап) Тема. Основные закономерности протекания химических процессов
Задание. Дано уравнение реакции (см. вариант в табл.).
Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин
 и
и
 .
.Вычислите изменение энтальпии реакции
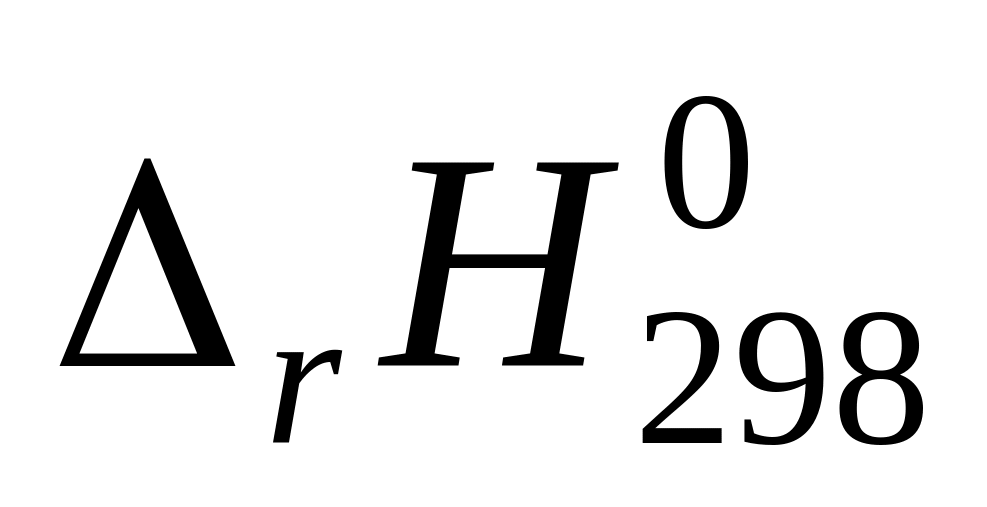 и
определите, является ли данная реакция
экзо- или эндотермической. Запишите
термохимическое уравнение реакции.
и
определите, является ли данная реакция
экзо- или эндотермической. Запишите
термохимическое уравнение реакции.Вычислите, какое количество теплоты Q выделяется или поглощается в ходе реакции для заданной массы m или объема V одного из вступивших в реакцию веществ.
По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции
 .
Вычислив изменение энтропии реакции
в стандартных условиях, объясните знак
.
.
Вычислив изменение энтропии реакции
в стандартных условиях, объясните знак
.Вычислите энергию Гиббса прямой реакции в стандартных условиях
 и установите возможность самопроизвольного
протекания реакции.
и установите возможность самопроизвольного
протекания реакции.Определите температуру, при которой реакция находится в равновесии (Тр).
Рассчитайте
 при
Т=Тр–100, Т=Тр+100.
при
Т=Тр–100, Т=Тр+100.Постройте график зависимости от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
Вычислите значения константы равновесия Кc для температур: Т=Тр, Т=Тр–100, Т=Тр+100. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
-
Номер
варианта
Значения
 ,кДж/моль;
,кДж/моль; (298
К), Дж/(Кмоль)
(298
К), Дж/(Кмоль)Уравнение реакции
mA,
г
VB,
л
1
ССl4(г) + 2 Н2(г) = СН4(г) + 2 Сl2

–106,7 0 –74,85 0
5,6
309,7 130,58 186,2 222,96
2
2 BCl3(г) + 3 Н2(г) 2 В(т) + 6 HCl(г)
– 402,96 0 0 –92,3
11,2
290,08 130,58 5,87 187
3
4 NH3(г) + 3 О2 = 2 N2(г) + 6Н2О(ж)
–46,19 0 0 –285,84
11,2
192,5 205,04 191,5 70,08
4
2 NH3(г) + SO3(г) + Н2О(г) = (NH4)2SO4(к)
–46,19 –395,2 –241,82 –1179,3
5,1
192,5 256,23 188,7 220,3
5
СН4(г) + 2 Н2О(г) = СО2(г) + 4 Н2(г)
–74,85 –241,82 –393,51 0
13,44
186,2 188,7 213,68 130,58
6
8 NH3(г) + 6 NO2(г) = 7 N2(г) + 12 Н2О(ж)
–46,19 33,5 0 –285,84
10,2
192,5 240,45 191,5 70,08
7
СО2(г) + 4 Н2 = СН4(г) + 2 Н2О(г)
–396,3 0 –74,85 –241,82
16,8
213,68 130,58 186,19 188,7
8
2 H2S(г) + SO2(г) = 3 S(к) + 2 Н2О(г)
–20,17 –296,9 0 –241,82
25,5
205,6 248,1 31,88 188,7
9
2 РН3(г) + 4 О2 = Р2О5(к) + 3 Н2О(ж)
5,44 0 –1492 –285,84
17
210,1 205,04 114,5 70,08
10
2 H2S(г) + 3 О2 = 2 Н2О(ж) + 2 SO2(г)
–20,17 0 –285,84 –269,9
17
205,6 205,04 70,08 248,1
11
CS2(г) + 4 Н2 = 2 H2S(г) + СН4(г)
110,7 0 –20,17 –74,9
11,2
237,77 130,58 205,6 186,2
12
2 H2S(г) + O2(г) = 2 S(к) + 2 Н2О(ж)
–20,17 0 0 –285,84
3,4
205,6 205,04 31,88 70,08
13
2 СН3ОН(ж) + 3 О2 = СО2(г) + 2 Н2О(ж)
–238,57 0 –393,51 –285,84
7,84
126,78 222,96 213,68 70,08
14
2 PCl5(г) + О2 = 2 POCl3(г) + 2 Сl2(г)
–374,89 0 –306 0
20,8
364,47 205,04 324 222,96
15
СО2(г) + 2 SO3(г) = СS2(г) + 4 О2(г)
–393,51 –395,2 110,7 0
3,36
213,68 256,23 237,77 205,04
16
2S(т) + 2 Н2О(г) = О2(г) + Н2S(г)
0 –241,82 0 –20,17
1,7
31,88 188,7 205,04 205,6
17
NО(г) + 2 Н2(г) = N2(г) + 2 Н2О(ж)
15
90,25 0 0 –285,84

210,62 130,58 191,5 70,08
18
3 Fe(т) + 4 Н2О(г) = Fe3O4(т) + 4 Н2(г)
5,6
0 –241,82 -11173,13 0
27,15 188,7 146,19 130,58
19
2 NO(г) + 2 H2S(г) N2(г) + 2 H2O(г) + 2S(т)
90,25 –20,17 0 –241,82 0
13,44
210,62 205,6 191,5 188,7 31,88
20
SiCl4(г) + 2 Н2(г) Si(т) + 4 HCl(г)
–657,52 0 0 –92,3
6,72
330,95 130,58 18,83 187
21
SО2(г) + 2 Н2S (г) 3S(т) + 2 H2O (ж)
–296,9 –20,17 0 –285,84
6,6
248,1 205,6 31,88 70,08
22
SiН4(г) + 2 О2(г) SiО2(т) + 2 H2O (ж)
34,73 0 –903,5 –285,84
5,6
204,55 205,04 46,86 70,08
23
2 H2О (г) + 2 Cl2(г) = 4 НCl (г) + O2(г)
–241,82 0 –92,3 0
3,6
188,7 223 187 205,04
