
- •Введение
- •1 .Гармонические колебания пружинного маятника
- •2. Свободные колебания маятника
- •3.Вынужденные колебания маятника
- •4.Сложение перпендикулярных колебаний. Фигуры Лиссажу
- •5. Метод решения задач механики с использованием вычислительной техники
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа № 2 (7к) Основы термодинамики
- •Основы теории
- •Применение первого закона термодинамики к различным процессам
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа №3 Термодинамика циклических процессов
- •Основы теории
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа № 4 (12к) Исследование электростатического поля
- •Основы теории
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа № 5 (19к) Движение частиц в электромагнитном поле
- •Основы теории
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа № 6 (ззк) Дифракция Фраунгофера
- •Основы теории
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа № 7 (38к) Водородоподобные атомы
- •Основы теории
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа № 8 Радиоактивность
- •Основы теории
- •Результаты измерений
- •Результаты экспериментов
- •Результаты экспериментов
- •Период полураспадов некоторых радиоактивных изотопов
- •Лабораторная работа № 9 Количественные характеристики цвета. Сложение цветов
- •Основы теории
- •Характеристики света
- •Классификация цветов
- •Задание к лабораторной работе
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Результаты измерений
- •Лабораторная работа № 10 Определения коэффициента внутреннего трения жидкости
- •Результаты измерений
- •Контрольные вопросы
- •Методика обработки результатов
- •Коэффициент Стьюдента tα,n
- •Библиографический список
- •Содержание
- •644099, Г. Омск, ул. П. Некрасова, 10
- •644099, Г. Омск, ул. П. Некрасова, 10
Применение первого закона термодинамики к различным процессам
Изотермический
процесс. В
идеальном газе внутренняя энергия
определяется абсолютной температурой.
При изотермическом расширении или
сжатии газа его температура не меняется.
В изотермическом процессе изменение
внутренней энергии равно нулю:
![]() =0.
На основании первого закона термодинамики
при изотермическом расширении газа
переданное количество теплоты Q
равно
работе А,
совершенной
газом: Q
= A.
=0.
На основании первого закона термодинамики
при изотермическом расширении газа
переданное количество теплоты Q
равно
работе А,
совершенной
газом: Q
= A.
Работа же в данном процессе
 .
.
Изохорный процесс. При изохорном процессе работа газа равна нулю, поэтому изменение внутренней энергии идеального газа равно полученному количеству теплоты Q.
Итак,
при изохорном процессе Q
= ∆U
=![]() .
.
Изобарный
процесс. Изобарное
расширение газа происходит при
передаче ему количества теплоты Q.
В
результате нагревания газа происходит
увеличение его внутренней энергии и
совершение работы расширения:
![]() .
.
Адиабатный процесс. Адиабатным называется процесс изменения объема, давления и температуры газа при отсутствии теплообмена с окружающими телами, то есть при условии Q = 0.
При адиабатном расширении газ совершает работу за счет уменьшения внутренней энергии: = – А. Поэтому температура газа при адиабатном расширении понижается. Используя полученное выражение, а также уравнение состояния идеального газа, можно получить уравнение адиабатного процесса (уравнение Пуассона):
![]() =
const,
=
const,
где – коэффициент Пуассона.
Теплоемкость газов. Теплоемкостью называется количество теплоты, необходимой для нагревания тела на 1 К. Для анализа теплоемкости газов удобно использовать молярную теплоемкость, которая равна количеству теплоты, необходимой для нагревания одного моля вещества на 1 К:

или, используя уравнение состояния идеального газа, можно рассчитать молярную теплоемкость каждого процесса по формуле
![]()
Единица
молярной теплоемкости -
![]()
Молярная теплоемкость газа зависит от процесса с ним производимого. Для изохорного процесса соответственно можем получить

в случае изобарного процесса

Следовательно, для γ можно получить:
![]() .
.
Задание к лабораторной работе
Данная программа предназначена для проведения лабораторных работ по термодинамике для студентов технических вузов. Она позволяет моделировать и получать количественные характеристики любого термодинамического (квазистатического) процесса. Также имеется возможность увидеть графики этих процессов при любой функциональной зависимости координатных осей.
Лабораторная установка представляет собой цилиндр с подвижным поршнем, заполненный двухатомным идеальным газом (молярную массу можно выбирать произвольно). Газ в установке можно нагревать (охлаждать). В программе предусмотрена возможность помещения установки в термостат. Для начала эксперимента необходимо ввести начальные значения необходимых вам параметров. Невведенные параметры вычисляются через известные или им присваиваются (в случае нехватки параметров для вычисления) значения параметров при нормальных условиях.
Изотермический процесс
1. Выберите в окне программы значение массы газа, степень свободы и молярную массу газа (рис.2). Занесите в табл.1 начальные параметры газа.
2. Для проведения с газом изотермического процесса необходимо рядом с буквой Т установить флажок.
3. Уменьшите объём газа перетаскиванием бегунка полосы прокрутки, расположенного справа от рисунка.
4. Занесите в табл. 1 конечные параметры газа, а также количество теплоты, сообщенное газу, изменение внутренней энергии и совершенную газом работу.
5. Рассчитайте теплоемкость газа в данном процессе.
6. Зарисуйте графики изотермического процесса в координатах рV, рТ, VT.
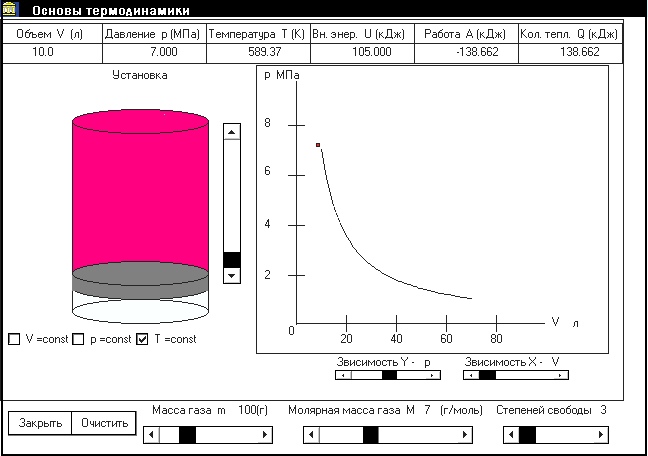
Рис.2. Рабочее окно программы
Таблица 1
