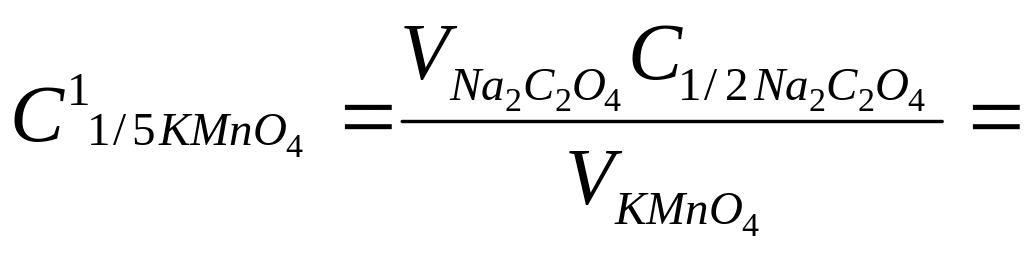- •Введение
- •Титриметрические методы анализа
- •Растворы, применяемые в титриметрическом методе анализа
- •Способы титрования
- •Кислотно-основноЕ титрованиЕ
- •Лабораторная работа 1 Определение содержания уксусной кислоты в растворе методом кислотно-основного титрования
- •Приготовление первичного стандарта янтарной кислоты hoocch2ch2cooh.
- •Приготовление и стандартизация титранта (раствора NaOh).
- •Определение содержания уксусной кислоты в исследуемом растворе
- •4. Статистическая обработка результатов анализа [5].
- •Лабораторная работа 2 Определение содержания этилендиамина в растворе методом кислотно-основного титрования
- •1. Приготовление первичного стандарта карбоната натрия (Na2co3).
- •2. Приготовление и стандартизация титранта (раствора hCl)
- •3. Определение содержания этилендиамина в исследуемом растворе
- •Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторным работам № 1,2 Теоретические вопросы
- •Практические вопросы
- •Комплексонометрическое титрование
- •2) Комплексон II (этилендиаминтетрауксусная кислота, эдту, h4y)
- •Расчетные формулы для построения кривых титрования в комплексонометрии
- •Классификация методов комплексонометрического титрования
- •Лабораторная работа 3 Определение содержания кальция (II) и магния (II) в растворе при совместном присутствии методом комплексонометрии
- •1. Стандартизация титранта – раствора эдта (Na2h2y)
- •4. Статистическая обработка результатов анализа
- •Лабораторная работа 4 Определение содержания меди(II) в растворе методом комплексонометрии
- •1. Стандартизация титранта - раствора эдта (Na2h2y).
- •2. Определение содержания меди (II) в растворе.
- •3. Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторным работам № 3 и № 4 Теоретические вопросы
- •Окислительно-восстановительное титрование
- •Кривые титрования
- •Константа равновесия редокс-реакции
- •Индикация точки эквивалентности при окислительно-восстановительном титровании
- •Перманганатометрия
- •Хроматометрия
- •Йодметрия
- •Йодатометрия
- •Лабораторная работа 5 Определение содержания меди (II) в растворе методом йодометрического титрования
- •1 Приготовление и стандартизация рабочего раствора тиосульфата натрия (Na2s2o3)
- •2. Определение содержания меди (II) в исследуемом растворе
- •3. Статистическая обработка результатов анализа
- •4. Статистическая обработка результатов определения содержания меди (II) в растворе, полученных двумя методами (комплексонометрия и йодометрия).
- •Контрольные вопросы и задачи к лабораторной работе № 5 Теоретические вопросы
- •Броматометрия
- •Лабораторная работа 6 Определение содержания фенолфталеина в растворе методом бромид-броматометрии с йодОметрическим окончанием
- •Сущность метода определения фенолфталеина
- •1. Приготовление стандартного раствора бромата калия.
- •2. Стандартизация рабочего раствора Na2s2o3 (стандартизовать, не разбавляя!)
- •3. Приготовление анализируемого спиртового раствора фенолфталеина
- •4. Определение содержания фенолфталеина
- •5. Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторной работе № 6 Теоретические вопросы
- •Нитритометрия
- •Лабораторная работа 7 Анализ лекарственных препаратов производных п-аминобензолсульфаниламида методом нитритометрии
- •1. Стандартизация раствора NaNo2.
- •2. Определение содержания сульфаниламида в препарате
- •Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторной работе № 7
- •Библиографический список ПриложениЯ
Лабораторная работа 7 Анализ лекарственных препаратов производных п-аминобензолсульфаниламида методом нитритометрии
Цель работы:
1) закрепление теоретических знаний о методе нитритометрии;
2) практическое применение данного метода титрования для определения массы сульфаниламида в препарате на примере растворимого стрептоцида.
Реактивы
1. Раствор оксалата натрия Na2C2O4 с молярной концентрацией эквивалента 0,1000 моль/дм3 – первичный стандарт.
Сульфаниловая кислота C6H4NH2SO3H, высушенная до постоянной массы, – первичный стандарт.
Раствор KMnO4 с молярной концентрацией эквивалента 0,1 моль/дм3.
Раствор серной кислоты H2SO4 с молярной концентрацией 2 моль/дм3.
Дистиллированная вода.
Раствор нитрита натрия NaNO2 с молярной концентрацией 0,1 М (молярная концентрация эквивалента 0,2 моль/дм3).
Раствор гидрокарбоната натрия NaHCO3 с массовой долей 5 %.
Раствор соляной кислоты HCl, разбавленной 1:3.
Бромид калия KBr кристаллический.
Раствор метиленового синего c массовой долей 0,2 % (нейтральный светофильтр).
Раствор тропеолина 00 с массовой долей 0,1 % (индикатор).
Ход работы:
1. Стандартизация раствора NaNo2.
1.1. Стандартизации раствора NaNO2 по раствору KMnO4
Раствор KMnO4 не является первичным стандартом, поэтому его стандартизуют по оксалату натрия.
1.1.1. Приготовление стандартного раствора Na2C2O4
Раствор оксалата
натрия готовят объёмом 200,00 см3
с молярной концентрацией эквивалента
![]() моль/дм3.
моль/дм3.
Расчет массы
навески, г:
![]() (масса берется с точностью до четвертого
знака после запятой).
(масса берется с точностью до четвертого
знака после запятой).
C2O4 2- - 2e 2CO2
M1/z (Na2C2O4) = М(Na2C2O4 )/2 = 67,00 г/моль/
Взятие навески (взвешивание):
Масса часового стекла (стакана)
Масса часового стекла (стакана) с навеской
Масса навески
Навеску количественно переносят в мерную колбу ( см3), добавляют 50 – 70 см3 дистиллированной воды, перемешивают до полного растворения оксалата натрия, доводят до метки дистиллированной водой и тщательно перемешивают.
1.1.2. Стандартизация раствора KMnO4
Кривую титрования Na2C2O4 раствором KMnO4 при [Н+]=1 строят самостоятельно.
Раствор KMnO4 применяется с молярной концентрацией эквивалента 0,1 моль/дм3.
Схема 14. Стандартизация раствора KMnO4 по раствору Na2C2O4

В коническую колбу для титрования вместимостью 250 см3 помещают 25,00 см3 раствора Na2C2O4 с молярной концентрацией эквивалента 0,1000 моль/дм3, прибавляют 15 см3 раствора серной кислоты с молярной концентрацией 2 моль/дм3, разбавляют горячей дистиллированной водой (~ 70 см3) и титруют раствором KMnO4 до появления устойчивой слабо-розовой окраски от одной капли. Результаты титрований заносят в табл. 16. Концентрацию KMnO4 рассчитывают по закону эквивалентов:
![]() .
.
Таблица 16
Результаты стандартизации раствора KMnO4 по Na2C2O4
№ опыта |
Объем Na2C2O4, см3 |
Объем KMnO4, см3 |
Концентрация KMnO4, моль/дм3 |
Средняя концентрация KMnO4, моль/дм3 |
1 |
25,00 |
|
|
|
2 |
25,00 |
|
|
|
3 |
25,00 |
|
|
1.1.3. Приготовление и стандартизация раствора NaNO2
Раствор NaNO2 применяется 0,1 М (с молярной концентрацией эквивалента 0,2 моль/дм3).
Схема 15. Стандартизация раствора NaNO2 по раствору KMnO4 и Na2C2O4
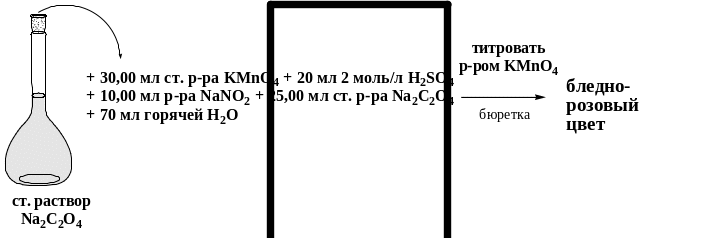
В
коническую колбу для титрования
вместимостью 250 см3
помещают
30,00 см3
стандартного раствора KMnO4
(![]() =
0,1000 моль/дм3),
прибавляют 20 см3
серной кислоты с молярной концентрацией
2 моль/дм3,
10,00 см3
NaNO2
(раствор перемешивают) и 25,00 см3
стандартного раствора Na2C2O4.
К раствору приливают 70 см3
горячей дистиллированной воды. Избыток
щавелевой кислоты (горячий раствор)
оттитровывают стандартным раствором
KMnO4
до появления устойчивой слабо-розовой
окраски от одной капли.
=
0,1000 моль/дм3),
прибавляют 20 см3
серной кислоты с молярной концентрацией
2 моль/дм3,
10,00 см3
NaNO2
(раствор перемешивают) и 25,00 см3
стандартного раствора Na2C2O4.
К раствору приливают 70 см3
горячей дистиллированной воды. Избыток
щавелевой кислоты (горячий раствор)
оттитровывают стандартным раствором
KMnO4
до появления устойчивой слабо-розовой
окраски от одной капли.
Концентрацию нитрита натрия рассчитывают по формуле
 ,
,
где V1 (KMnO4) – введенный в реакционную смесь объем титранта перманганата калия, см3;
V2 (KMnO4) – объем титранта перманганата калия, затраченный на титрование Na2S2O3, см3.
Результаты параллельных титрований заносят в табл. 17.
Таблица 17
Результаты стандартизации раствора NaNO2 по KMnO4
№ опыта |
Введено KMnO4, V1, см3 |
Объем раствора NaNO2, см3 |
Объем раствора Na2C2O4, см3 |
Объем KMnO4, V2, см3 |
Концентрация NaNO2, моль/дм3 |
Средняя концентра-ция NaNO2, моль/дм3 |
1 |
30,00 |
10,00 |
25,00 |
|
C1= |
|
2 |
30,00 |
10,00 |
25,00 |
|
C2= |
|
3 |
30,00 |
10,00 |
25,00 |
|
C3= |
1.2.Стандартизации раствора NaNO2 по сульфаниловой кислоте
Сульфаниловую кислоту предварительно высушивают при температуре 105°С до постоянной массы.
1.2.1. Приготовление стандартного раствора сульфаниловой кислоты
Раствор сульфаниловой
кислоты готовят объёмом 100,00 см3
с молярной концентрацией
![]() моль/дм3.
моль/дм3.
Расчет массы
навески, г:
![]() (масса берется с точностью до четвертого
знака после запятой).
(масса берется с точностью до четвертого
знака после запятой).
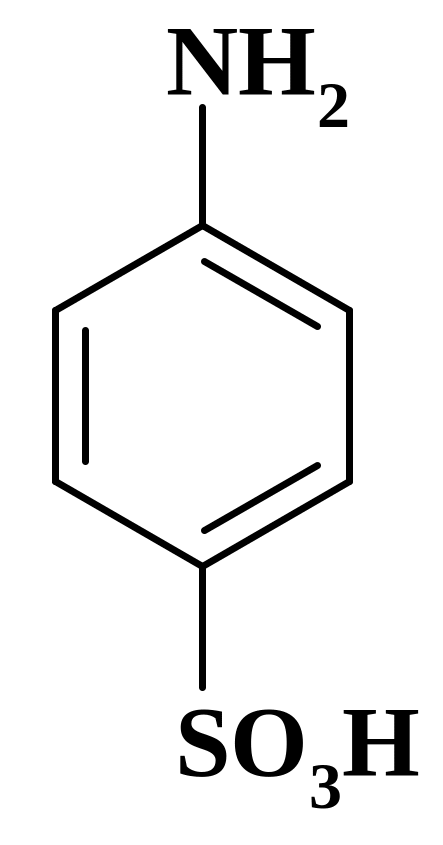
М1/z (сульфаниловой кислоты) = М (сульфаниловой кислоты)=173,20 г/моль.
Взятие навески (взвешивание):
Масса часового стекла (стакана)
Масса часового стекла (стакана) с навеской
Масса навески
Навеску сульфаниловой кислоты растворяют в воде в присутствии 5 % –ного раствора NaHCO3 (АККУРАТНО! : образуется водорастворимая соль сульфаниловой кислоты и бурно выделяется CO2), количественно переносят в мерную колбу, доводят водой до метки и перемешивают.
Схема 16. Стандартизация раствора NaNO2 по раствору сульфаниловой кислоты

В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту сульфаниловой кислоты 20,00 см3, добавляют 10 мл HCl (1:3), кристаллы KBr, 2 капли тропеолина 00 и 1 каплю метиленового синего и титруют 0,1 М NaNO2.
ВНИМАНИЕ! Определение выполняют при температуре не выше 18–20 0С. Скорость титрования должна быть замедленной: в начале – 2,00 см3 в 1 мин, в конце титрования – 0,05 см3 в 1 мин.
Результаты титрования заносят в табл. 18. Концентрацию NaNO2 рассчитывают по закону эквивалентов:
![]() .
.
Таблица 18
Результаты стандартизации раствора NaNO2 по сульфаниловой кислоте
№ опыта |
Объем сульфани- ловой кислоты, см3 |
Объем NaNO2, см3 |
Концентрация NaNO2, моль/дм3 |
Средняя концентрация NaNO2, моль/ дм3 |
1 |
20,00 |
|
|
|
2 |
20,00 |
|
|
|
3 |
20,00 |
|
|