
- •Введение
- •Титриметрические методы анализа
- •Растворы, применяемые в титриметрическом методе анализа
- •Способы титрования
- •Кислотно-основноЕ титрованиЕ
- •Лабораторная работа 1 Определение содержания уксусной кислоты в растворе методом кислотно-основного титрования
- •Приготовление первичного стандарта янтарной кислоты hoocch2ch2cooh.
- •Приготовление и стандартизация титранта (раствора NaOh).
- •Определение содержания уксусной кислоты в исследуемом растворе
- •4. Статистическая обработка результатов анализа [5].
- •Лабораторная работа 2 Определение содержания этилендиамина в растворе методом кислотно-основного титрования
- •1. Приготовление первичного стандарта карбоната натрия (Na2co3).
- •2. Приготовление и стандартизация титранта (раствора hCl)
- •3. Определение содержания этилендиамина в исследуемом растворе
- •Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторным работам № 1,2 Теоретические вопросы
- •Практические вопросы
- •Комплексонометрическое титрование
- •2) Комплексон II (этилендиаминтетрауксусная кислота, эдту, h4y)
- •Расчетные формулы для построения кривых титрования в комплексонометрии
- •Классификация методов комплексонометрического титрования
- •Лабораторная работа 3 Определение содержания кальция (II) и магния (II) в растворе при совместном присутствии методом комплексонометрии
- •1. Стандартизация титранта – раствора эдта (Na2h2y)
- •4. Статистическая обработка результатов анализа
- •Лабораторная работа 4 Определение содержания меди(II) в растворе методом комплексонометрии
- •1. Стандартизация титранта - раствора эдта (Na2h2y).
- •2. Определение содержания меди (II) в растворе.
- •3. Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторным работам № 3 и № 4 Теоретические вопросы
- •Окислительно-восстановительное титрование
- •Кривые титрования
- •Константа равновесия редокс-реакции
- •Индикация точки эквивалентности при окислительно-восстановительном титровании
- •Перманганатометрия
- •Хроматометрия
- •Йодметрия
- •Йодатометрия
- •Лабораторная работа 5 Определение содержания меди (II) в растворе методом йодометрического титрования
- •1 Приготовление и стандартизация рабочего раствора тиосульфата натрия (Na2s2o3)
- •2. Определение содержания меди (II) в исследуемом растворе
- •3. Статистическая обработка результатов анализа
- •4. Статистическая обработка результатов определения содержания меди (II) в растворе, полученных двумя методами (комплексонометрия и йодометрия).
- •Контрольные вопросы и задачи к лабораторной работе № 5 Теоретические вопросы
- •Броматометрия
- •Лабораторная работа 6 Определение содержания фенолфталеина в растворе методом бромид-броматометрии с йодОметрическим окончанием
- •Сущность метода определения фенолфталеина
- •1. Приготовление стандартного раствора бромата калия.
- •2. Стандартизация рабочего раствора Na2s2o3 (стандартизовать, не разбавляя!)
- •3. Приготовление анализируемого спиртового раствора фенолфталеина
- •4. Определение содержания фенолфталеина
- •5. Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторной работе № 6 Теоретические вопросы
- •Нитритометрия
- •Лабораторная работа 7 Анализ лекарственных препаратов производных п-аминобензолсульфаниламида методом нитритометрии
- •1. Стандартизация раствора NaNo2.
- •2. Определение содержания сульфаниламида в препарате
- •Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторной работе № 7
- •Библиографический список ПриложениЯ
Кривые титрования
В редоксметрии кривые титрования строят в координатах Е = f(CR), они иллюстрируют графическое изменение потенциала системы в процессе титрования. До точки эквивалентности потенциал системы рассчитывается по отношению концентраций окисленной и восстановленной форм определяемого вещества (потому что до точки эквивалентности одна из форм титранта практически отсутствует), после точки эквивалентности – по отношению концентраций окисленной и восстановленной форм титранта (потому что после точки эквивалентности определяемое вещество оттитровано практически полностью).
Потенциал в точке эквивалентности определяется по формуле
![]() ,
(26)
,
(26)
где
![]() – число электронов, участвующих в
полуреакциях;
– число электронов, участвующих в
полуреакциях;
![]() – стандартные
электродные потенциалы полуреакций.
– стандартные
электродные потенциалы полуреакций.
На рис. 10 представлена кривая титрования раствора щавелевой кислоты H2C2O4 раствором перманганата калия KMnO4 в кислой среде ([H+] = 1 моль/дм3).

Рис. 10. Кривая титрования 100,00 см3 раствора щавелевой
кислоты H2C2O4 с С1/z = 0,1000 моль/дм3 раствором перманганата
калия KMnO4
с С1/z
= 0,1000 моль/дм3
при
![]() =1
моль/дм3
=1
моль/дм3
Потенциал полуреакции MnO4- + 5e + 8H+ → Mn2+ + 4H2O зависит от рН среды, так как в полуреакции участвуют ионы водорода.
Константа равновесия редокс-реакции
Рассмотрим окислительно-восстановительное равновесие
aARed + bBOx aAOx + bBRed ,
для которого можно записать полуреакции
aAOx + ne aARed
bBOx + ne bBRed ,
где n – число электронов, участвующих в ОВ–реакции.
Если компоненты этой системы находятся в химическом равновесии, то электродные потенциалы полуреакций равны (ЕА = ЕВ). Выразим электродные потенциалы полуреакций из уравнения Нернста, тогда при равновесии

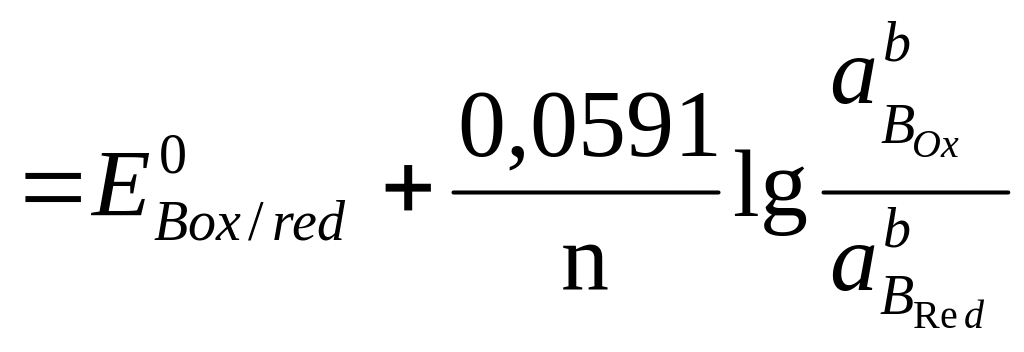 ,
,
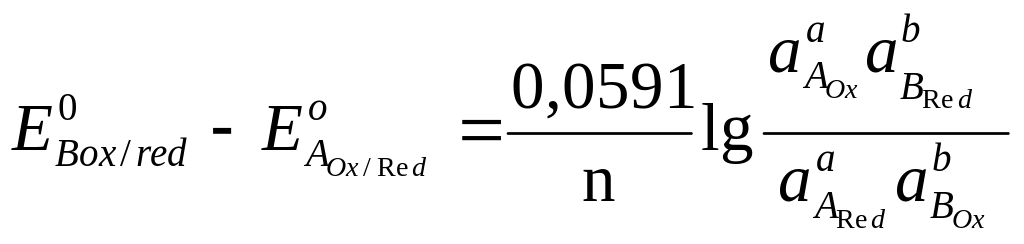 ,
,
![]()
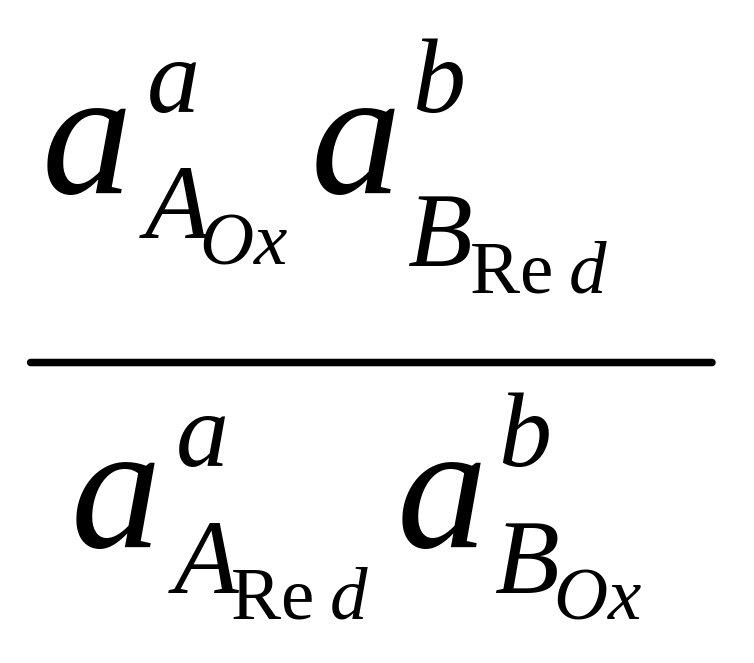 ,
,
![]() ,
,
![]() ,
(27)
,
(27)
где n – число электронов, участвующих в ОВ – реакции.
Для аналитических целей используются реакции, которые протекают на 99,9 %, то есть:
Кравн
=
![]() =
=
![]() .
.
В случае одноэлектронного перехода, когда n1 = n2 = 1, необходимая минимальная разность потенциалов для протекания реакции на 99,9 % следующая:
![]() =
0,354
В.
=
0,354
В.
В методах окислительно-восстановительного титрования в качестве титрантов – окислителей используют растворы брома, йода, солей церия (IV), перманганата калия (KMnO4), бихромата калия (K2Cr2O7), бромата (BrO3–), йодата (IO3–), в качестве титрантов – восстановителей применяют растворы солей Fe2+,Cr2+ , Sn2+ ,Ti3+, арсенит натрия (NaH2AsO3), оксалат – ион (C2O42-), аскорбиновую кислоту (C6H8O6).
Название окислительно-восстановительного метода титриметрического анализа зависит от названия реагента, используемого в качестве титранта. Классификация методов окислительно-восстановительного титрования
Перманганатометрия: титрант KMnO4.
Основное уравнение:
MnO4-
+8H+
+
5e = Mn2+
+ 4H2O,
![]() =
+1,51 В.
=
+1,51 В.
Дихроматометрия: титрант K2Cr2O7.
Основное уравнение:
Cr2O72-+14H++6e=2Cr3++7H2O,
![]() =
+1,33 В.
=
+1,33 В.
Иодометрия: титранты I2, Na2S2O3.
Основные
уравнения: I2
+2e
2I-,
![]() =
0,54 В
=
0,54 В
2S2O32-
–
2e
S4O62-,
![]() =
+0,09 В.
=
+0,09 В.
Броматометрия: титрант KBrO3.
Основное
уравнение: BrO3-
+6H+
+6e
= Br-
+3H2O,
![]() =
+1,44 В.
=
+1,44 В.
Нитритометрия: титрант NaNO2.
Основное уравнение для определения восстановителей:
NO2-
+ 1e
+ 2H+
= NO
+ H2O,
![]() =
+1,2 В.
=
+1,2 В.
Основное уравнение для определения окислителей:
NO2-
– 2e
+ H2O
= NO3-
+ 2H+,
![]() =
+0,96 В.
=
+0,96 В.
Основное уравнение взаимодействия с первичными аминами:
R-NH2 + NaNO2 + 2HCl [R-N+≡N]Cl- + 2H2O + NaCl
