
II уравнение Липпмана
Это уравнение показывает возможность определения емкости ДЭС, если известна зависимость поверхностного натяжения от потенциала.
Если ДЭС возникает вследствие перераспределения ионов, то для описания адсорбции ионов можно воспользоваться адсорбционным уравнением Гиббса. Если на поверхности адсорбируется катионы:
-d = Г+ dm+ (5.8)
Г+ - гиббсовская адсорбция потенциалоопределяющих катионов.
Поверхностная плотность заряда:
qs = F n Г+ (5.9)
Подставляем это выражение во 2 уравнение Липпмана:
-d = qs d = F n Г+ d
Сравниваем (5.8) и (5.9)
![]() , (5.10)
, (5.10)
где ao и ap - активности иона на поверхности и в растворе
Полученное уравнение называется уравнением электродного потенциала Нернста. Приведенный вывод указывает на связь между уравнениями Гиббса и Липпмана и показывает, что потенциалоопределяющие ионы, адсорбируясь, изменяют поверхностное натяжение. Это эквивалентно увеличению потенциала на межфазной границе.
СПЕЦИФИЧЕСКАЯ АДСОРБЦИЯ ИОНОВ
Штерн попытался учесть влияние специфической адсорбции ионов на электрический потенциал, обусловленный действием ковалентных сил дополнительно к электростатическим силам. Так как радиус действия сил такой адсорбции соизмерим с размером ионов, это дает основание учитывать ковалентные силы только для ионов, входящих в плотный слой Гельмгольца.
Плотность поверхностного заряда противоионов можно разделить на две части: плотность заряда qr, обусловленную слоем Гельмгольца и q диффузного слоя Гуи.
Общая поверхностная плотность заряда ДЭС:
-qS=qr+q (5.11)
Штерн предположил, что поверхность имеет определенное число адсорбционных центров, каждый из которых взаимодействует с одним противоионом.
Константа такой квазихимической реакции равна фактору Больцмана, в котором общий адсорбционный потенциал составляет сумму адсорбционных потенциалов электростатического и специфического взаимодействия:
![]() (5.12)
(5.12)
Fn - электростатический адсорбционный потенциал,
- потенциал специфической адсорбции.
Такой подход позволил Штерну получить уравнение для плотности поверхностного заряда в слое Гельмгольца:
![]() (5.13)
(5.13)
где q-предельно возможная плотность поверхностного заряда
xo -мольная доля противоионов в растворе.
При малых концентрациях электролита можно пренебречь единицей в знаменателе.
Теория Штерна позволяет рассчитать заряд в плотном и диффузном слоях.
Из теории Штерна следует, что лучше адсорбируются и ближе подходят к поверхности менее гидратированные ионы.
Специфическая адсорбция зависит от сродства адсорбируемых ионов к поверхности, их способности образовывать недиссоциирующие поверхностные соединения. Большими адсорбционными потенциалами обладают многозарядные ионы(Al3+ ,Th4+ и др.), органические ионы.
Хорошо адсорбирующиеся ионы в плотном слое способны создать избыточный заряд со знаком заряда противоионов .Это явление называется перезарядкой.(рис.5.2)
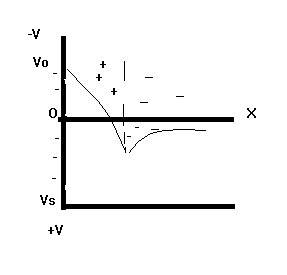
Рис.5.2 Изменение потенциала поверхности при ее перезарядке.
При перезарядке o и имеют разные знаки. Общую поверхностную плотность заряда можно представить в виде разности между величинами адсорбции потенциалоопределяющих ионов разного знака :
qs=F(Г+n+ - Г_n_) (5.14)
Если потенциалопределяющими ионами являются Н+ или ОН-, то
qs = F(ГН+ - ГОН-). Величины адсорбции можно экспериментально определить методом потенциометрического титрования поверхности.
На формирование ДЭС оказывает влияние природа поверхности конденсированной фазы, наличие в растворе определнных ионов, их концентрация. Рассмотрим пример.
Пример:1) водный раствор - поверхность AgI. При избытке в растворе Ag+(при добавлении AgNO3 ) эти ионы являются потенциалоопределяющими
В роли противоионов выступают NO3- , часть которых, находится в плотном слое, часть - в диффузном. Для такой системы можно написать формулу.
Формула ДЭС:[ AgI ]m n Ag+/(n - x)/NO3-/ x NO 3-
n-число потенциалопределяющих ионов
x-число противоионов в диффузной части
Если в систему с AgI добавить KNO3 , то потенциалопределяющими станут иодид - ионы:
[ AgI ]mnI-/(n – x)K+/x K+
2) В ДЭС на поверхности оксидов в растворе в качестве потенциалопределяющих ионов выступают Н+ или OH- (в зависимости от среды).
В результате преобладающей адсорбции одного и этих ионов поверхность оксида приобретает соответствующий знак заряда поверхности. Например: SiO2 обладает кислотными свойствами, поэтому его поверхность заряжена отрицательно:
[SiO2]mnOH-/(n - x)H+/x H+
FeO имеет основные свойства, его поверхность будет заряжена положительно:
[FeO]mnH+/(n-x)OH-/xOH-
Al2O3 - в кислой среде поверхность заряжена положительно, в щелочной - отрицательно.
В дисперсионных системах ДЭС возникает на поверхности частиц.
Частицу дисперсной фазы в гетерогенно-дисперсной системе вместе с ДЭС называют мицеллой.
Строение мицеллы можно показать той же формулой, что и строение ДЭС.
Внутренняя часть мицеллы - агрегат основного вещества, на поверхности агрегата-потенциалопределяющие ионы:
Агрегат + потенциалопределяющие ионы = ядро.
Ядро + противоионы = гранула.
Гранулу окружают противоионы диффузного слоя. Вся мицелла электронейтральна.
Мицеллы создают в дисперсионной системе соответствующую противоионам ионную среду - суспензионный эффект. Если противоионами являются Н+ и ОН- , то среда приобретает соответственно кислый или щелочной характер. При удалении частиц, например, фильтрацией , противоионы уходят вместе с ними в количествах, эквивалентных заряду частиц).Отсюда суспензионный эффект количественно можно определить как разность между концентрационными характеристиками противоионов в суспензии (дисперсионной системе) и в фильтрате. При определении кислотно-основных свойств дисперсной фазы суспензионный эффект рассчитывается по соотношению:
рНсэ = рНс - рНф, то есть по разности значений рН суспензии и фильтрата. Суспензионный эффект возрастает с увеличением концентрации дисперсной фазы -с увеличением ее дисперсности D, и уменьшается с повышением концентрации электролита (это связано с сжатием ДЭС).
