
- •Лекция 2 алканы
- •1. Понятие радикала и изомерия.
- •2. Номенклатура.
- •3. Способы получения.
- •4. Физические свойства и строение.
- •4.1. Физические свойства
- •4.2. Пространственное строение.
- •5. Химические свойства.
- •Факторы, определяющие реакционную способность
- •Статические
- •Динамические
- •Реакции замещения
- •1. Галогенирование.
- •1.4. Сульфохлорирование.
- •1.5. Нитрование.
- •Реакции расщепления
1.4. Сульфохлорирование.
Сульфохлорирование алканов при УФ-облучении, при комнатной температуре, протекает как цепной радикальный процесс (реакция Руффа). В качестве продуктов образуются хлорангидриды алкансульфокислот. Особенностью реакции является следующее: при наличии в молекуле углеводорода первичных, вторичных и третичных атомов углерода замещению не подвергаются атомы водорода при третичном атоме углерода:

1.5. Нитрование.
Атомы водорода в углеводородах могут быть замещены нитрогруппой -NO2. Соответствующая реакция называется реакцией нитрования. Протекает реакция также по цепному радикальному механизму. Нитрование алканов впервые провел М.И.Коновалов действием 10-20% азотной кислоты при 120-1500С. (реакция Коновалова, 1888г.):

Данная реакция протекает в жидкой (по Коновалову) при 100-1500С, и в газовой фазе при 250-5000С.
В реакцию жидкофазного нитрования вступают все углеводороды, однако продукты образуются с низкими выходами. Наиболее высокие выхода получаются для алканов, имеющих третичные углеродные атомы.
В газовой фазе реакция нитрования сопровождается окислением углеводородов и расщеплением углерод-углеродных связей. Поэтому в продуктах наряду с основными содержатся низкомолекулярные нитроалканы. Так, в случае нитрования пропана образуется 34% 1-нитропропана СН3-СН2-СН2-NO2, 32% 2-нитропропана СН3-СНNO2-СН3, 26% нитроэтана СН3-СН2-NO2, и 8% нитрометана СН3-NO2.
Реакции расщепления
1.4. Окисление алканов.
Определение: Углеродный атом соединенный с функциональной группой называется α-углеродным атомом, соответствующая связь называется α-связью. Атом, соединенный с α-углеродным атомом, называется β-атомом. Соответствующая связь называется β-связью.
Определение: Расщеплением β–связи называется гомолитический разрыв β-связи, приводящий к образованию двух радикалов, у которых неспаренные электроны несут α- и β-углеродные атомы исходной системы (молекула или радикал).
Наиболее распространенным процессом в химии алканов является их окисление. Как известно алканы составляют основные виды энергоносителей: бензин, дизельное топливо, авиационный керосин, топочный мазут. Сгорание алканов происходит до углекислого газа и воды. Но двуокись углерода и вода это конечные продукты реакции со сложным механизмом, протекающим через стадии образования радикалов и их распада.
В процессе окисления предельных углеводородов в качестве промежуточных продуктов образуются органические гидроперекиси:

Образующиеся в результате распада гидроперекиси радикалы вступают в две реакции.
1. Отрывают атомы водорода от других молекул алканов и дают спирты.
2. Распадаются по β-связи (β по отношению к атому, несущему радикал) с образованием альдегидов и кетонов.
Радикалы третичных гидроперекисей распадаются с образованием третичного спирта или кетона, по схеме:

Радикалы вторичных гидроперекисей, в зависимости от температуры распадаются по двум схемам. При низких температурах образуются, преимущественно, спирты и кетоны:

При высоких температурах преимущественно образуются спирты и альдегиды:
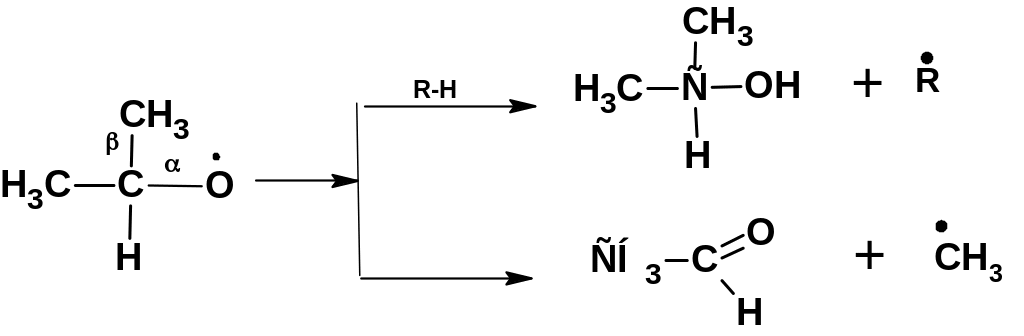
Радикалы первичных гидроперекисей распадаются с образованием первичного спирта альдегида и формальдегида:

1.6. Крекинг углеводородов при высокой температуре.
При температурах 300-7000С предельные углеводороды образуют сложную смесь предельных, непредельных и ароматических углеводородов. Основными процессами при крекинге являются дегидрогенизация и разрыв углеродной цепи. Эти процессы протекают через стадию свободных радикалов.
Свободные радикалы, образующиеся в процессе крекинга, способны к следующим превращениям:
1. Распад по β-связи между α- и β-углеродными атомами (β по отношению к атому, несущему радикал). В результате распада образуются алкан и алкен:
![]()
Например, распад молекулы бутана при крекинге:

При распаде радикала образуются все возможные сочетания алкана и алкена с числом углеродных атомов меньшим, чем число углеродных атомов в исходном радикале, но сумме дающее число углеродных атомов равное числу углеродных атомов в исходном радикале.
2. Диспропорционирование.
Окислительно-восстановительный процесс с участием двух радикалов. В ходе процесса расщепляются β-связи между α-углеродным атомом и соединенным с ним атомом водорода. При диспропорционировании образуются алкан и алкен с числом углеродных атомов равным числу углеродных атомов в исходных радикалах. Например:

3. Соединение (рекомбинация)
Процесс соединения двух радикалов, в ходе которого образуется алкан с числом углеродных атомов равным сумме числа углеродных атомов в исходных радикалах. Например:

