
- •Тема 4 . Вуглеводні.
- •2.Алгоритм дій , для створення напівструктурної формули за заданою номенклатурною назвою.
- •3.Алгоритм дій для створення ізомерів за заданою формулою.
- •Тема 4 Вуглеводні
- •Vі. Каучуки.
- •Тема4 Вуглеводні
- •Навчальна література:
- •Тема 4 Вуглеводні
- •Написати напівструктурні формули ізомерів
- •6. Розв’яжіть задачі:
Написати напівструктурні формули ізомерів
А)триметилбензену
Б) гексадієну
4. Задачі на використання загальної формули органічних речовин. Напишіть формули алкенів в молекулах яких є
А) 6 атомів Карбону; Б) 8 атомів Гідрогену
Серед переліку речовин виберіть формули алкінів
С2Н2,С4Н10, С4Н6,С4Н8,С8Н8,С3Н4
Написати рівняння реакцій , що лежать в основі поданої схеми Аl4С3→СН4→С2Н2→С2Н4→(-СН2-СН2-)n
Задачі на виведення формул за відомою масовою часткою елементів сполуки.
Визначте формулу сполуки , що містить Карбону40%,Оксигену53,33%, Гідрогену6,67% Густина парів сполуки за киснем1,875.
6. Розв’яжіть задачі:
І. визначте формулу алкену ,якщо 4,2 грами його приєднують 7,2 грами хлору.
ІІ. . визначте формулу алкіну ,якщо 5,4 грами його приєднують 4,48 літрів водню.
27. Тема 5 Оксигеновмісні органічні речовини.
Заняття 1. Спирти і феноли.
Навчальні питання:
1.Насичені одноатомні , багатоатомні спирти, феноли будова молекули, фізичні властивості , класифікація.
2. Ізомерія спиртів , номенклатурна назва.
3.Хімічні властивості спиртів. Якісна реакція на багатоатомні спирти.
4. Отруйність спиртів. Охорона довкілля від промислових відходів ,що містять фенол.
5. Застосування та добування спиртів.
Навчальна література:
Л-3 с. 100-116
Л-4 с. 100-109
Спирти – органічні речовини , до складу яких входить одна , або декілька гідроксогруп.(ОН)
Класифікація спиртів.
По кількості гідроксогруп: одноатомні, багатоатомні.
По вуглеводневому радикалу: насичені, ненасичені, ароматичні.
По будові радикала: первинні, вторинні, третинні.
С Н3-СН2-ОН СН3 – СН – СН3 СН3
первинний ОН СН3 – С – СН3
вторинний ОН
третинний
Порівняльна характеристика спиртів.
|
Одноатомні спирти |
Багатоатомні спирти |
Феноли |
визначення |
Спирти , що містять одну гідроксогрупу |
Спирти , що містять кілька гідроксогруп |
Спирти , що містять гідроксогрупу, що безпосередньо зв’язана з бензольним ядром. |
Функціональна група |
Одна гідроксогрупа - ОН |
Кілька гідроксогруп - ОН |
Бензольне ядро і гідроксогрупа |
Загальна формула |
СnН2n+1ОН |
СnН2n+2-х (ОН)х |
СnН2n-7ОН, n≥6 |
Гомологічний ряд |
СН3ОН – метанол,деревний спирт С2Н5ОН –етанол, винний спирт С3Н7ОН – пропанол С4Н9ОН – бутанол С5Н11ОН – пентанол С6Н13ОН – гексанол |
С Н2 – ОН етиленгліколь, СН2 – ОН (етан-1,2-диол)
С Н2 – ОН гліцерин С Н – ОН ( пропан -1,2,3-триол) СН2 – ОН |
ОН С6Н5ОН
- фенол
|
Систематична номенклатурна назва |
Нумерація починається з того краю , де ближче гідроксогрупа, закінчення –ол, між коренем та закінченням номер карбону біля якого розміщена гідроксогрупа. С1Н3 – С2Н – С3Н2 – С4Н – С5Н3 ОН СН3 4-метилпентан-2-ол |
Нумерація починається з того краю , де ближче гідроксогрупа, суфікс вказує кількість гідроксогруп, закінчення –ол, між коренем та закінченням номера карбону біля яких розміщені гідроксогрупи. С1Н3 – С2Н – С3Н2 – С4Н – С5Н3 ОН ОН СН3 4-метилпентан-1,2-диол |
ОН СН3 2,5-диметилфенол
СН3 Нумерація починається від гідроксогрупи, закінчення фенол. |
Ізомерія |
1. карбонового ланцюга 2. положення гідроксогрупи 3.міжкласова ізомерія з простими ефірами (етерами) |
1. карбонового ланцюга 2. положення гідроксогрупи |
1.Положення замісника 2. між класова з ароматичними спиртами. |
Будова молекули. |
Оксисен більш електронегативний, тому до нього відбувається перетяг електронної пари від Н. Тому на Оксигені виникає заряд «σ-», а на Гідрогені виникає заряд«σ+»,атом Гідрогену стає більш рухливий, може легше відриватись ніж у вуглеводнів, заміщуючись на атом активного металу, тому спирти у хімічних реакціях проявляють дуже слабкі кислотні властивості.
Між двома молекулами спиртів виникає водневий зв'язок , тому спирти рідини та добре розчинні у воді. |
Оскільки в молекулах є кілька гідроксогруп , то властивості багатоатомних спиртів схожі на властивості одноатомних спиртів , але перетяг електронної хмари у гідроксогрупах значно сильніший , внаслідок чого збільшуються кислотні властивості цих речовин і вони , на відміну одноатомних спиртів можуть реагувати навіть з нерозчинними основами, та збільшується сила водневих зв’язків , між молекулами , тому збільшується густина сполук. |
Бензольне ядро більш електронегативне ніж Оксиген, тому електронна густина зміщується до бензольного ядра і розподіляється в положеннях 2,4,6 де виникають часткові негативні заряди σ- внаслідок цього атом Гідрогену стає більш рухливим і може легко відриватись, вступаючи у реакції заміщення. У гідроксогрупі перетяг електронної густини значно сильніше ніж у звичайних спиртах, тому фенол проявляє сильніші кислотні властивості ніж одно- чи багатоатомні спирти(змінює колір індикаторів). Оскільки ОН група більш полярна і є велике бензольне ядро , то фенол є твердою речовиною частково розчинним у воді. |
Застосування спиртів |
Метанол: ЯД!розчинник, для добування формальдегіду, барвників, фотореагентів, ліків. Етанол: добувають синтетичний каучук, діетиловий ефір, барвників, оцтової кислоти, бездимного пороху, пластмас; використовують як паливо, як розчинник для одеколонів, лаків, ліків. |
Етиленгліколь: ЯД! Виготовлення антифризу та синтетичного волокна лавсану Гліцерин: Виготовлення синтетичних смол, вибухових речовин, ліків, косметики, мазей , кремів; у шкіряному та текстильному виробництві для пом’якшення шкіри та тканин |
Фенол: ЯД!Виробництво лікарських речовин, фенолформальдегідних смол, фотографічних проявників,барвників; сильний антисептик і антиоксидант. Вплив на навколишне середовище: води коксохімічних підприємств не достатньо сильно очищуються, тому фенол потрапляє в навколишне середовище , що зумовлює загибель флори і фауни. |
Добування |
Метанол: 1.із синтез газу СО+2Н2→СН3ОН 2. суха перегонка деревини Етанол: 1.бродіння глюкози С6Н12О6→2С2Н5ОН +2СО2 2.гідратація етилену(промисловий спосіб) С2Н4 +Н2О→С2Н5ОН 3.із галогенопохідних алканів СН3СІ +NaOH водний розчин→CH3OH +NaCl 4.Відновлення альдегідів. CH3CHO +H2 →CH3CH2OH |
1.із хлоропохідних алканів С Н2-СІ + 2NaOH→CH2OH СН2-СІ CH2OH + 2NaCl 2.гідроліз жирів 3.із продуктів крекінгу нафти 1)CH2=CH-CH3+ O2→CH2CHO+ H2O
2 )CH2=CH-CH2OH+H2O→CH2-CH-CH2 OH OH OH
|
1.із камяновугільної смоли 2.із бензену 1)С6Н6 + СІ2→ С6Н5СІ +НСІ 2) С6Н5СІ +Н2О→ С6Н5ОН +НСІ |
Хімічні властивості |
1.окислення А)горіння С2Н5ОН +3О2→2СО2+3Н2О Б) часткове окиснення С2Н5ОН +[ О]→СН3СНО СН3СНО +[ О]→СН3СООН Де [ О]- це KMnO4, H2O2, K2Cr2O7, O2 2.кислотні властивості спиртів: А) взаємодія з активними металами C2H5OH+2Na→C2H5ONa + H2O Б) взаємодія з лугами при нагрівання і в присутності C2H5OH + NaOH →C2H5ONa + H2O В) взаємодія з кислотами (естерифікація) C2H5OH +HOSO2OH →C2H5OSO3H +H2O C2H5OH +HOOCCH3 →C2H5OOCCH3 +H2O Г) взаємодія з спиртами ( мІжмолекулярна дегідратація) C2H5OH + HOC2H5→C2H5OC2H5 +H2O 4.Реакції з розривом С – О звязку: А)взаємодія з галогеноводнями C2H5OH +HBr→C2H5Br + H2O Б) внутрішньомолекулярна дегідратація CH3 – CH – CH – CH3 →CH3 – CH=CH – CH3 +H2O 5.дегідрування(каталізатор мідь 200 0С) C2H5OH →CH3CHO +H2 |
Взаємодія з активними металами С Н2 – ОН +2Na→ СН2 – ОNa СН2 – ОН СН2 – ОNa +H2 Взаємодія з основами СН2 – ОН СН2 – ОNa СН2 – ОН+NaOH → СН2 – ОNa +H2O Якісна реакція на багатоатомні спирти – взаємодія з купрум(ІІ) гідроксидом CuSO4+2NaOH→Cu(OH)2 +Na2SO4 СН2–ОН +Сu(OH)2 → H2O + СН2–ОН СН2–О HO-CH2 СН2–ОН Cu O- CH2 Етилгліконат міді Взаємодія з кислотами С Н2–ОН + 2НNO3→ СН2–ОNO2 +2H2O СН2–ОН СН2–ОNO2 |
1.Впливає на індикатори С6Н5ОН↔ С6Н5О-+Н+ 2.взаємодіє з натрієм 2С6Н5OH +2Na→ 2С6Н5ONa +H2 3.взаємодіє з основами С6Н5OH +NaOH→ С6Н5ONa+H2O 4.Взаємодіє з бромною водою( знебарвлює бромну воду) – якісна реакція на феноли. С6Н5OH +3Br2→ С6Н2Br3OH +3HBr 5 С
6.горять 2C6H5OH +9O2→12CO2+6H2O |
Самостійна робота студентів
Назвіть за міжнародною систематичною номенклатурою
ОН С – С – С ОН ОН ОН ОН
С
 – С – С – С – С – С С – С – С –
С – С СН3
СН3
– С – С – С – С – С С – С – С –
С – С СН3
СН3
С С С С2Н5
СІ
2.напишіть напівструктурні формули спиртів:
А) 2,3-дибром – 3-етилпент-1,4-диол
Б) 2,4,6- трихлорофенол
В) 3,5-диметилгекс-1-ол
Г) 2,3,3,4-тетраметилгепт-1,4,5-триол
3. напишіть напівструктурні формули трьох можливих ізомерів А) диметилфенолу; Б) гексантриолу.
4. здійсніть перетворення: СН4→СН3СІ→С2Н6→С2Н4→С2Н5ОН→С2Н5СІ→С2Н5ОН→С2Н5ОС2Н5
5. розв’яжіть задачі
А)Визначте формулу сполуки , що містить Натрій 32,4%, Сульфур 22,5%, Оксиген 45,1%. Густина парів сполуки за воднем 71.
Б) Визначте формулу арену , якщо 7,8 грами його приєднують 21,3 грами хлору
28. Тема 5. Оксигеновмісні органічні сполуки.
Заняття 2. Розв’язування задач на виведення формул речовин по продуктам горіння.
Навчальні питання:
1.систематична номенклатурна назва спиртів
2. ізомерія спиртів.
3. генетичний зв’язок між класами органічних сполук.
4. задачі на виведення формул по продуктам горіння речовин.
Навчальна література Л-1 с. 84,86
Вивчення нової теми. задача на виведення формул по продуктам горіння речовини.
Визначте формулу речовини , якщо при горінні 2,3 грам її утворилось 4,4 грами вуглекислого газу і 2,7 грам води. густина за азотом 1,64
Дано
m (речовини)=2,3г 1.визначимо, чи входив до складу речовини Оксиген. Для цього знайдемо маси Карбону і Гідрогену
m(СО2)=4,4г ν(СО2)=m(СО2)/Μ(СО2)=4,4/44 = 0,1 моль
m(Н2О)=2,7г ν(СО2) = ν(С) = 0,1 моль
D(N2 ) =1,64 m(С)=νх М(С)=0,1х12=1,2(грам)
формула - ? ν(Н2О)=m(Н2О)/М(Н2О)=2,7/18=0,15 моль
ν(Н)=2 х ν(Н2О)=2 х 0,15 = 0,3 моль
m(Н)=νх М(Н)=0,3 х 1= 0,3 (грам)
2.визначимо загальну масу Карбону і Оксигену m(С) +m(Н) = 1,2+0,3=1,5(грам).
Оскільки ця сума менша ніж маса речовини в умові, то до складу речовини входить Оксисен. Визначимо його масу.
m(О)= 2,3 – 1,5=0,8 (грам)
3.визначимо формулу найпростішої молекули. Для цього визначимо відношення кількості речовини кожного атома.
ν (С):ν(Н):ν(О) = m(С) : m(Н) : m(О) 1,2 : 0,3 : 0,8 0,1 : 0,3 : 0,05 =2 : 6 : 1
М(С) М(Н) М(О) 12 1 16 0,05 0,05 0,05
Отже, найпростіша формула шуканої речовини С2Н6О. визначимо справжню формулу .для цього знайдемо молярну масу найпростішої формули (за періодичною системою), потім знайдемо масу справжньої формули використовуючи відносну густину, і порівняємо ці числа.
М(С2Н6О) =12х2 + 6+16 =46 (г/моль)
М(справжньої) = D(N2) х М(N2)=1,64 х 28 = 46 (г/моль)
Отже ,маси однакові , тому найпростіша формула і є справжньою Відповідь: С2Н6О
Самостійна робота студентів
1.назвіть речовини за міжнародною систематичною номенклатурою.
ОН С ОН С2Н5 С2Н5 С2Н5 СН3
С
 – С – С – С – С – С С – С – С –
С – С СН3
СІ
– С – С – С – С – С С – С – С –
С – С СН3
СІ
С С2Н5 ОН ОН С СН3
за назвою напишіть напівструктурну формулу речовини.
А) 2,5-диметил -3-хлорогекс-1,2,3-триол ; Б) 1,3,4-триметилфенол
В) 2-метилбутан-2-ол ; Г) 3-етил -2,3,4-трибромопент-1,4-диол; Д) 1,4-дибромфенол
3. напишіть напівструктурні формули трьох можливих ізомерів
А)гексантриол Б)диметилфенолу В) пентанолу
4. виберіть формулу спирту СН3ОН, СН2О, С6Н12О , С3Н5(ОН)3, С6Н5ОН, С2Н5СООН; напишіть формулу
А) трьох атомного сприту , що містить 5 атомів Карбону Б) одноатомного спирту в якому є шість атомів Карбону
5.Здійсніть перетворення
С2Н4→С2Н5СІ→С2Н5ОН→С2Н4→С2Н2→С6Н6→С6Н5СІ→С6Н5ОН→С6Н5ОNа
6.задача: Визначте об’єм газу , що виділиться при взаємодії 40 грам натрію з етанолом.
7.Визначте формулу речовини при горінні 18,8 грам якої виділилось 26,88 літрів вуглекислого газу і 10,8 грам води. Густина пари даної речовини за киснем 2,94.
29.Тема: Оксигеновмісні органічні сполуки
Заняття 3 Альдегіди.
Вид заняття: Групове заняття 14
Навчальні питання:
Альдегіди, склад, будова молекули, фізичні властивості.
Ізомерія та номенклатурні назви альдегідів.
Хімічні властивості альдегідів, якісні реакції на карбонільну групу.
Добування та застосування альдегідів
Навчально-методичне забезпечення:
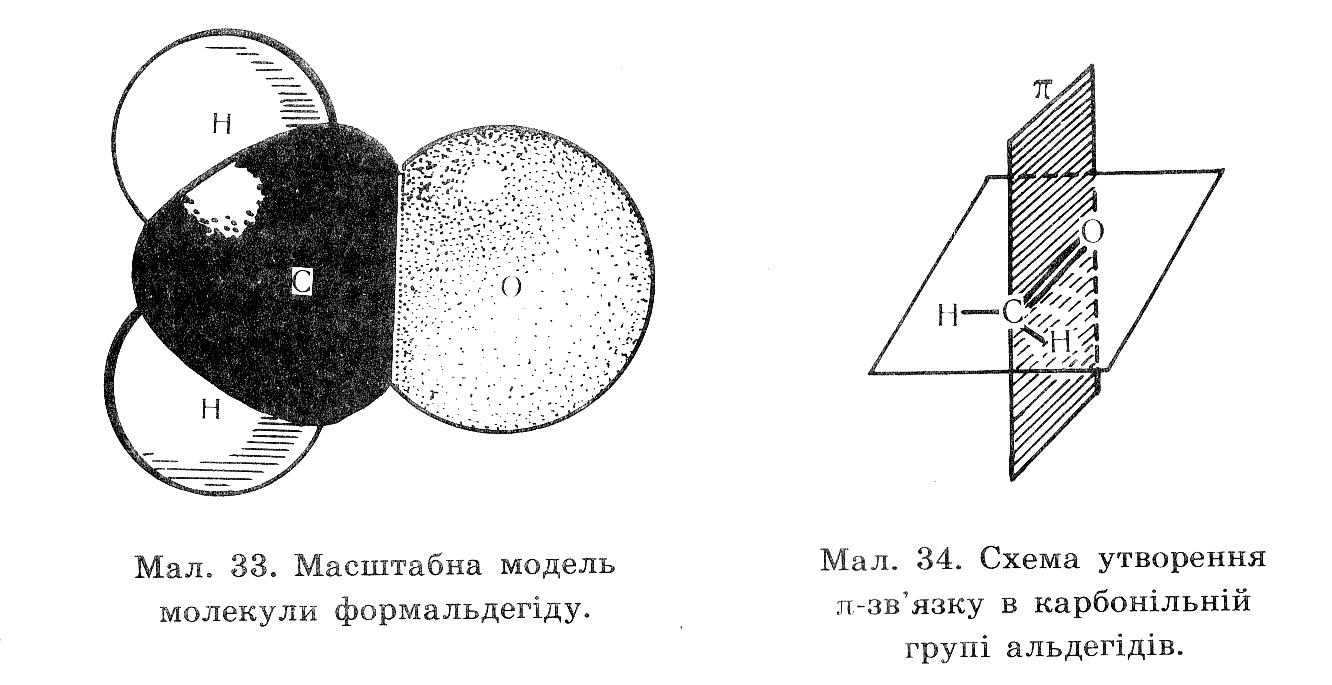
Таблиця Будова молекули етаналю
Навчальна література:
Л-3 с. 121-128
Л-4 с.116-117
ІІІ. Вивчення нового матеріалу.
Визначення |
Функціо- нальні групи |
Загальна формула |
Номенк- латурна назва |
Види ізомерії |
Будова |
Застосування |
Добування |
Фізичні і Хімічні властивості |
Альдегіди – це органічні сполуки , що містять карбоніл кар групу що стоїть на початку ланцюга. |
С =О Н Карбоні льна група |
R С =О Н
СnН2nО |
Нумерація Ланцюга починається від карбонільна групи ,закінчення –аль
|
1.Структурна ізомерія 2.міжкласова ізомерія з етерами (простими ефірами) |
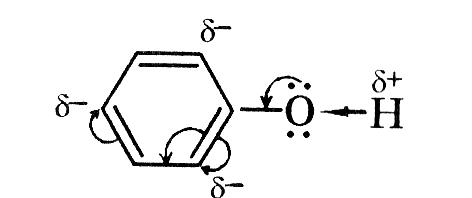
Карбон в стані sp2-гібридизації.до атома Оксигену , як до біль електронегативного атома перетягується електронна густина і на ньому виникає частковий негативний заряд , а позитивний заряд виникає на атомі Карбону карбонільної групи. |
Метаналь( формальдегід)-40% розчин у воді називається формаліном і використовується для зберігання біопрепаратів. Виробляютьполіформальдегід,фенолформальдегід-це полімери, барвники, синтетичного каучуку, фармацевтичних препаратів,вибухових речовин. Етаналь:добування оцтової кислоти,пластмас,ліків,фенопластів |
1.окиснення спиртів CH3OH+CuO→ CH2O+Cu+H2O 2.окиснення метану CH4+O2→CH2O +H2O 3.реакція Кучерова C2H2+H2O→ CH3HO 4.окиснення етену. C2H4+[O]→ CH3CHO |
1.відновлення воднем до спирту CH3CHO+H2→C2H5OH 2.полімеризація(утворюється поліформальдегід з якого виготовляють деталі , що замінюють металічні) nCH2O→(-CH2-O-)n 3.Поліконденсація – послідовне зєднання маленьких молекул у великі(полімери) , під час якого утворюється побічна низькомолекулярна сполука.
n
фенол формальдегідна пластмаса це термостійка пластмаса яку використовують як ізолятор, термозахисний та антикорозійний матеріал. Горіння 2CH3CHO+5O2→4CO2+4H2O Часткове окиснення Реакція срібного дзеркала – якісна реакція на альдегіди. CH3CHO+Ag2O→CH3COOH+2Ag↓ Реакція з гідроксидом міді ри нагріванні – утворюється осад морквяного кольору – якісна реакція на альдегіди. CH3CHO+Cu(OH)2→CH3COOH+Cu2O↓+H2O |
Наслідки з будови
Альдегіди погано розчинні у воді і чим більший ланцюг , тим гірша розчинність.
Альдегіди не утворюють водневих зв’язків, тому метаналь – газ.
класифікація |
В залежності від радикалу спирти є насичені , ненасичені , ароматичні. |



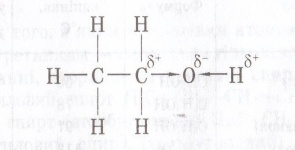
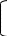
 .взаємодіє
з формальдегідом(поліконденсація)
.взаємодіє
з формальдегідом(поліконденсація) 6Н5OH
+CH2O→
OH
6Н5OH
+CH2O→
OH
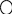 --
--CH2-
+H2O
--
--CH2-
+H2O
 C6H5OH+nCH2O+…→(
- CH2 –)n+H2O
C6H5OH+nCH2O+…→(
- CH2 –)n+H2O