
- •Результирующий механический момент многоэлектронного атома.
- •Эффект Зеемана
- •Электронный парамагнитный резонанс
- •Связь в молекулах.
- •Гибридизация
- •Молекулярные спектры
- •Вращательная энергия молекул
- •Комбинационное рассеяние света.(Эффект Рамона).
- •Поглощение света
- •Нелинейная оптика
- •Физика твёрдого тела
- •Кристаллическая структура твёрдых тел
- •Энергия связи кристаллической решётки.
- •Индексы Миллера
Гибридизация
Если химические ковалентные связи появляются при атомах с валентными S и P электронами, то часто эти химические связи образуются так, что эти электроны S и P в связях совсем не различны. Например углерод в молекуле CH4. При образовании химической связи электроны S и P теряют неповторимость.
Лепестки не отличаются друг от друга, лепестки имеют заряд, т.к. состоят из электрического заряда. И т.к. они имеют заряд, то отталкиваются, значит они максимально удаляются и их энергия становится минимальной. Такие ковалентные химические связи с формой вытянутых направленных лепестков. Сам процесс образования гибридных связей – гибридизация. Каждый лепесток можно представить как линейную комбинацию атомных волновых функций атома водорода. φ2,0,0; φ2,1,1; φ2,1,0; φ2,1,-1; l=0,1. Принято обозначать совокупность этих комбинаций как sp3.
Молекулярные спектры
В молекуле есть движения:
1) взаимодействие и движение е друг с другом и с ядрами атомов;
2) колебательное движение в атоме;
3) вращение молекулы вдоль произвольных осей.
Чтоб описать каждый тип движения надо вводить волновую функцию. Волновая функция для описания молекулы в целом имеет вид: φ= φэ φк φв. Если взять уравнение Шредингера, то уравнение φ= φэ φк φв на 3 уравнения. Находим волновые функции и собственные значения: Еэ(энергия движения в молекуле); Ек(энергия колебательного движения атомов); Ев(энергия вращательного движения молекулы). Полная энергия молекулы: Е= Еэ+ Ек+Ев. Рассмотрим Еэ, Ек и Ев молекулы азота(N2). Зависимость Еэ от межъядерного расстояния.
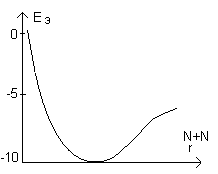
Азот:
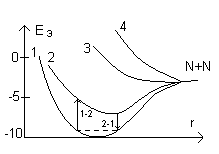
Это 4 разных решения диф. уравнения. Это результат квантово-механических вычислений:
1![]() )
При сближенииN
и N
валентные электроны спины антипараллельные.
)
При сближенииN
и N
валентные электроны спины антипараллельные.
N=[He]2s22p3
2) В возбуждённом
состоянии:
![]()
3) Есть только 1 пара
↑↓ спинов:
![]()
4) Все пары имеют
спины ↑↑:
![]()
Состояния 3 и 4 – это действует отталкивание, состояние неустойчивое, распад молекулы.
Облучив молекулу светом или бомбардируя заряженными ионами, она станет возбуждённой (1-2), при обратном переходе излучит квант света.
Принцип Франка-Кондона(Комптона), определяет электронные переходы в молекулах: электронные переходы в молекулах происходят при почти неподвижных ядрах(т.е. так быстро то ядра не успевают поменять положения). Минимальный потенциал кривых 1 и 2 на рисунке не совпадают когда молекула переходит в 2, то это соответствует не только электронному и колебательному возбуждению. Когда молекула сталкивается с другими, она переходит в нижнее колебательное состояние, от сюда следует, количество поглощённой ей энергии разное, значит различны частицы и спектры при поглощение света. Электронный переход в молекулах подчиняется правилу отбора : Δλ=0;±1(если λ 0); Δλ=±1(если λ=0). λ – сумма проекций орбитальных моментов всех валентных е молекул на её ось симметрии. λ = ΣNi=1λi (N – число е в молекуле; λi – проекция момента импульса на ось симметрии). Из-за теплового хаотического движения, молекулы испытывают колебательные движения. Для двухатомных молекул (О2, Н2).
Ev=(υ+1/2)hν+θ(ν;υ). Ev – энергия колебательного движения молекулы; υ – колебательное число, υ=0,1,2 …; ν – частота колебаний; θ – поправка, она мала и зависит от амплитуды колебания, при возрастании υ, θ тоже растёт. Θ появляется т.к. колебания негармоничные. Если сравнить с гармоничным осцеляратором:

Возвращающая сила равна F=-(kx2)/2; U=kx2/2.
Видно, что при малых смещениях, потенциальная энергия почти одинакова, а при больших очень отличается, значит F=-kx2+gx2-Ђx3+…
Если υ=0, то E0=hν/2 – нулевая энергия колебательного движения. Когда температура 0°К, атомы молекул всё равно участвуют в колебательном движении.
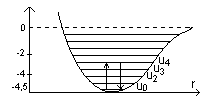
Колебательное состояние обозначено n-линиями, каждая из них соответствует разному квантовому числу U. Правило отбора: (определяют переходы между колебательными состояниями) ΔU=±1. Преходы происходят из-за столкновения атомов и облучения светом. С ростом ΔU вероятность перехода быстро падает. В мазерах применяют в инфракрасном спектре, то что излучается свет при переходе.
