
- •Индивидуальное задание
- •5.2 Твердые растворы замещения…………………………...………………….45
- •1 Область применения тугоплавких неметаллических материалов
- •1.1 Характеристика изделий, их применение
- •1 Склад глины ч-2 на шамот Склад глины ч-3 на связку .2 Технологическая схема производства тугоплавких неметаллических материалов
- •2 Морфотропная область существования перовскитовой системы цтс
- •2.1 Система цирконат-титанат свинца
- •0,98[(Pb1_у_zSryBaz)(ZrxTix_1)]o3-0,02BiNi1/3Wl/3o3
- •3.1 Ферриты как фазы переменного состава
- •3.3 Гравиметрический метод
- •4 Способы получения монокристаллов
- •4.1 Моно и поликристаллические твердые тела
- •4.2 Рост кристаллов
- •5 Механизмы взаимодействия между твердыми веществами
- •5.2 Твердые растворы замещения
- •6 Решение задачи по расчету шихты, методом совместного осаждения
3.1 Ферриты как фазы переменного состава
Рассматривая
ферриты как фазы переменного состава,
следует иметь в виду не только вероятность
катионных замещений, но и возможность
изменения атомного соотношения
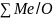 в пределах существования данной
кристаллической структуры для
феррита Me2+xMe3+yFe2+zFe3+3-x-у-zO4
условие электронейтральности
в пределах существования данной
кристаллической структуры для
феррита Me2+xMe3+yFe2+zFe3+3-x-у-zO4
условие электронейтральности
2х + 3у + 2z +3(3-x-y-z) =8
показывает,
что идеальное соотношение
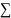 Ме/О
= 3/4 может быть реализовано только при
Ме2+/
Ме
3+
=1/2.
Ме/О
= 3/4 может быть реализовано только при
Ме2+/
Ме
3+
=1/2.
Однако в реальных кристаллических структурах эти соотношения практически не реализуются. Более того, получение оптимальных структурно-чувствительных свойств, как правило, возможно лишь при максимальных (в пределах существования однофазной шпинели) отклонениях от соотношения Ме/О = 3/4.
В
общем случае (
Ме/О
 3/4)
формулу феррита целесообразно представить
в виде:
3/4)
формулу феррита целесообразно представить
в виде:
Me2+х Me3+у Fe2+z Fe3+ 3-х-у-zO4 y,
где у - коэффициент, учитывающий изменения атомного соотношения Ме/О.
Из условия электронейтральности 2х + 3у + 2z + 3(3 - х - у - z) = 8 + 2у
следует, что у= 1/2(1 -х- z).
Причиной изменения концентрации кислорода в конденсированной фазе является взаимодействие с газовой фазой, определяемое совокупностью термодинамических и кинетических параметров: температуры, давления кислорода, продолжительности взаимодействия и т.д.
В
условиях равновесия химический3 потенциал
кислорода в газовой фазе
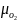 равен химическому потенциалу кислорода,
входящему в состав феррита. При
фиксированной температуре для данного
феррита существует только одно значение
парциального давления кислорода, которое
отвечает равновесному
равен химическому потенциалу кислорода,
входящему в состав феррита. При
фиксированной температуре для данного
феррита существует только одно значение
парциального давления кислорода, которое
отвечает равновесному
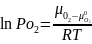
где
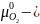 химический
потенциал чистого кислорода; РО2=105
Па.
химический
потенциал чистого кислорода; РО2=105
Па.
Для замкнутой системы феррит-газовая фаза, когда парциальное давление кислорода в газовой фазе станет меньше равновесного, характерно неустойчивое состояние феррита, сопровождающееся потерей кислорода шпинелью вплоть до выравнивания химических потенциалов кислорода в конденсированной и газовых фазах.
По мере удаления кислорода из феррита в решетке последнего создается избыток металлических атомов ( Ме/О > 3/4), что может приводить в пределах стабильности шпинельной структуры к образованию вакансий в анионной подрешетке. Дальнейшее удаление кислорода сопровождается выделением новой, чаще всего вюститной фазы.
Когда давление кислорода в окружающей среде превышает равновесное, атомы кислорода из газовой фазы переходят в решетку шпинели Mex 2+Meу3+Fe3-x-уO4+у. Адсорбируясь на поверхности кристалла, они оттягивают недостающие им электроны от катионов и превращаются в ионы кислорода, достраивая кубическую решетку. В металлических подрешетках должны образовываться вакансии, общее число которых равно трем на каждые четыре иона кислорода, дополнительно встроенные в решетку. Этот процесс также ограничен предельной концентрацией дефектов, выше которой структура шпинели становится нестабильной и разрушается с образованием гематитовой фазы. Накопление вакансий, вызванное растворением в шпинели избыточного кислорода, снижает величину парциальной энтальпии кислорода в феррите, т.е. ослабляет энергию связи с металлами.
Таким
образом, величина
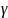 в формуле Meх2+Mey3+Fe3_x_уO4
Y
не только учитывает изменение атомного
соотношения
Me/O,
но и характеризует концентрацию
доминирующих точечных дефектов,
оказывающих существенное влияние на
магнитные и электрические свойства
ферритов.
в формуле Meх2+Mey3+Fe3_x_уO4
Y
не только учитывает изменение атомного
соотношения
Me/O,
но и характеризует концентрацию
доминирующих точечных дефектов,
оказывающих существенное влияние на
магнитные и электрические свойства
ферритов.
3.2 Термодинамические условия
Равновесные термодинамические условия образования однофазной шпинельной структуры характеризуются диаграммами состояния, связывающими состав ферритов, температуру Т и парциальное давление кислорода Ро2. Изучению Ро2-Т-фазовых диаграмм марганец-цинковых ферритов посвящено значительное количество работ.
При исследовании высокотемпературных гетерогенных равновесий методы определения фазового равновесия могут быть разделены на два общих класса: статический и динамический. В системах, где равновесие достигается быстро, динамический метод является наиболее приемлемым. Ряд авторов считают гравиметрию наиболее удобным методом исследования равновесия между ферритами и кислородом. Точность результатов ограничена главным образом химическим и рентгенофазовым анализами, используемыми для определения изучаемых состояний. Рассмотрим фазовые диаграммы Мп—Zn-ферритов, построенные с использованием этих методов.
Одна из первых Ро2-Т-фазовых диаграмм (рис. 4.1) приведена Бланком на основании данных статического метода. Методика экспериментов включала в себя спекание образцов в интервале температур 1000-1400°С при парциальном давлении кислорода от 10-3 до 105 Па и закалку в воду. Образцы анализировали на содержание Fe2+, a на шлифах проводили петрографические исследования фазового состава. Изоконцентраты кислорода, соответствующие определенной степени окисления шпинели, выражены через концентрацию Fe2+. Их наклон плавно изменяется по мере удаления от нижней границы шпинельного поля. Бланк приводит границы области гомогенности Mn-Zn-феррита.
На основании данных по изучению двух Mn-Zn-ферритов и двух Ni-Zi-ферритов автором было сделано предположение об универсальном характере фазовой диаграммы.
Для сохранения постоянного содержания кислорода в феррите термодинамические параметры должны изменяться по изоконцентрате, проходящей через фигуративную точку (Ро2,Т) первоначального равновесия. Степень окисления и пределы области гомогенности изменяются при изменении катионного состава ферритов. Однако геометрическое положение изоконцентрат, проходящих через данную фигуративную точку (PО2,T), остается неизменным для ферритов любого состава.
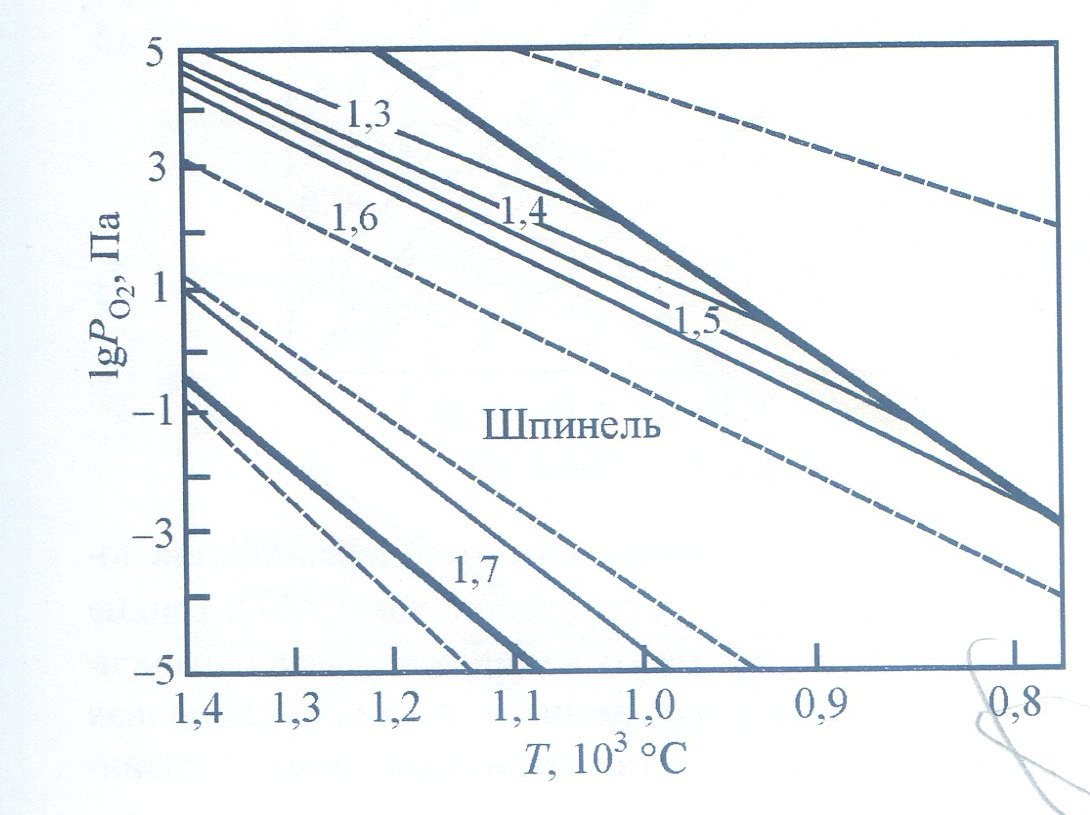
Рис. 3.1 - Фазовая диаграмма Mn-Zn-феррита с исходным составом, мол. %: 54,6 Fe2O3; 29,3 МnО; 16,1 ZnO по Бланку: сплошные и штриховые прямые - линии равного состава (штриховые взяты из универсальной диаграммы); жирные линии — пределы фазовой области
Маклен подтвердил гипотезу Бланка об универсальном характере фазовой диаграммы для ферритов, содержащих более 50 мол. % Fe2O3.
Слик дополнил фазовую диаграмму Бланка данными по изучению двухфазной области, используя гравиметрию (рис.4.2). Величина кислородной нестехиометрии определена относительно произвольно выбранных эталонных условий (1042°С и 0,12 Па). В однофазной области изоконцентраты параллельны между собой, что не наблюдалось
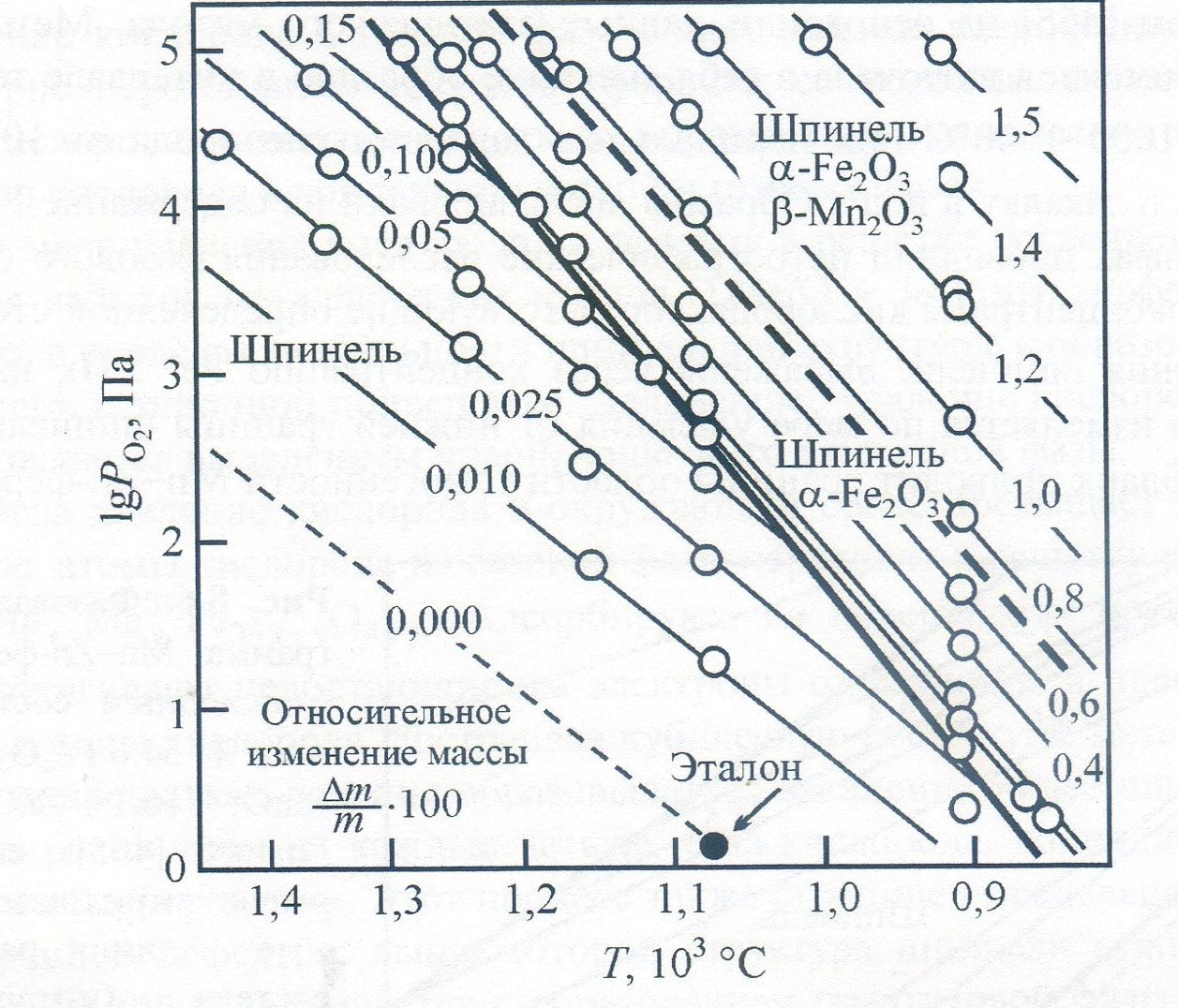
Рисунок 3.2 - Равновесные изменения массы в зависимости от содержания кислорода для феррита (Fe2O3)54,9 (MnO)26,8 (ZnO)18,3 согласно Слику. тонкие сплошные линии - изоконцентраты постоянного изменения массы относительно эталонных условий; толстая сплошная линия — высококислородная граница области существования шпинели; толстая штриховая линия - граница раздела двух и трехфазной областей.
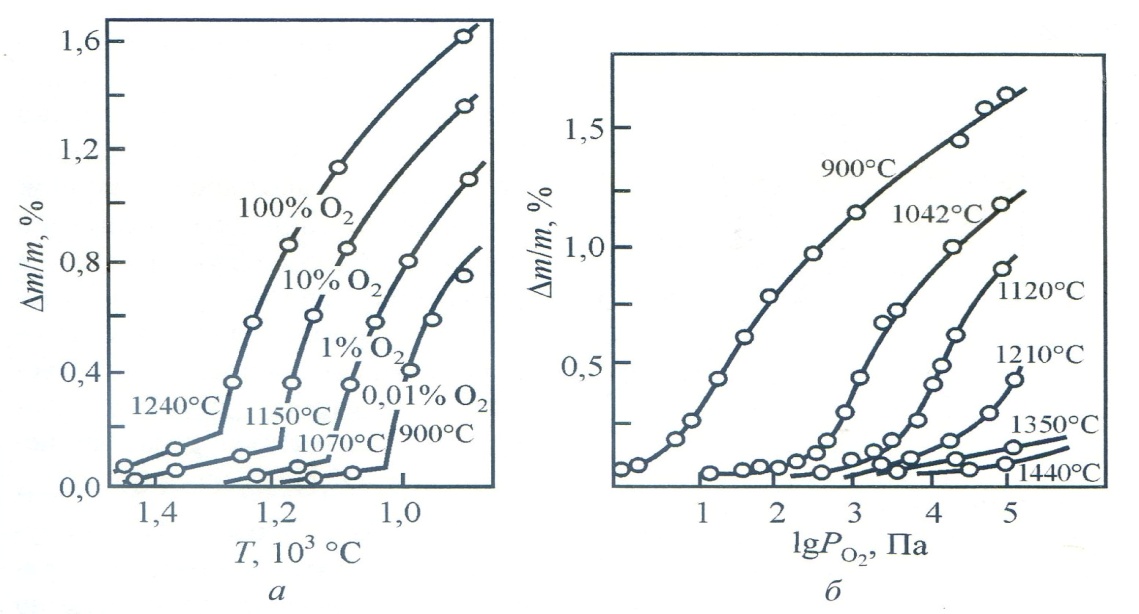
Рисунок 3.3 - Равновесные изобарные изменения массы феррита в зависимости от температуры (а) и изотермические в зависимости от РО2 (б) Бланком. В двухфазной области изоконцентраты почти параллельны фазовой границе шпинель-гематит. Положение высококислородной границы шпинельного поля бьшо определено по положению перегибов на изобарных и изотермических кривых изменения массы при движении со стороны высоких температур и низких парциальных давлений кислорода (рис. 4.3). При охлаждении из однофазной области Слик впервые наблюдал наличие метастабильной области существования шпинели.
На рисунке 3.4, представлена фазовая диаграмма Mn-Zn-феррита по Ю.Д. Третьякову. Равновесное давление кислорода на нижней границе было установлено методом ЭДС в предположении, что состав образцов

Рис. 3.4 - Зависимость lnРо2 (1/T) феррита Mno,518 Zno,41 l Fe2,07104+у при различных значениях у (указаны на кривых): сплошные толстые линии — границы однофазной шпинели; штриховая линия - давление кислорода, возникающего при диссоциации СО2
на
этой границе точно соответствует
стехиометрическому. Положение
изоконцентрат определено методом
кулонометрического титрования, а
высококислородной
границы
шпинельного поля - по данным микроструктурного
и
рентгенофазового
анализов. Используя данные различных
авторов и свои собственные, Ю.Д. Третьяков
построил фазовые диаграммы для целого
ряда шпинелей : NixFe3-x
O4+y,COxFe3-x
O4+y,Mgx
Fe3-x
O4+y,Mnx
Fe3-x
O4+y
.
Изучив
данные этих систем, он пришел к выводу:
если различные по
химическому
составу и степени дефектности ферриты
при какой-либо температуре имеют
одинаковое давление кислорода, то при
любой другой температуре равновесное
давление кислорода одинаково, т.е.
одинакова
величина
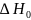 .
Такой вывод позволил Ю.Д. Третьякову
построить универсальную диаграмму
(рис. 3.4), применимую для определения
режима контролируемой атмосферы спекания
ферритов любого химического состава с
произвольной степенью дефектности.
.
Такой вывод позволил Ю.Д. Третьякову
построить универсальную диаграмму
(рис. 3.4), применимую для определения
режима контролируемой атмосферы спекания
ферритов любого химического состава с
произвольной степенью дефектности.
Морино и Паулюс построили фазовые диаграммы для двух ферритов с различным соотношением MnO/ZnO при постоянном содержании оксида железа (рис. 3.6) и определили положение изоконцентрат
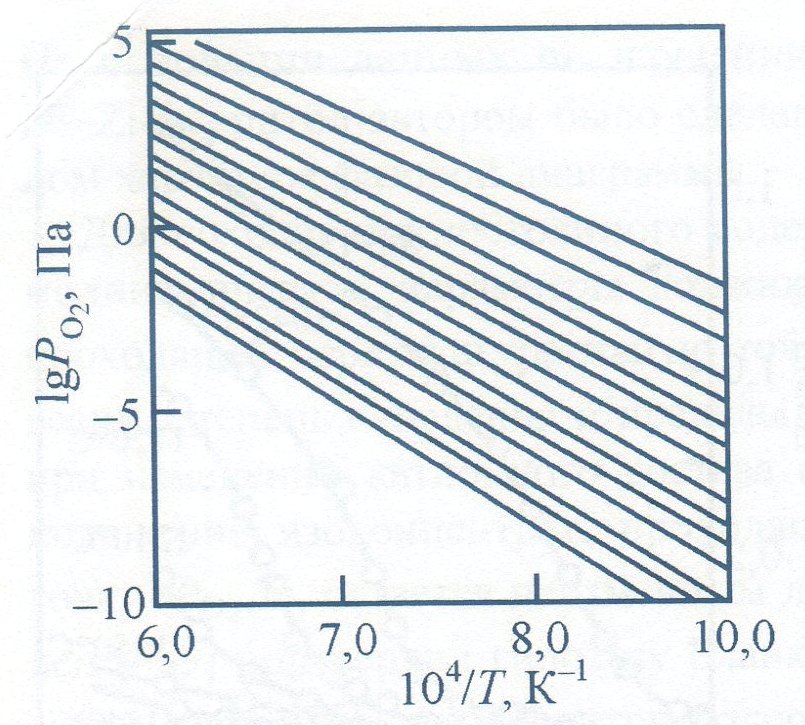
Рисунок 3.5 - Универсальная диаграмма контролируемых атмосфер спекания ферритов со структурой шпинели
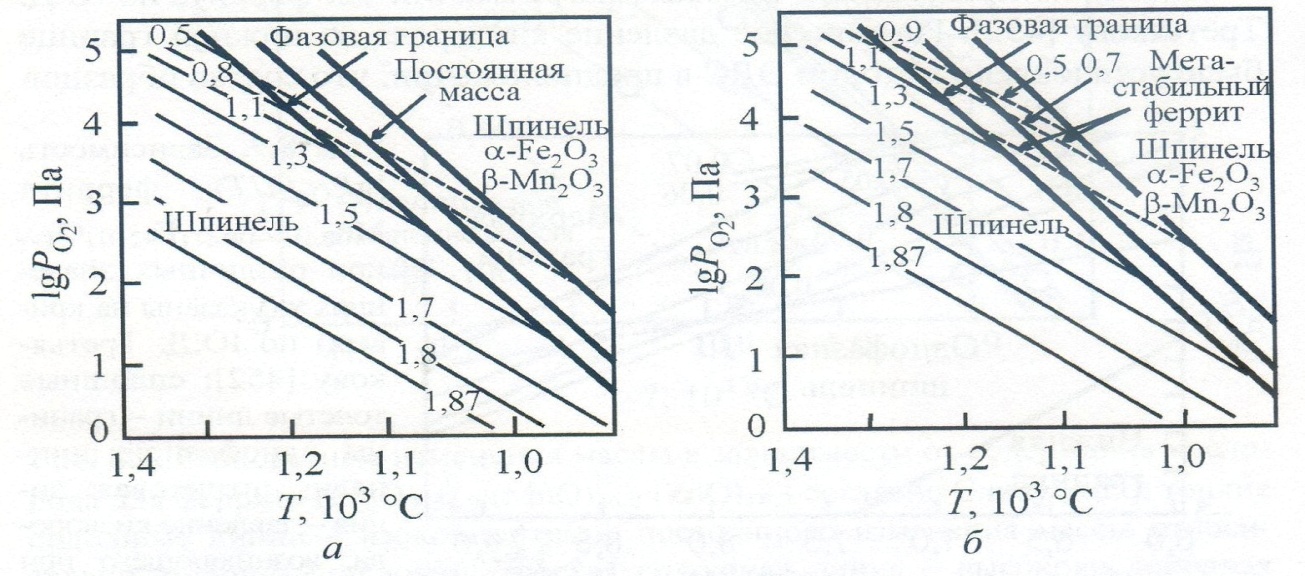
Рисунок 3.6 - Диаграммы lgPo2(l/7) для составов 53Fe2O3-30MnO-17ZnO (а) и 53Fe2O3-26MnO-21ZnO (б)
Таким образом, обзор литературы показывает, что изучению фазовых диаграмм уделено достаточно много внимания. Однако, хотя общие закономерности строения Ро2-Т-фазовых диаграмм Мn—Zn-ферритов выяснены, количественного соответствия между данными разных авторов нет.] Это видно из сопоставления приводимых в литературе положений высококислородных границ и изоконцентрат у = 0 и у= 0,03 (рис. 3.7). Наблюдаемые расхождения трудно объяснить незначительным различием химического состава (табл. 3.1) изучавшихся ферритов. Вызывают сомнение надежность и точность определения абсолютных значений кислородной нестехиометрии.
