
2 Получение ферритовых порошков
2.1 Технология ферритов по методу растворной химии
Основная задача создания оптимальной технологии ферритов состоит в получении материалов с воспроизводимыми, однородными, заданными магнитными и электрическими функциями при минимальных затратах на оборудование, сырьё, электроэнергию и рабочую силу при максимальном выходе годных изделий.
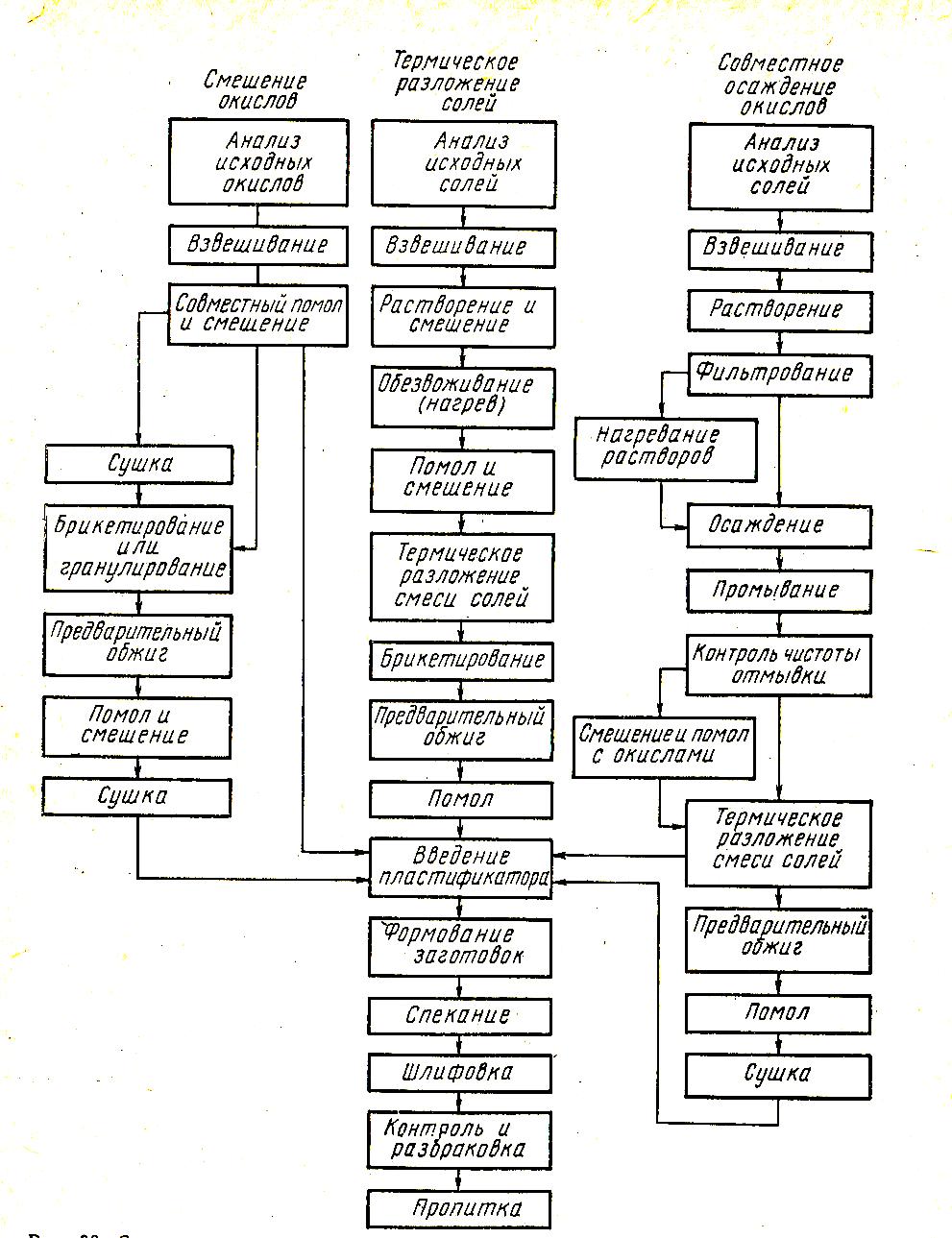
Рисунок 2.7. Схема технологического процесса изготовления ферритов
Технологический процесс является многооперационным и длительным.
При производстве ферритов применяют три основных метода приготовления шихты: 1) метод смешения и помола порошкообразных оксидов (керамический метод); 2) метод термического разложения смеси солей соответствующих металлов до оксидов; 3) метод совместного осаждения углекислых солей или гидрооксидов с последующим термическим разложением их до оксидов [3].
Преимуществами двух последних (химических) методов являются, получение высокогомогенной смеси без помола и смешения, а также обеспечение высокой воспроизводимости ее физико-химических и структурных характеристик.
Недостатком химических методов является необходимость переработки большого количества сырых материалов; кроме того, отходы производства при использовании этих методов загрязняют окружающую среду. При совместном осаждении гидроксидов осадок адсорбирует находящиеся в растворе соли, трудно удаляемые последующей отмывкой и обжигом.
Наиболее распространен метод приготовления шихты из оксидов. К его достоинствам относятся: возможность точного соблюдения заданного состава; отсутствие отходов и соответственно переработка меньших количеств сырья; отсутствие вредных выделений, загрязняющих атмосферу; относительная простота технологической схемы производства.
Недостатком этого метода является необходимость тщательного измельчения и смешения оксидов с целью получения смеси высокой однородности. Последовательность операций при приготовлении ферритов указанными методами показана на рис. 2.7.
Любым из упомянутых способов можно получить ферриты с близкими магнитными свойствами, компенсируя меньшую активность шихты, полученной смешением порошкообразных оксидов, более высокой температурой и продолжительностью обжига.
2.1.1 Метод осаждения солей или гидроксидов
При использовании метода осаждения можно получать продукты реакции в виде солей или гидроксидов. При этом используется раствор солей (сернокислых, азотнокислых) в соотношении, требуемом для получения феррита определенного химического состава. В раствор добавляют осадитель (щелочь, аммиак, углекислый аммоний), в результате чего происходит совместное осаждение продуктов реакции (~50° С), а полученный пастообразный осадок отмывают, отжимают и сушат при 120° С.
Осадок прокаливают при 300 — 800°С; при этой температуре он разлагается на оксиды. Полученную массу размалывают и т. д. Применяют и раздельное осаждение компонентов шихты, осаждение части компонентов или совместное осаждение. Последнее не всегда возможно, так как для полного осаждения каждого гидроксида требуется среда с определенной кислотностью. Полное смешение возможно, когда соосажденные компоненты образуют твердые растворы (в противном случае в осадке образуется механическая смесь кристаллов и степень смешения на молекулярном уровне не может быть достигнута) и когда катионы равномерно распределены по объему кристаллов (это условие невыполнимо, если процесс кристаллизации идет не одновременно).
Совместное и полное осаждение смесей солей невозможно при различной растворимости осажденных компонентов, зависящей от дисперсности осадка и концентрации образующихся растворимых солей, а также из-за различных скоростей кристаллизации отдельных солевых компонентов и образования комплексных соединений, а также неизоморфности соосаждаемых соединений.
Осадки раздельно осажденных компонентов высушивают, взвешивают в требуемой пропорции и тщательно перемешивают. При осаждении части компонентов мокрый осадок смешивают с недостающими оксидами и размалывают. При совместном осаждении всех компонентов осадок высушивают и нагревают до температуры, при которой разлагается наиболее термостойкая составная часть смеси. В результате разложения получается смесь оксидов. Полученные этим методом ферритовые порошки, как правило, являются мелкодисперсными и однородными по составу[3].
2.1.2 Метод термического разложения солей
Материалы, полученные этим методом, в отечественной практике получили название оксиферов. Сырьем служат соли металлов (преимущественно сернокислые), содержащие кристаллизационную воду. В смесь солей, взятых в необходимых количествах для получения феррита заданного состава, добавляют небольшое количество воды. При нагревании смесь расплавляется (60—70° С), кипит (100—120° С) и после выпаривания воды соли затвердевают (300° С). При дальнейшем нагревании (950—1100° С) обезвоженная смесь солей разлагается на оксиды, а образовавшиеся газы улетучиваются. Оставшуюся массу оксидов размалывают.
Для этого метода характерна высокая однородность смешения компонентов шихты. В то же время полная однородность в распределении компонентов по объему практически не достигается, так как растворимость солей разных металлов неодинакова; (при выпаривании из пересыщенного раствора в первую очередь будут выпадать менее растворимые соли) [3].
Технологический процесс получения ферритовых порошков включает следующие основные стадии:
1. Подготовка производства.
2. Подготовка сырьевых материалов.
3. Приготовление шихты (взвешивание сырьевых материалов и помол шихты).
4. Ферритизация шихты.
5.Помол ферритизованной шихты.
2.2 Керамическая технология получения ферритов
Проверяется комплектность и соответствие технологической схемы.
Проверяется наличие смазки, работоспособность механизмов и оборудования, наличие и надёжность защитных ограждений.
Проверяется наличие и исправность защитных заземлений электрооборудования и приборов.
Проверяется наличие и работоспособность контрольно-измерительных приборов, систем автоматического регулирования. Сигнализации и блокировки.
Проверяется исправность и эффективность работы систем приточно-вытяжной вентиляции и аспирации.
Устраняются обнаруженные неисправности механизмов, оборудования и систем автоматики.
Проверяется наличие сырья, материалов и их соответствие требованиям нормативных документов.
Проверяется наличие на рабочих местах средств индивидуальной защиты и их исправность [7].
2.2.1 Подготовка сырьевых материалов
В качестве исходного сырья для производства марганец-цинковых ферритовых порошков применяют железо (ІІІ) оксид, марганца (ІІ, ІІІ) оксид, белила цинковые.
Железо (ІІІ) оксид поступает в цеховой склад в одноразовых мягких контейнерах типа МКР-1. во избежение случайного увлажнения хранимого в цеховом складе сырья, последнее должно храниться на поддонах.
Оксид марганца и цинковые белила поступают в 25-30 кг полиэтиленовых мешках.
Из поступающего в цеховой склад сырья лаборант цеха специальным пробоотборником отбирает пробы от каждой партии сырья для определения массовой доли основного вещества и химического анализа согласно техническим условиям на сырьё.
Оксид марганца разных партий перед подачей на шихтовку подвергают усреднению в барабанном смесителе типа с рабочей поверхностью 1,0 м3/поз.1/. смеситель представляет собой цилиндрический корпус, расположенный под наклоном 300 к штативу, на котором закреплён двигатель. Двигатель соединён с барабаном при помощи ременного привода. Таким образом, при работе двигателя, барабан вращается в виде гироскопа. Такое вращение барабана обеспечивает равномерное по всему объёму порока перемешивание. Процесс усреднения длится от 1 до 2 часов. Усреднённый после анализа на содержание основного вещества выгружают в бумажные барабаны [7].
2.2.2 Приготовление шихты
Взвешивание сырьевых компонентов осуществляют на платформенных весах, пределы взвешивания 0,5-1000кг. Для подачи мешков и барабанов с сырьём на платформу весов используют электротельфер. Для удобства взвешивания оксида железа его пересыпают из мягкого контейнера в барабаны по 30кг. При взвешивании определяют массу нетто по разности масс заполненных и опорожненных барабанов с сырьём.
Количество компонентов шихты (кг) рассчитывают, исходя из количества марганец-цинкового ферритового порошка, который необходимо получить как конечный продукт, по следующим формулам:
а) масса оксида железа в шихте рассчитывается по формуле:
![]()
где
m1 - масса марганец-цинкового ферритового порошка, кг.;
m2 - массовая доля Fe2O3 в составе феррита, %;
m3 - массовая доля основного вещества в исходном оксиде железа по анализу, %.
б) масса оксида марганца (ІІ, ІІІ) в шихте рассчитывается по формуле:
![]()
где
m1 - масса марганец-цинкового ферритового порошка, кг;
m2 - массовая доля MnO в составе феррита, %;
m3 - массовая доля MnO в исходном оксиде марганца по анализу, %.
в) масса цинковых белил в шихте рассчитывается по формуле:
![]()
где
m1 - масса марганец-цинкового ферритового порошка, кг;
m2 - массовая доля ZnO в составе феррита, %;
m3 - массовая доля основного вещества в исходных цинковых белилах по анализу, %.
Для смешения и
помола шихты используют вибромельницу
типа М-400 с максимальной загрузкой 400
кг. Мощность мельницы 45 кВт. Мельница
представляет собой горизонтальный
стальной барабан диаметром 1м и длиной
2м. внутри камеры мельницы находятся
стальные шары диаметром от 10 до 30мм (в
любом соотношении). Общая масса загружаемых
шаров составляет 25% от объёма барабана,
при этом расстояние от нижней кромки
загрузочного люка до поверхности шаровой
загрузки барабана должно составлять
(1000![]() 30)мм.
При вибрационном движении барабана
мельницы стальные шары внутри мельницы
смешивают и измельчают шихту [6].
30)мм.
При вибрационном движении барабана
мельницы стальные шары внутри мельницы
смешивают и измельчают шихту [6].
Для лучшего перемешивания компоненты шихты засыпают в загрузочный люк вибромельницы слоями: оксид железа, оксид марганца, цинковые белила и т.д.
Для улучшения поверхностно-активных свойств шихты при помоле в конце загрузки в мельницу добавляют 200мл триэтаноламина, разбавленного с дистиллированной водой в соотношении 1:1. помол шихты производят в течении 1-2 часов.
Как загрузка, так и помол шихты осуществляют при включённой вентиляции.
По окончании помола через верхний люк мельницы отбирают пробу шихты для анализа её химического состава и удельной поверхности. В случае несоответствия химического состава заданному осуществляют корректировку состава шихты введением необходимых компонентов. Корректировка шихты производится по компоненту, которого по данным анализа в составе больше.
Как в случае корректировки шихты, так и в случае несоответствия регламенту величины удельной поверхности шихты( 0,7-0,9м2/г), производят дополнительный помол в течении одного часа. Затем анализ шихты повторяют.
Шихту, соответствующую требованиям регламента по составу и удельной поверхности, через нижний люк вибромельницы выгружают в барабаны и подают на туннельную печь для ферритизации [7].
2.2.3 Ферритизация шихты
Для ферритизации шихты используется электрическая туннельная печь «Диффузор». Нагрев продукта в рабочем пространстве электропечи осуществляется силитовыми нагревательными элементами, расположенными на боковых стенках нагревательной камеры по зонам. Туннельная нагревательная камера имеет семь температурных зон.
Таблица 2.1 Температурные зоны туннельной нагревательной камеры
Температура по зонам печи,°С |
Скорость нагрева по зонам печи,град/час |
1зона-370 |
143,9 |
2зона-510 |
213,8 |
3зона-720 |
158,9 |
4зона-980 |
218,4 |
5зона-980 |
0 |
6зона-980 |
0 |
7зона-980 |
0 |
Марганец-цинковую шихту подают в туннельную печь в керамических кюбелях по семь кг, которые продвигаются по зонам печи при помощи толкателя с интервалом в 20 минут.
Таким образом, шихта при прохождении через туннельную печь медленно нагревается до температуры ферритизации 9800С, а в конце печи медленно остывает. Ферритизованную шихту из кюбелей ссыпают в барабаны и подают на стадию вторичного помола на вибромельницу М-400.
2.2.4 Помол ферритизованной шихты
Перед вторичным помолом шихты, её взвешивают в барабанах на платформенных весах для определения веса нетто, который должен быть равен запланированной на стадии приготовления шихты величине массы марганец-цинкового ферритового порошка, с учётом потерь при ферритизации и потерь в виде россыпей при транспортировке.
Таблица 2 Характеристика исходного сырья для пр-ва ферритовых изделий
Сырьё |
Стандарт, ТУ, регламент |
Показатели для проверки |
Регламентир. показатели |
1. Железо (III) оксид для магнитомягких ферритов «чистый» МТВ, МР-1 Железо (III) оксид для ферритов «чистый» ММ-1
|
ТУ 14-15-228-90
ТУ-6-09-4783-83 ГОСТ 202-84 ТУ 6-02-916-79 ГОСТ 10779-78 |
Массовая доля, % : Fe 2 O3 Si Са
Коэффициент усадки в пределах Массовая доля, % : Fе2О3 Si Са Массовая доля, % : МnО Са Массовая доля ZnO В состоянии поставки В состоянии поставки |
не менее 99,2 не более 3 10-2 не более 2 10-2
1,12±1 10-2 не менее 99,2 8 10-3-2 10-2 8 10-3-2 10-2
90 не более 2 10 не менее 99,6
|
Процесс помола ферритизованной шихты аналогичен процессу помола шихты на стадии её приготовления.
Измельчённый марганец-цинковый порошок анализируют на соответсвие её требованиям ТУ на удельную поверхность и процентного содержания его основных компонентов.
В случае удовлетворительного результата ферритовый порошок выгружают в бумажные барабаны, которые по мере необходимости используют для получения ферритовых изделий [7].
2.2.5 Методы синтеза ферритовых порошков
Трудности получения ферритов с воспроизводимыми свойствами в основном связаны с самой природой этих материалов, являющихся фазами переменного состава. Многие свойства ферритов определяются не только соотношением основных компонентов, но и термодинамическими параметрами синтеза, важнейшими из которых являются температура и давление кислорода в газовой фазе. Поэтому необходимо установить и использовать на практике соотношения между внешними параметрами и состоянием системы. Большое значение имеет изучение равновесных диаграмм состояния, природы атомных дефектов и механизма их возникновения, исследование термодинамических и термохимических свойств ферритов, установление кинетических закономерностей и механизмов формирования фаз переменного состава.
Многие физические свойства ферритов являются структурно-чувствительными и зависят от условий формирования структуры при спекании и изменения ее в присутствии микропримесей или в ходе дополнительной термообработки.
Ферритовые порошки чаще всего получают керамическим методом, в котором при повышенной температуре осуществляется твердофазная реакция с образованием однофазного продукта
![]()
Степень ферритизации порошковой смеси существенно зависит от свойств исходных оксидов и условий механической гомогенизации. По данным рентгенофазового анализа, для одной и той же ферритовой композиции изменение указанных условий при постоянных температуре и продолжительности нагрева может приводить к колебаниям степени ферритизации от 20 до 80%. Присутствие в продуктах реакции исходных оксидов отрицательно сказывается на последующих процессах спекания. Вместе с тем повышение температуры, способствующее увеличению степени ферритизации, крайне нежелательно из-за существенного снижения активности порошков. Повторное измельчение и дополнительные обжиги, имеющие целью более полно гомогенизировать смесь оксидов и облегчить диффузию ионов в процессах ферритообразоваиия, часто сопряжены с такими изменениями исходной смеси, которые трудно оценить количественно. К числу таких изменений относится загрязнение смеси материалом мельницы при его истирании, гидратация оксидов, частичное их восстановление или окисление. Таким образом, используемые в керамической технологии приемы гомогенизации ферритовых порошков неизбежно приводят к дополнительному появлению неоднородностей. Так, если при помоле шихта загрязняется оксидов, образующими легкоплавкую эвтектику с основными компонентами системы, то качество ферритовой шихты резко ухудшается из-за анизотропного роста зерен при спекании и сопутствующего ему изменения магнитных характеристик [3].
Необходимо также отметить еще один существенный недостаток, присущий керамическому методу, — наличие остаточной химической неоднородности однофазных продуктов твердофазного синтеза, которые приводят к флуктуациям физических свойств, чувствительных к изменениям химического состава феррита.
Известное развитие получили варианты керамического метода, в котором в качестве исходных сырьевых материалов используют смеси сульфатов, нитратов, карбонатов и гидроксидов, подвергаемые термическому разложению после тщательного смешения и измельчения.
При правильном выборе режима разложения (скорости и продолжительности нагрева) процессы образования оксидов и ферритизацию удается совместить в сравнительно узком температурном интервале. Оксиды, получаемые разложением солей, в момент образования имеют высокую степень дефектности и большую подвижность элементов структуры, повышенную реакционную способность.
Так, термическое разложение смеси
0,4 моля NiSO4 · 7H2O + 0,6 моля ZnSO4 · 7H2O + 2 моля FeSO4 · 7H2O
приводит
к получению никельцинкового феррита
![]() .
При
этом температурный интервал разложения
практически совпадает
с образованием однофазного ферритового
продукта. Метод,
основанный на использовании солевых
смесей, не всегда решает
до конца задачу получения ферритов с
гомогенным распределением компонентов
[3].
.
При
этом температурный интервал разложения
практически совпадает
с образованием однофазного ферритового
продукта. Метод,
основанный на использовании солевых
смесей, не всегда решает
до конца задачу получения ферритов с
гомогенным распределением компонентов
[3].
Интенсивно развиваются методы получения ферритовых порошков из твердых растворов солей и гидроксидов. В таких растворах, а также в продуктах их термического разложения ферритообразующие компоненты находятся в более высокой степени смешения, чем в системе, образованной из смеси солей.
Существующие методы получения твердых растворов солей (гидроксидов) основаны на равновесной или неравновесной кристаллизации.
Равновесную кристаллизацию осуществляют: 1) методом изотермического и изоконцентрационного снятия микропересыщений и 2) методом изотермического и изоконцентрационного испарения растворителя.
Методы неравновесной кристаллизации используют один из перечисленных ниже приемов: 1) соосаждение в форме малорастворимых соединений, 2) замену растворителя, 3) распылительную сушку, 4) криохимическую кристаллизацию.
2.2.5.1 Метод изотермического и изоконцентрационного снятия микропересыщений
К раствору, насыщенному при температуре T1, прибавляют при интенсивном перемешивании небольшие порции другого раствора, имеющего температуру Т2 (Т2 > T1) и более высокую концентрацию. Если концентрации компонентов подобраны соответствующим образом, то при быстром снятии микропересыщений в микрообъеме из раствора выпадают кристаллы, в которых соотношение солевых компонентов отвечает получаемому ферриту.
2.2.5.2 Метод изотермического и изоконцентрационного испарения
Непрерывное испарение растворителя из раствора, равновесного с кристаллами заданного состава. По мере удаления растворителя и отбора выпадающих кристаллов концентрация маточного раствора постоянно корректируется добавлением насыщенного раствора, соотношение солевых компонентов в котором отвечает кристаллизуемой соли [3].
2.2.5.3 Методы соосаждения
Основаны на осуществлении химических реакций, приводящих к соосаждению железа с другими феррито-образующими компонентами в форме нерастворимых или мало растворимых солей или гидроксидов
![]()
Очевидно, что однородность солевых твердых растворов, кристаллизующихся в сильно пересыщенной (неравновесной) системе, образующейся при смешении раствора легкорастворимых солей ферритообразующих компонентов с осадителем, зависит от растворимости и скорости кристаллизации отдельных солевых компонентов. При значительной разности этих величин ожидать получения совершенно однородных кристаллов практически невозможно.
2.2.5.4 Метод замены растворителя
Основан на эффекте «высаливания» — резком уменьшении растворимости солей в водно-органических смесях по сравнению с чистой водой. Метод замены растворителя удобней всего применять к солям, которые обладают высокой растворимостью в воде и практически нулевой растворимостью в водно-органических смесях с малым содержанием органического компонента. Органические вещества, используемые в качестве высаливающего агента, должны обладать неограниченной взаимной растворимостью с водой и относительно высоким давлением паров при комнатной температуре, способствующим быстрому испарению молекул органического вещества с поверхности кристаллизованной солевой массы. Этим условиям в полной мере отвечает ацетон, который чаще всего используют для гомогенизации ферритообразующих компонентов методом замены растворителя (можно использовать также этиловый, изопропиловый спирт и др.).
2.2.5.5 Распылительная сушка
Диспергирование исходного раствора в потоке теплоносителя. В большинстве известных вариантов распылительной сушки теплоносителем является нагретый воздух. Естественно, что малая скорость испарения растворителя крайне нежелательна из-за возможности дробной кристаллизации солевых компонентов из раствора. Вместе с тем дробную кристаллизацию можно устранить лишь при очень больших скоростях испарения растворителя. Метод распылительной сушки был успешно применен для получения марганец-цинковых ферритов из сульфатных растворов при относительно невысоких температурах теплоносителя в зоне распыления (280—300° С).
2.2.5.6 Криохимический метод
Распыление растворов солей ферритообразующих компонентов в жидкий, не смешивающийся с растворителем хладоагент. Быстрое замораживание отдельных капель раствора позволяет получить собственно криохимический продукт, представляющий собой мелкие криогранулы, имеющие, как правило, сферическую форму с достаточно равномерным распределением исходных солевых компонентов по их объему. Удаление растворителя из продукта криохимического синтеза производят путём сублимации льда при низких давлениях и температурах, не превышающих температур плавления криогранул. Схема метода представлена на рис. 2.8
Равновесные методы кристаллизации имеют довольно узкую область применения, ограниченную возможностью образования солевых твердых растворов. Среди солевых твердых растворов, в состав которых входят ферритообразующие компоненты, необходимо отметить твердые растворы солей типа шенитов, оксалоаммониевые комплексные соли и т. д.
Равновесные методы кристаллизации неприменимы, если солевые компоненты не образуют твердые растворы.

Рисунок 2.8. Схема криохимического метода гомогенизации ферритообразующих компонентов
Так, большинство сульфатов или нитратов ферритообразующих компонентов не образуют между собой солевые твердые растворы. Поэтому применение равновесных методов к таким системам не обеспечит их гомогенизации — продукт кристаллизации будет представлять собой механическую смесь индивидуальных сульфатов или нитратов.
Для ферритообразования соосажденных гидроксидов предложена следующая процедура: сразу же после осаждения гидроксид железа превращается в липидокрокит пропусканием воздуха через водную суспензию гидроксидов
2Fe(OH)2 + ½ O2 = 2FeOOH = H2O
Образующаяся рентгеноаморфная масса при старении дегидратируется и переходит в упорядоченное состояние, свойственное структуре феррита. Скорость ферритизации зависит как от степени неоднородности растворов, так и от способности отдельных гидроксидов к дегидратации. Если хотя бы один из компонентов системы легко дегидратируется, это свойство в известной мере присуще и твердому раствору. А устойчивость к дегидратации обоих компонентов системы затрудняет процесс старения и образования ферритов.
2.2.5.7 Электрохимический метод
Имеет несомненное преимущество перед обычным методом соосаждения гидроксидов. Он позволяет периодический процесс осаждения сделать по существу непрерывным, так как при электролизе происходит саморегенерация осадителя.
При получении ферритов анодным растворением металлов отпадает необходимость в их предварительной очистке, поскольку переход отдельных компонентов в осадок происходит лишь при определенных значениях электродного потенциала. Так как рН раствора в процессе осаждения практически не изменяется, как это имеет место при химическом осаждении, можно ожидать, что полученные осадки гидроксидов или оксидов отличаются высокой степенью гомогенности [3].
2.2.5.8 Оксолатный метод
Оксалаты двухвалентных металлов изоморфны друг другу и образуют непрерывные или ограниченные ряды твердых растворов. Из числа распространенных ферритообразующих элементов лишь медь и литий не входят в эти растворы. Термическое разложение смешанных оксалатов на воздухе при сравнительно невысоких температурах (Т < 500° С) приводит к образованию феррита по схеме:
![]()
Серьезный недостаток оксалатного метода получения ферритовых порошков — значительное различие скорости осаждения индивидуальных оксалатов. Даже при больших пресыщениях, создаваемых смешением достаточно концентрированных растворов, содержащих ионы Me2+ и C2O42-, отдельные оксалаты переходят в осадок дифференцированно и весь цикл кристаллизации завершается лишь через несколько часов.
В соосажденных оксалатах первые порции кристаллов обогащены легко кристаллизующимися компонентами, а последние — трудно кристаллизующимися. Вместе с тем оптимизация условий осаждения оксалатов дала возможность в ряде случаев получить достаточно однородные ферритовые порошки.
Помимо метода соосаждения, оксалаты можно использовать в методах распылительной сушки, замены растворителя и криохимической кристаллизации.
Получение смешанных оксалатов взаимодействием суспензии оксидов, гидроксидов или карбонатов двухвалентных металлов с щавелевой кислотой. Такое взаимодействие уже при комнатной температуре протекает практически до конца образования недиссоциированных Н2О или летучих СО2 продуктов. Достоинством метода является отсутствие каких-либо загрязнений (неизбежных при осаждении оксалатов из растворимых солей) и полное соответствие исходного состава материала составу продукта. К сожалению, оксид железа не может быть соосажден в форме оксалата и вводится дополнительно.
Соосаждение ферритообразующих катионов бикарбонатом аммония лежит в основе внедренного в промышленность способа получения марганец-цинковых ферритовых порошков [3].
Сульфаты и нитраты большинства ферритообразующих элементов хорошо растворимы в воде и практически не образуют солевых твердых растворов. Сульфаты и нитраты не нашли применения в методах замены растворителя и распылительной сушки, так как ферритовые порошки, полученные этими методами, имеют значительные флуктуации состава. Вместе с тем применение метода криохимической кристаллизации позволяет в случае необходимости получать оптически прозрачную керамику из порошков, синтезированных в свою очередь из высокооднородных механических смесей сульфатов.
Возможность использования сульфатов и нитратов для гомогенизации ферритообразующих компонентов в полной мере относится и к другим растворимым солям, включая хлориды, бромиды, формиаты и ацетаты.
Соли типа шенитов с общей формулой Me2+ N2+ (RO42-)2 · 6H2O использовали для гомогенизации ферритообразующих компонентов методами как равновесной, так и неравновесной кристаллизации.
Способность к образованию непрерывных рядов твердых растворов при любых соотношениях компонентов, по-видимому, связана с большим размером элементарной ячейки шенитов, превосходящим этот параметр для других солей. Другое преимущество шенитов — хорошая растворимость в воде, резко изменяющаяся с изменением температуры. Оба свойства шенитов легли в основу равновесных методов получения изоморфных смесей. Одновременно с этим твердые растворы солей типа шенитов с успехом используют в методах замены растворителя и криохимической кристаллизации. Эффективность шенитных твердых растворов как исходных веществ для получения высокогомогенных ферритовых порошков была показана на примерах Мg—Мn, Ni—Со, Ni—Zn и других ферритов.
Таким образом, одна и та же ферритовая композиция может быть получена различными методами. При выборе конкретной формы исходных соединений и конкретного метода гомогенизации ферритообразующих компонентов следует учитывать следующие факторы: 1) простоту и доступность метода; 2) экономичность; 3) воспроизводимость; 4) возможность получения ферритового порошка с высокой химической однородностью; 5) возможность получения ферритового порошка с высокой активностью к спеканию [3].
