
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД
“ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ”
Кафедра “Прикладної екології та охорони навколишнього середовища ”
Самостійна робота
з дисципліни “Фізична хімія ТНСМ”
Опис та практичне використання одно- , двух- ,
трикомпонентних діаграм стану
Виконав студент гр. ТТМ – 09 Максаков М. В.
Перевірив Прилипко Ю.С.
Донецьк, 2012
Реферат
Самостійна робота: сторінок – 28 , таблиць – 1, рисунків – , джерел -
Мета роботи – охарактеризувати однокомпонентні, двокомпонентні та трикомпонентні фазові діаграми. В роботі розглянуті і описані діаграми стану двокомпонентні: MgO-Cr2O3; CaO-SiO2; та трикомпонентні: MgO-Al2O3-SiO2. Також розглянуті їхні основні модифікації.
ОДНОКОМПОНЕНТНА, ДВОКОМПОНЕНТНА, ТРИКОМПОНЕНТНА, ДІАГРАМИ СТАНУ, ЕВТЕКТИКА, МОДИФІКАЦІЯ
ЗМІСТ
Вступ……………....………………………………………………………..4
1. Однокомпонентні системи …..………...………....................………..……….5
2. Двокомпонентні системи …………………..............................................…8
2.1. Діаграма стану двокомпонентної системи з евтектикою……………
3. Двухкомпонентная система CaO-SiO2…………………..........................14
4. Двокомпонентна система MgO-Cr2O3………………....................................17
5 Трикомпонентна система СаО—А12О3—SiО2…………..……...................19
ВИСНОВКИ..........................................................................................................22
Перелік посилань…………………………………........................................23
ВСТУП
Фізична хімія Тугоплавких Неметалевих і Силікатних Матеріалів - міждисциплінарний розділ науки.
Трикомпонентні системи являють собою численні з'єднання різних сполук, утворених чистими металами, їхніми оксидами й солями. Завдяки тому, що діаграми цих систем дають можливість уявити процес утворення та кристалізації як окремих речовин, так і різних сполук, трикомпонентні системи пояснюють нам ті процеси, які відбуваються в надрах землі при утворенні мінералів. Крім того, ці системи дають можливість передбачити хід і напрямок ряду хімічних процесів у технологічній практиці різних виробництв.Діаграми трикомпонентних систем широко використовуються в кольоровій та чорніїі металургії, в технології виготовлення різних будівельних матеріалів.
Вивчення діаграм стану двокомпонентних систем має велике практичне значення у будівництві, металургії, металознавстві та інших галузях.
При переходах із рідкого у твердий стан двокомпонентні системи можуть утворювати механічні суміші, тверді розчини або хімічні сполуки. Двокомпонентні системи характеризуються чотирма термодинамічними параметрами: температурою, тиском і концентраціями обох компонентів.
1. Однокомпонентні системи
В однокомпонентних системах фази складаються з однієї речовини в річних агрегатних станах. Для однокомпонентних систем (К = 1) правило фаз матиме вигляд:
С = K - Ф + 2 = 3 - Ф.
Мінімальне число фаз дорівнює одиниці Фmin = 1, йому відповідає максимальне число ступенів вільності Сmax = 2, тобто рівноважний стан системи визначається двома змінними: тиском і температурою.
Мінімальному числу ступенів вільності Сmin = 0, відповідає максимальне число фаз, які знаходяться в рівновазі: Фmax = 3, таким чином, одночасно в рівновазі може існувати три фази: рідка, тверда і газоподібна або інші.
Діаграма, яка характеризує залежність стану системи й фазової рівноваги в ній від 'зовнішніх умов або від її складу, називається діаграмою стану або фазовою діаграмою. Вона будується експериментальним шляхом.
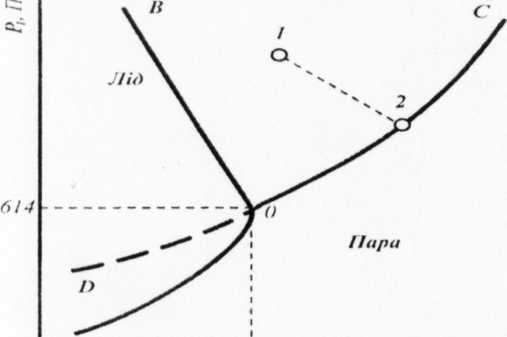
Рис. 1. Діаграма стану води
На рис. 1 наведена діаграма стану води в області середнього тиску. Три криві розбивають діаграму на поля, кожне з яких відповідає існуванню води в одному з трьох агрегатних станів: парі, рідині або твердій фазі. Криві відповідають рівновазі між відповідними двома фазами.
Крива ОС характеризує залежність тиску насиченої пари
рідкої фази від температури і називається кривою випаровування; крива ОВ показує залежність температури замерзання води від зовнішнього тиску і називається кривою плавлення, крива OA встановлює залежність тиску насиченої пари твердої фази від температури і називається кривою сублімації.
Точка О характеризує умови одночасної рівноваги між парою, твердою фазою (кригою) і рідкою водою і називається потрійною точкою.
Для однофазної області, позначеної, наприклад, точкою 1, число ступенів вільності С = 3 - 1 = 2. Це означає, що у відомих межах можна змінювати незалежно два параметри: температуру й тиск, і при цьому не відбуваються зміни числа й виду фаз системи.
У точці 2 на кривій ОС число ступенів вільності С = 3 - 2 = 1, тобто на кривій ОС можна змінювати один із параметрів (або температуру, або тиск). При цьому друга змінна повинна змінюватися відповідно до першої за рівнянням Клапейрона-Клаузіуса.
У точці 0 у рівновазі співіснують три фази й число ступенів вільності С = 3 - 3 = 0, система безваріантна. Це означає, що три фази води можуть знаходитися в рівновазі тільки за визначених умов: тиск р = 614 Па й температура t = 0,0075°С. За умов стандартного атмосферного тиску лід плавиться при температурі 0°С, тобто при більш низькій температурі, ніж у потрійній точці. Це пояснюється тим, що питомий об'єм льоду більший, ніж води, й відповідно до рівняння Клапейрона-Клаузіуса крива рівноважного співіснування води й льоду нахилена вліво, тобто при зниженні тиску температура плавлення підвищується.
Якщо до системи в потрійній точці підводити тепло, то воно буде витрачатися на плавлення льоду, але ні температура, ні тиск пари не зміниться до тих пір, поки в системі співіснують три фази, оскільки С = 0. Коли весь лід розплавиться, то залишаться дві рівноважні фази: рідина й пара. Система стане одноваріантною (С = 1) і при подальшому нагріванні процес піде відповідно до кривої ОС.
Охолодження системи в потрійній точці сприяє утворенню льоду і поки вся вода не перетвориться в лід, температура й тиск пари будуть залишатися сталими. При подальшому охолодженні системи, коли залишиться тільки дві фази (лід і пара), система стає одноваріантною і процес конденсації пари йде відповідно до кривої OA.
Продовження кривої ОС на діаграмі пунктирною лінією являє собою криву тиску насиченої пари над переохолодженою рідиною. Пружність пари над переохолодженою рідиною більша від пружності пари над кристалами. Тому переохолоджена рідина є системою нестійкою і може самочинно переходити в кристалічний стан. Такий термодинамічно нестійкий, нерівноваж-ний стан називається метастабільним (лабільним). До нього правило фаз не застосовується.
Відзначимо, що криву тиску насиченої пари над речовиною у твердому стані (AO), яка називається кривою сублімації, не можна продовжити правіше точки 0, оскільки перегріті кристали отримати неможливо. При підвищенні температури коливання молекул, які утворюють кристал, досягають такої амплітуди, що решітка руйнується і кристал плавиться.
